Работа № 17. Определение скорости коррозии металла газометрическим методом
Похожие статьи вашей тематики
Цель работы – изучение механизма протекания электрохимической коррозии и определение коррозионной стойкости:
а) железа в слабокислой среде; б) алюминия в щелочной среде.
Оборудование
1. Специальная бюретка (см. рис. 6.6) с отводом к водоструйному насосу и расширенной нижней частью, в которой находится стеклянный крючок для подвешивания образца исследуемого металла.
2. Стакан с раствором серной кислоты H2SO4 или щелочи NaOH.
3. Металлическая пластинка (Fe или Al).
Последовательность выполнения работы
1. Измерить с двух сторон с помощью линейки площадь металлической пластинки.
2. Зачистить пластинку наждачной бумагой, промыть проточной водой и просушить фильтровальной бумагой.
3. Подвесить образец под колпак бюретки на крючок и опустить расширенную часть бюретки с подвешенным образцом в стакан с раствором кислоты (щелочи) при открытом верхнем кране бюретки.
4. Включить водоструйный насос (в присутствии лаборанта!), отвернув водопроводный кран. Когда раствор электролита поднимется в бюретке до верхних делений, закрыть кран бюретки и выключить водоструйный насос. Отметить первоначальный уровень жидкости в бюретке.
5. В течение 100 мин через каждые 20 мин. отмечать положение уровня мениска жидкости. Полученные данные занести в таблицу.
6. По окончании замеров открыть кран бюретки, извлечь образец, промыть водой и удалить с него остатки воды фильтровальной бумагой.
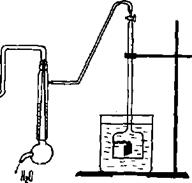
Рис. 6.6. Установка для определения скорости коррозии металла
По полученным экспериментальным данным
1. Построить график зависимости объема выделившегося водорода от продолжительности испытания.
2. Рассчитать скорость коррозии (массовый показатель) за 100 мин. в г/м2∙час, при этом убыль массы образца Δm  рассчитать по закону эквивалентов, учитывая, что при растворении I г/экв металла выделяется 11,2 л водорода. рассчитать по закону эквивалентов, учитывая, что при растворении I г/экв металла выделяется 11,2 л водорода.
3. Рассчитать глубинный показатель в мм/год и оценить стойкость образца по шкале баллов стойкости.
| Металл
| 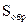 ,
м2 ,
м2
| 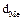 ,
г/см3 ,
г/см3
| τ,
мин
| Положение
мениска,
мл
| 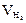 ,
мл ,
мл
| 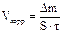 ,
г/м2∙час ,
г/м2∙час
| |
|
|
|
|
|
|
|
Глубинный показатель_____
Балл стойкости____________
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Объясните на конкретных примерах механизм химической и электрохимической коррозии.
2. Напишите электрохимические процессы, протекающие при нарушении: цинкового и оловянного покрытий на железе, эксплуатирующегося в атмосферных условиях.
3. Какие активаторы коррозии алюминия и железа вам известны?
4. Объясните влияние на коррозию металлов ионов Н+.
5. Какая алюминиевая пластинка корродирует интенсивнее в контакте:
а) с железом; б) с медью?
|