Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа № 1. Определение эквивалента металла газометрическим методомСодержание книги
Поиск на нашем сайте
А. Теоретическое введение Эквивалентом элемента называют такую его массу, которая без остатка взаимодействует с одной массовой частью (м.ч.) атомов водорода или с восемью м.ч. атомов кислорода или же замещает указанное количество водорода и кислорода в химических реакциях. Из определения следует, что эквивалент водорода равен 1 м.ч. (или 1 г, в этом случае его называют грамм-эквивалентом), а эквивалент кислорода─ 8 м.ч. (8 г). Эквиваленты можно выразить через объемные единицы. В этом случае необходимо применить закон Авогадро: «В равных объемах различных газов или паров при одинаковых внешних условиях (температура и давление) содержится одинаковое количество молекул» и его следствия. Например, 1 моль любого газа при нормальных условиях (н.у.) содержит 6,02∙1023 молекул – число Авогадро (NА) и, как следствие, один моль любого газа (при н.у.) занимает объем 22,4 л. В связи с тем, что водород и кислород – газы, то в расчетах эквивалентов элементов можно сравнивать их количества не с массами эквивалентов этих газов, а с объемами их эквивалентов. Так как масса г-эквивалента водорода равна 1/2 массы моля водорода, а масса г-эквивалента кислорода равна 1/4 массы моля кислорода, следовательно, согласно закону Авогадро: Эквиваленты элементов (Fe, Zn, Ca, Cu и др.) рассчитываются по формуле Э = А/В, где «А» ─ атомная масса элемента, «В» ─ степень его окисления, т.е. его валентность. Например, г-эквивалент меди в оксиде меди CuO или в соли CuSO4 равен Э(Cu)= Эквиваленты «сложных» веществ (оксидов, оснований, кислот, солей) рассчитываются следующим образом. Эквивалент кислоты равен отношению молекулярной массы кислоты (М) к ее основности (т.е. числу атомов водорода, участвующих в данной реакции). Например, г-эквивалент серной кислоты (в том случае, если в реакции участвуют два атома водорода) рассчитывается по формуле Эквивалент основания равен отношению молекулярной массы щелочи (М) к ее кислотности (т.е. числу групп ОН-, участвующих в данной реакции). Например, г-эквивалент гидроксида натрия рассчитывается по формуле Эквивалент соли равен отношению молекулярной массы соли (М) к произведению числа атомов металла, входящих в состав соли, на его валентность. Например, г-эквивалент сульфата алюминия Al2(SO4)3 рассчитывается по формуле:
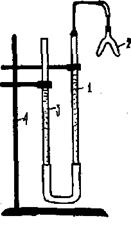
Эквиваленты можно определить, используя один из основных стехиометрических законов химии – закон эквивалентов, которому подчиняются все реагирующие между собой вещества. Как простые, так и сложные: «Все вещества реагируют друг с другом в эквивалентном количестве, то есть количества эквивалентов каждого из участников реакции равны между собой». Для реакции, протекающей согласно уравнению a ∙A + b ∙B = d ∙D + f ∙F, закон эквивалентов запишется следующим образом: Так как количество эквивалентов вещества n, содержащихся в определенной его массе, равно откуда следует, что массы реагирующих веществ пропорциональны их эквивалентам: Для веществ, реагирующих в растворах, закон эквивалентов можно выразить формулой где NA и NB – нормальные концентрации растворов веществ А и В, выраженные в г-экв/л; а VA и VB – объемы растворов, л Б. Экспериментальная часть Цель работы ─ изучение практической значимости закона эквивалентов для стехиометрических расчетов и определение с помощью газометрического метода эквивалента и атомной массы металла с известной валентностью. Оборудование Прибор для проведения эксперимента (рис. 6.1), включающий: ● «рабочую» (1) и «вспомогательную» (3) бюретки, заполненные водой и соединенные резиновым шлангом (сообщающиеся сосуды); ● двухколенную (2) пробирку, герметически присоединяемую к прибору во время эксперимента к «рабочей» бюретке; ● штатив (4) для крепления установки.
Рис. 6.1. Прибор для определения эквивалента металла газометрическим методом
|
|||||
|
Последнее изменение этой страницы: 2021-03-10; просмотров: 332; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.4.99 (0.01 с.) |

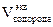 = 11,2 л
= 11,2 л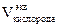 = 5,6 л.
= 5,6 л.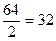 г.
г.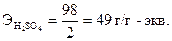
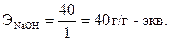
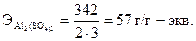
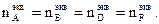
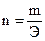 , то закон эквивалентов можно записать иначе:
, то закон эквивалентов можно записать иначе: 
 ,
,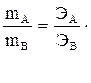
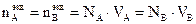 ,
,