
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Последовательность выполнения работы. При выполнении работы необходимо измерить температуру кристаллизации чистого
При выполнении работы необходимо измерить температуру кристаллизации чистого растворителя – воды, раствора неэлектролита и раствора электролита, предложенных преподавателем. 1. Составить таблицу для записи в нее полученных результатов Растворенное вещество: А. Неэлектролит_________________ Б. Электролит _________________
2. Подготовить криометр к работе, для чего: ● аккуратно извлечь термометр и мешалку из пробирки; ● промыть проточной водой пробирку и сполоснуть ее дистиллированной водой; ●выданный лаборантом лед поколоть на небольшие кусочки; заложить лед в защитный кожух, поместить в середину льда пробирку и присыпать лед сверху небольшим количеством поваренной соли − хлорида натрия NaCl. 3. Налить в пробирку 10 мл дистиллированной воды, погрузить пробирку в сосуд, наполненный доверху охлаждающей смесью, и закрыть пробкой. В пробирку погрузить термометр и мешалку. Для равномерного охлаждения жидкость медленно помешивать мешалкой и следить по термометру за понижением температуры (не исключено некоторое переохлаждение жидкости). 4. Так как при кристаллизации выделяется скрытая теплота плавления, то небольшое повышение температуры после достижения минимума укажет на окончание процесса кристаллизации. При наблюдении данного эффекта перемешивание прекратить, отметить и записать максимальную температуру подъема (из переохлажденного состояния), которая и будет температурой кристаллизация жидкости. 5. Пробирку извлечь из охлаждающей смеси. Подогревая рукой или теплой водой, растворить кристаллы и вымыть пробирку. Аналогичные операции повторить для растворов неэлектролита и электролита. 6. На основании полученных результатов рассчитать: а) разность температур кристаллизации растворителя и растворов; б) молекулярную массу растворенного неэлектролита; в) степень диссоциации электролита в растворе. КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ 1. Какие факторы влияют на понижение температуры кристаллизации раствора по сравнению с чистым растворителем (закон Рауля)? 2. Каков физический смысл криоскопической и эбулиоскопической констант растворителей? 3. Используя закон Рауля, рассчитайте, при какой температуре будет кипеть сахарный сироп, содержащий 1 моль сахара в 0,5 л 4. Определите изотонический коэффициент Вант-Гоффа и степень
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-10; просмотров: 119; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.126.248 (0.006 с.) |

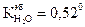 ).
).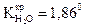 ).
). 


