
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 2. Растворы электролитовСодержание книги
Поиск на нашем сайте
Электролитами, как уже было сказано выше, называются вещества (кислоты, основания, соли), молекулы которых в растворах под действием молекул растворителя, чаще всего воды, распадаются на ионы – положительные катионы и отрицательные анионы. Этот процесс называется электролитической диссоциацией. Распад молекул электролитов на ионы может происходить и под воздействием высокой температуры (термическая диссоциация). Под действием электрического тока, подаваемого от внешнего источника, в растворах или расплавах электролитов осуществляется направленное движение ионов, т.е. перенос заряда (электрический ток). Таким образом, электролиты являются ионными электрическими проводниками (проводниками второго рода) в отличие от проводников первого рода (металлов и полупроводников), которые проводят электрический ток либо за счет движения электронов, либо за счет движения электронов и дырок. Равновесие в растворах электролитов. Степень и константа диссоциации Состояние динамического равновесия в растворах электролитов, при котором скорость диссоциации молекул растворенного вещества на ионы равна скорости ассоциации ионов в молекулы, характеризуется константой диссоциации, обозначаемой Для состояния равновесия
Величина Если каждая молекула при диссоциации образует один катион и один анион (n = m = 1) то концентрации катионов и анионов, находящихся в растворе, равны [A+] =[B-]= С0∙α, где С0 — первоначальная концентрация вещества; α — степень диссоциации, представляющая собой, как сказано выше, долю молекул, распавшихся на ионы. Число оставшихся после диссоциации непродиссоциировавших молекул [AB] = Сo - С0∙α = С0 ∙(I - α). В этом случае значение константы диссоциации:
Формула (2.2) представляет собой математическое выражение закона разведения Оствальда. Если α«1 (раствор очень слабого электролита), то в знаменателе ее величиной по сравнению с единицей можно пренебречь. Тогда
Полученное выражение наглядно показывает, что степень диссоциации с ростом концентрации раствора уменьшается. Величина константы диссоциации определяет силу электролитов. Различают очень слабые электролиты, для которых 1O3 <
Ионное произведение воды. Кислотность растворов. Водородный показатель (рН) Вода является очень слабым электролитом. Её диссоциация – пример самоионизации, протекающей по уравнению Н20 + Н20 где Н3O+ — ион гидроксония, представляющий собой гидратированный ион водорода (Н20 + H+ = Н3O+). Константа диссоциации воды согласно закону действия масс:
Это произведение В нейтральном растворе концентрации [Н3O+] и [ОН-] равны: [Н3O+] = [ОН-] =10-7моль/л. (2.5) Концентрация ионов гидроксония [Н3O+] определяет кислотность растворов. Если [Н3O+] > 1O-7 моль/л, то раствор является кислым, если [Н3O+] < 1O-7 моль/л — щелочным. Для более удобного выражения кислотности раствора было введено понятие рH, где р — оператор, тождественно равный отрицательному десятичному логарифму р ≡ -lg. Таким образом, величина рН представляет собой отрицательный десятичный логарифм числа, определяющего концентрацию ионов гидроксония [Н3O+] или упрощенно – ионов водорода [Н+]: pH = -lg[Н3O+]; pH = -lg[Н+]. (2.6) Оператор р применяется и для других малых величин, например pOH = -lg[OН+,, а р КW = pH + pOH = 14. (2.7)
pH нейтральных сред равен 7, кислых – меньше 7, щелочных – больше 7. Гидролиз солей.
|
|||||||
|
Последнее изменение этой страницы: 2021-03-10; просмотров: 239; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.008 с.) |

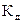 .
.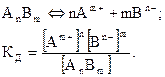
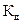 зависит только от температуры и природы веществ.
зависит только от температуры и природы веществ.
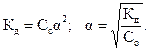
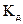 < 1O-7. Для просто слабых электролитов константа диссоциации лежит в интервале 1O-7 <
< 1O-7. Для просто слабых электролитов константа диссоциации лежит в интервале 1O-7 < 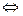 Н3O+ + ОН-,
Н3O+ + ОН-,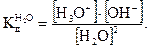 (2.4)
(2.4)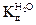 при 25оС равна 3,24∙I0-18. Так как степень диссоциации молекул воды очень мала, то концентрацию молекул воды можно считать величиной постоянной и равной [H2O] = 1000/18 = 55,55 моль/л и произведение двух постоянных величин тоже величина постоянная, равная:
при 25оС равна 3,24∙I0-18. Так как степень диссоциации молекул воды очень мала, то концентрацию молекул воды можно считать величиной постоянной и равной [H2O] = 1000/18 = 55,55 моль/л и произведение двух постоянных величин тоже величина постоянная, равная: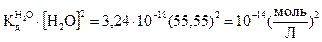 .
.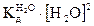 = [Н3O+][ОН-] = IO-14 = КW (моль/л)2 является постоянным для всех водных растворов. Константа КW называется ионным произведением воды, она зависит только от температуры.
= [Н3O+][ОН-] = IO-14 = КW (моль/л)2 является постоянным для всех водных растворов. Константа КW называется ионным произведением воды, она зависит только от температуры.


