
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Последовательность выполнения работы. 1. Собрать согласно схеме или проверить предварительно собранную установку дляСодержание книги
Поиск на нашем сайте
1. Собрать согласно схеме или проверить предварительно собранную установку для электролиза. Кулонометр, электролизер и амперметр, соблюдая полярность, необходимо последовательно подсоединить к выпрямителю тока. 2. Подготовить поверхность катодов: алюминиевую пластинку для кулонометра и медную пластинку для исследуемого электролизера, для чего зачистить их наждачной бумагой, промыть водой и ее остатки удалить, промокнув фильтровальной бумагой. 3. Взвесить пластинки на аналитических весах. Данные записать в таблицу.
4. Подготовленные образцы зажать в клеммы для катодов (отрицательных полюсов) кулонометра и электролизера (см. рис. 6.4). Каждый катод поместить в соответствующий электролит на равном расстоянии от анодов так, чтобы уровень жидкости был на 3–5 мм выше расширенной части пластинок. 5. Поставить регулятор тока выпрямителя в крайнее левое положение и включить выпрямитель. Вращая регулятор тока вправо, установить требуемую силу тока (0,1 А). Плотность тока должна составлять 0,02–0,0З А/см2. Электролиз проводить 30 мин. 6. По истечении времени выключить ток, извлечь катоды из клемм, осторожно промыть водой и аккуратно промокнуть фильтровальной бумагой. 7. Взвесить пластинки на аналитических весах и результаты записать в таблицу, вычислив привес металла. 8. Рассчитать выход металла (Ni) по току по формуле где Э Cu, Э Ni – эквиваленты меди и никеля, 9. Написать уравнения всех электродных процессов, происходящих на аноде и катоде в кулонометре и исследуемом электролизере. КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ 1. Поясните на конкретных примерах механизм процессов электролиза в растворах и расплавах электролитов с растворимым и нерастворимым анодами. 2. Какие процессы протекают на электродах при электролизе следующих водных растворов: H2SO4, NaCl, Cu(NO3)2, NiBr2? 3. Исходя из закона Фарадея, выведите формулу, по которой рассчитывается выход металла по току. 4. Что называется потенциалом разложения и какова природа процессов определяющих перенапряжение в системе? 5. Сколько грамм КОН образуется у катода при электролизе раствора, если на аноде выделилось 11,2 л кислорода, измеренных при нормальных условиях? 6. Какой толщины образуется покрытие железа при электролизе соли двухвалентного железа, если плотность тока составляет 10А/дм2, время электролиза 30 минут, выход по току 60%, а плотность железа 7,6 г/см3?
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-10; просмотров: 171; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.70.169 (0.009 с.) |


 ,
%
,
%
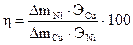 %,
%, и
и  –массы меди и никеля, выделившиеся на катодах.
–массы меди и никеля, выделившиеся на катодах.


