
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 5. Коррозия металлов. методы защиты
ОТ КОРРОЗИИ Коррозия металлов − самопроизвольный процесс разрушения (окисления) металла за счет его взаимодействия с окислителем окружающей среды. Основные механизмы протекания коррозионных процессов − электрохимический и химический. Критерием протекания коррозии по одному из перечисленных выше механизмов является состав (природа) среды. Химической коррозии подвергаются металлы, находящиеся в средах, не проводящих электрический ток, например в сухих газах в присутствии окислителей О2, СО2, Сl2, J2, H2S и других (газовая коррозия), в неводных растворах (раствор йода в бензоле, сернистая нефть) или в агрессивных средах, не содержащих воды (концентрированные растворы кислот, щелочей и т.д.). Газовой коррозии подвержены сопла ракет, двигатели внутреннего сгорания и т.п. В этом случае разрушение металла происходит за счет его непосредственного взаимодействия с окислителем. Более распространенной является электрохимическая коррозия металлов, так как в основном изделия из металлов и сплавов эксплуатируются в атмосферных условиях, в которых присутствует вода в большем или меньшем количестве в зависимости от природы среды: почва, влажный воздух, полное погружение изделия в электролит и т.п. Таким образом, электрохимической коррозии (критерий – токопроводящая среда) подвержены те металлические изделия, которые находятся в растворах электролитов или во влажном воздухе. Это электрохимический процесс, так как на поверхности металла имеются участки с различным значением электродного потенциала и образуются так называемые короткозамкнутые микрогальванопары и вследствие этого электрический ток. Электрохимическая коррозия – многостадийный процесс, основными стадиями которого являются: окисление металла на анодных участках корродирующего металла и восстановление окислителя из окружающей среды − на катодных. Рассмотрим в качестве примера коррозию железа в растворе НСl.
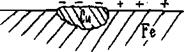
Рис. 5.1. Коррозия железа в кислой среде
Так как абсолютно чистый металл получить невозможно, то практически любая железная пластина, как правило, содержит включение других металлов, например Сu, Sn, Pb и др. Железо является более электроотрицательным металлом, чем указанные примеси, так как его стандартный электродный потенциал
Поэтому железо будет анодом любой из возможных микрогальванопар и происходит его разрушение по схеме: (-) А(Fe): Feo −2e → Fe2+. (5.1) Отдаваемые железом электроны внутри металла перемещаются к участку с более высоким значением потенциала (в данном случае к медному включению), который служит катодом. В кислой среде на нем происходит процесс восстановления водорода: (+) K (Cu): 2H+ + 2e → H2. (5.2) В связи с тем, что электрохимическая коррозия протекает в растворах электролитов, процесс, имеющий место на катоде, определяется кислотностью (рН) среды. В кислых средах, как показано выше, происходит образование водорода при восстановлении свободных ионов Н+, в нейтральных и щелочных средах без доступа кислорода протекает процесс выделения водорода из воды: 2Н2О + 2е → Н2 + 2ОН- Е° = -0,828В. (5.3) В нейтральных или щелочных средах с доступом кислорода происходит восстановление последнего по схеме
O2+ 2Н2О +4e → 4ОН- Е° = 0,401В. (5.4)
Таким образом, если рассмотреть с точки зрения коррозионных процессов микрогальванопару, представленную на рис. 5.1, т.е. два контактирующих металла железо−медь, то в зависимости от состава среды катодные процессы (схемы 5.5) будут различными, а анодный во всех случаях один и тот же: ● кислая среда (-) А(Fe): Feo − 2e → Fe2+ (+) К(Cu): 2H+ + 2e → H2o; ● токопроводящая среда в отсутствии кислорода (-) А(Fe): Feo − 2e → Fe2+ (+) К(Cu): 2Н2О + 2е → Н2 + 2ОН-; (5.5) ● токопроводящая среда в присутствии кислорода (-) А(Fe): Feo − 2e → Fe2+
(+) К(Cu): O2 + 2Н2О +4e → 4ОН- . В дальнейшем в случае присутствия в коррозионной среде ионов ОН- протекают «вторичные» коррозионные процессы – образование различных по составу гидроксидов, составляющих основу ржавщины:
Fe2+ + 2ОН- → Fe(ОН)2 (5.6) 4Fe(ОН)2 + O2 + 2Н2О →4 FeООН ∙Н2О. (5.7) Способы защиты от коррозии 1. Профилактика коррозии, т.е. предупреждение протекания коррозионных процессов на стадиях проектирования, изготовления изделия и его эксплуатации (например, сведение к минимуму контактов разнородных материалов, исключение создания форм конструкций, способствующих скапливанию влаги и др.). 2. Создание сплавов с легирующими добавками. Легирование – это повышение коррозионной стабильности металлов за счет введения добавок различных более электроотрицательных металлов. Так, для железа такими добавками будут Ni, Cr, W, Mo, Ti и др., входящие в состав нержавеющей стали. 3. Изоляция поверхности изделий от окружающей среды с помощью: а) нанесения органических покрытий (лаки, краски, эмали, компаунды и др.). При использовании данного метода защиты требуется не менее трех слоев, для перекрывания пор, так как органические молекулы имеют большие размеры по сравнению с неорганическими; б) электрохимического анодирования при электролизе. Например, естественная оксидная пленка на алюминии толщиной около 8 мкм может быть увеличена до толщины в 200 мкм и более плазмохимическим наращиванием или формированием оксидных слоев. Цвет получаемого оксидного слоя пи этом будет зависеть от природы раствора электролита, в котором осуществлялось её наращивание, а толщина ─ от времени протекания процесса, концентрации раствора и ряда других факторов. Механизм протекающих процессов при анодировании можно представить следующим образом: электрохимически образующийся атомарный кислород Н2О − 2е → 2Н+ + Оадс (5.8) проникает через поры естественной оксидной пленки Al2O3 на алюминии и химически взаимодействует непосредственно с металлом: 2Al + Оадс → Al2O3. (5.9) Рост толщины защитной оксидной пленки будет продолжаться до тех пор, пока скорость ее образования не станет равной скорости ее разрушения вследствие химического взаимодействия с электролитом. В кислых средах данный процесс имеет вид: Al2O3 + 6Н+ → ЗН20 + 2 Al 3+; (5.10)
в) нанесения металлических покрытий: анодных, при которых нанесенный на изделие металл более «активен», т.е. имеет более отрицательный электродный потенциал (металл – «жертва»); катодных, если металл-покрытие менее «активен», т.е. имеет более положительный электродный потенциал. Так, для железа анодным покрытием может служить цинк. В этом случае при нарушении целостности покрытия разрушению будет подвергаться цинк: (-) A(Zn): Zn0 – 2 e →Zn2+, (5.11)
а железо будет являться катодом и служить лишь переносчиком электронов. В кислой среде на поверхности железа будет восстанавливаться водород: (+) К(Fe): 2 Н+ + 2 е → Н2. (5.12) Катодными покрытиями для железа могут служить олово, медь и др. В этом случае при нарушении целостности покрытия разрушению подвергается основной металл. Так, если железо покрыто оловом, то при коррозии, например во влажном воздухе, будут иметь место следующие процессы: (-) А (Fe): Fe0 – 2 e → Fe2+ (+) K(Sn): O2 + 2 H2O + 4 e → 4 OH- . (5.13) 4. Электрозащита основана на свойствах некоторых металлов переходить в пассивное состояние при их присоединении к отрицательному полюсу внешнего источника постоянного тока. 5. Удаление активных веществ, способствующих протеканию коррозии, например деаэрация (удаление кислорода). 6. Применение ингибиторов ─ веществ, замедляющих процесс коррозии в жидких средах и тормозящих либо катодную, либо анодную реакцию. 7. Протекторная защита – частный случай анодной и электрозащиты применяется при существовании определенных трудностей в нанесении покрытия на изделия (крупногабаритные изделия). Принцип действия протектора заключается в том, что более активный металл через проводник (расстояние которого равно радиусу действия протектора, т.е. его работоспособности) присоединяется к изделию и окисляется, не допуская окисления металла изделия. В качестве протектора для железа чаще всего используется цинк. Для количественной оценки коррозии определяют либо коррозионные потери (отношение изменения массы испытуемого образца к площади его поверхности), либо скорость коррозии (изменение какой-либо характеристики образца во времени). Гравиметрический (весовой) метод основан на измерении изменения массы образца за единицу времени. Скорость коррозии в данном случае рассчитывается по формуле: где ∆m ─ изменение массы образца (мг,г,кг), S ─ поверхность образца (см2, м2), τ ─ время (мин, час, год). Объемный показатель коррозии рассчитывается как отношение объема прореагировавшего в процессе коррозии газа к единице поверхности металла в единицу времени: где Vо ─ объем газа при нормальных условиях. Глубинный показатель коррозии h (мм/год) представляет собой уменьшение толщины металла (в линейных единицах), отнесенное к единице времени. При равномерной коррозии h где d ─плотность металла (dFe = 7,8∙103 кг/м3); 8.76 ─коэффициент, учитывающий перевод единиц измерения времени (в году ~ 8760 часов). ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Глава 6. ОПИСАНИЕ ЛАБОРАТОРНЫХ РАБОТ
|
|||||||
|
Последнее изменение этой страницы: 2021-03-10; просмотров: 112; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.95.216 (0.016 с.) |
 , в то время как
, в то время как  .
.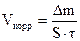 , (5.14)
, (5.14) 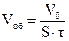 , (5.15)
, (5.15) , (5.16)
, (5.16)


