
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительно-восстановительное титрованиеСодержание книги
Поиск на нашем сайте
Возможность и направление окислительно-восстановительной реакции в стандартных условиях определяется по знаку стандартного значения ЭДС окислительно-восстановительного элемента, составленного из соответствующих окислительно-восстановительных электродов. Принцип такого расчета рассмотрим на примере окислительно-восстановительной реакции КМn04 + 5FeCl2 + 8HCl ↔ KCl + 5FеCl3 + MnCl2 + 4H2O (3.29) Для этого сначала запишем уравнения предполагаемых электродных реакций (полуреакций), из которых складывается суммарное уравнение, и определим по справочнику значения их стандартных электродных потенциалов:
Для расчета ЭДС из потенциала, соответствующего реакции (3.30), вычитаем потенциал, соответствующий реакции (3.31):
Положительное значение
Измерение ЭДС окислительно-восстановительного гальванического элемента используется при окислительно-восстановительном титровании, когда проводят определение неизвестной концентрации раствора. Например, если необходимо определить концентрацию раствора соли FeSО4, то этот раствор титруют раствором перманганата калия KMnO4. В ходе окислительно-восстановительной реакции измеряют потенциал окислительно-восстановительной системы Измерение потенциалов можно проводить на рН-метре, шкала которого проградуирована как в единицах рН, так и в единицах измерения потенциала электрода. Глава 4. ЭЛЕКТРОЛИЗ Электролиз – это окислительно-восстановительные процессы, которые происходят на электродах при прохождении электрического тока через раствор электролита или его расплав. В этом случае электрическая энергия источника тока переходит в химическую энергию. Электролиз применяют главным образом при нанесении защитных покрытий на металлические изделия, при получении различных Для осуществления процесса электролиза расплавов или растворов электролитов используется электрохимическая ячейка, состоящая из двух электродов – катода и анода, присоединенных к источнику постоянного тока и соответствующего электролита. По возможности участия в окислительно-восстановительных реакциях, определяющих электрохимический процесс, аноды подразделяются на нерастворимые (не участвующие в реакции, чаще всего платиновые, угольные и другие инертные электроды) и растворимые, принимающие участие в электродной реакции и при этом растворяющиеся (в этом случае металл анода подбирается, исходя из целей и задач самого процесса электролиза). Общие правила разряда ионов при электролизе. В первую очередь на электродах будет реагировать тот ион, для разряда которого нужно приложить меньшее значение (по абсолютной величине) потенциала. Так как на катоде идет процесс восстановления, т.е. присоединения отрицательно заряженных электронов, то первоначально на нем будет протекать тот электродный процесс, который характеризуется более положительным значением потенциала, а на аноде − электродный процесс, характеризующийся более отрицательным значением потенциала, так как там идет окисление, сопровождающееся отдачей электронов. Очередность разряда ионов металлов определяется положением последних в ряду напряжений. Группа металлов «высокой» активности: Li+, Rb+, K+, Ca2+, Na+, La+, Mg2+, Be2+, Al3+ При электролизе водных растворов «активных» металлов на катоде происходит выделение водорода из воды, а ионы металла остаются в растворе в первоначальном виде, как и до электролиза, так как стандартный электродный потенциал реакции восстановления водорода из воды 2 Н2О + 2 е ↔ Н2 + 2 ОН- составляет величину В группу металлов «средней» активности входят: Mn2+, Zn2+, Fe2+, Cd2+, Co2+, Ni2+, Sn2+,Pb2+, Ge2+.. Их стандартные потенциалы определяются пределами от -1,53 В для Zn2+ до -0.01 В для Ge2+.. При электролизе водных растворов металлов «средней» активности на катоде происходят две реакции − восстановление как металла, так и водорода из воды. Группа «неактивных» металлов, стоящих в ряду активности после водорода: Bi2+, Cu2+, Hg2+, Ag+, Au3+, Au+, Стандартные потенциалы «неактивных» металлов всегда имеют положительное значение и охватывают область потенциалов от +0,22 В для Bi2+ до +1,68 В для Au+. Водороду (т.е. водородному электроду) Pt, H2(Г)│2H+ условно приписывается нулевое значение стандартного потенциала. При электролизе водных растворов «благородных» металлов, т.е. имеющих положительное значение стандартного электродного потенциала, на катоде происходит восстановление только металла. Ниже приведен ряд напряжений металлов с указанием ионов, которые образуются при их окислении:
Li+, Rb+, K+, Ca2+, Na+, La+, Mg2+, Be2+, Аl3+, Mn2+, Zn2+, Fe2+, Cd2+, Co2+, Ni2+, Sn2+, Pb2+, Ge2+., H+ Bi2+, Cu2+, Hg2+, Ag+, Au3+, Au+ Явление перенапряжения, имеющее место при протекании тока через электролизер, приводит к тому, что водород на катоде выделяется при потенциале гораздо более электроотрицательном, чем равновесный потенциал, отвечающий рН данного раствора. Перенапряжение выделения кислорода при его образовании на аноде по схемам ● в щелочном или нейтральном растворе 4ОН— -4е → О2+2Н2О (рН >7); (4.1) ● в кислом растворе 2Н2О -4е → О2 +4Н+ (рН <7) (4.2) заключается в смещении его потенциала в сторону положительных значений от равновесного потенциала. Перенапряжение в общем случае представляет собой сдвиг потенциала электрода от данного равновесного значения, который вызывается замедленностью стадии разряда электрохимической реакции. Рассмотрим конкретно процесс электролиза раствора и расплава соли NaCl. При электролизе расплава NaCl, в котором существует только один вид катионов и один вид анионов, образующихся при термической диссоциации NaCl по схеме NaCl ↔ Na+ + Cl- протекают следующие процессы: на отрицательно заряженном катоде К(-) происходит восстановление ионов натрия и образование чистого металла, а на положительно заряженном аноде А(+) − окисление ионов хлора с образованием газообразного продукта: (-)К: Na+ + e → Nao (4.3) +)A: С1- -e → С1° (4.4) С1° + С1°→ С12. Если же проводить электролиз водного раствора NaС1, то катодный процесс в этом случае будет иной. Это связано c тем, что в водном растворе электролизу будут подвергаться молекулы воды, как обладающие более положительным значением электродного потенциала, и для того чтобы произошло восстановление воды на катоде с образованием водорода в случае щелочных и нейтральных растворов по схеме 2H2O + 2e = H2 + 2 OH- (4.5) надо приложить потенциал, равный Ео = -0,83 В, а для восстановления ионов Na+ требуется создать потенциал, равный Ео = -2,7 В, поэтому как только потенциал катода станет равным -0,83В, на катоде начнется выделение водорода из воды. Это приводит к тому, что получать активные металлы с помощью электролиза возможно только из расплавов их соединений, когда отсутствует конкурирующая реакция восстановления воды. На аноде в первую очередь разряжается ион, который имеет менее положительный потенциал. Для окисления на аноде воды с выделением кислорода по реакции 2H2O - 4e → О2 + 4H+ следует приложить потенциал Е0 = 1,23В, а для окисления ионов хлора 2С1--2e →С12° требуется +1,36В. Однако в водном растворе NaС1 на аноде происходит выделение хлора, из-за сдвига потенциала в связи с процессом перенапряжения выделения кислорода. Таким образом, на аноде при электролизе водных растворов солей, имеющих простые анионы типа S2-, J-, Br-, Cl-, происходит их окисление с выделением свободных неметаллов. В случае же электролиза соединений, содержащих кислородсодержащие анионы типа PO43-, SO42-, NO3- и ион фтора F-, происходит окисление воды с образованием кислорода, так как для окисления последних требуется потенциал более 2 В. При электролизе водного раствора сульфата меди CuSO4 с нерастворимым анодом (например, угольным) протекают следующие реакции: на катоде происходит восстановление металла (-) К: Cu2+ + 2е → Cuо, на аноде окисление воды с выделением кислорода (+)А: 2H2O - 4e → О2 + 4H+. При электролизе водных растворов солей неактивных металлов и металлов «средней» активности при наличии растворимого анода возможно протекание сопряженных реакций на аноде и катоде. Так, для сульфата никеля, молекулы которого распадаются в воде на ионы Ni2+ и SO42-, возможно протекание электролиза по следующей схеме: ● на катоде (-)К: Ni2+ + 2е → Ni0 2H2O + 2e → H2 + 2 OH- (4.6) ● на аноде (+)А: Ni0 - 2е → Ni2+ 2H2O - 4e → О2 + 4H+ . (4.7) В случае же нерастворимого анода электролиз может быть представлен электродными реакциями: ● на катоде (-)К: Ni2+ + 2е → Ni0 ● на аноде (+)А: 2H2O - 4e → О2 + 4H+. В соответствии с законами Фарадея количество вещества m, претерпевшего химические превращения на электроде при прохождении тока через раствор или расплав электролита, прямо пропорционально количеству электричества Q и эквивалентной массе данного вещества Э: где F – число Фарадея ≈ 96500 кл/г-экв. Ели на электродах протекают конкурирующие реакции, то на выделение целевого продукта расходуется только часть количества электричества, протекающего через электрод, и тогда говорят о выходе по току целевого продукта. При электрохимическом получении металлов практически всегда часть тока расходуется на побочные процессы, такие, как выделение водорода и др., поэтому количество металла, выделившееся на электродах, будет меньше, чем рассчитанное теоретически по законам Фарадея. Отношение количества вещества, получаемого при электролизе, к его теоретическому значению называется выходом по току η:
|
||||||
|
Последнее изменение этой страницы: 2021-03-10; просмотров: 176; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.82.252 (0.01 с.) |


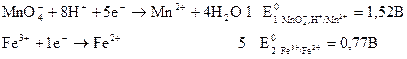
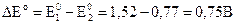 .
.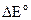 говорит о протекании реакции (3.29) при стандартных условиях в прямом направлении:
говорит о протекании реакции (3.29) при стандартных условиях в прямом направлении: .
. и строят график зависимости потенциала от объема прибавленного реактива. Кривая окислительно-восстановительного титрования имеет S-образный вид, абсцисса середины вертикального участка которой соответствует объему раствора КМпО4, отвечающему точке эквивалентности, а ординаты середин нижней и верхней ветвей кривой – потенциалам окислительно-восстановительных систем
и строят график зависимости потенциала от объема прибавленного реактива. Кривая окислительно-восстановительного титрования имеет S-образный вид, абсцисса середины вертикального участка которой соответствует объему раствора КМпО4, отвечающему точке эквивалентности, а ординаты середин нижней и верхней ветвей кривой – потенциалам окислительно-восстановительных систем 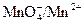 . По объему раствора KMnO4, соответствующему точке эквивалентности, можно вычислить нормальную концентрацию соли FeSО4 в растворе из равенства, основанного на законе эквивалентов: N1 V1 = N2 V2.
. По объему раствора KMnO4, соответствующему точке эквивалентности, можно вычислить нормальную концентрацию соли FeSО4 в растворе из равенства, основанного на законе эквивалентов: N1 V1 = N2 V2.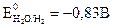 , а стандартные потенциалы «активных» металлов колеблются в пределах от -3,045 В для Li+ до -1,670 В для Al3+.
, а стандартные потенциалы «активных» металлов колеблются в пределах от -3,045 В для Li+ до -1,670 В для Al3+.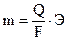 , (4.8)
, (4.8)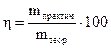 [%]. (4.9)
[%]. (4.9)


