
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа № 1 2 . Изучение окислительно-восстановительных гальванических элементовСодержание книги
Поиск на нашем сайте
Цель работы – изучение устройства и принципа работы гальванических элементов − химических источников тока (ХИТ) с окислительно-восстановительными электродами. Знакомство с методом измерения электродных потенциалов и электрохимических характеристик ХИТ. Использование результатов электрохимических измерений для расчета термодинамических параметров реакций. Оборудование
1. Высокоомный вольтметр – рН-метр (рН-340) для измерения потенциалов. 2. Хлорсеребряный электрод сравнения. 3. Штатив с измерительными бюретками. 4. Электролитический ключ (U-образная стеклянная трубочка, заполненная КС1 и агар-агаром для увеличения вязкости раствора). 5. Штатив с двумя пробирками. 6. Два угольных (инертных) электрода. Последовательность выполнения работы 1. Получить у преподавателя вариант окислительно-восстановительного гальванического элемента. 2. Включить рН-метр для прогрева на 15 мин. 3. Приготовить два полуэлемента. Полуэлемент (окислительно-восстановительный электрод) состоит из смеси растворов, содержащих ионы одного и того же элемента, но различного заряда, т.е. валентности (окисленная и восстановленная формы), в которую погружен угольный (нерастворимый) электрод. Для приготовления раствора первого полуэлемента необходимо взять 4 мл окисленной и 2 мл восстановленной формы, а второго полуэлемента – 3 мл окисленной и 4 мл восстановленной формы. 4. Подключив электроды к рН-метру (описание прилагается к прибору), измерить (при комнатной температуре) разность потенциалов трех гальванических элементов, составленных из: а) первого полуэлемента и хлорсеребряного электрода сравнения (Ag, AgС1|КС1нас), соединив растворы электролитов электролитическим ключом; б) второго полуэлемента и хлорсеребряного электрода. в) первого и второго полуэлементов. Отсчеты производить по нижней шкале прибора, поставив переключатель пределов на 1,5 В, а «род работы» – на «+mV» (или «-mV»). 5. Записать схемы исследованных гальванических элементов и уравнения протекающих в них токообразующих реакций. На основании полученных данных 1. Рассчитать опытные значения потенциалов Еоп 1-го и 2-го окислительно-восстановительных электродов, учитывая, что измеренная разность потенциалов 2. Рассчитать по формуле Нернста теоретические значения этих потенциалов Етеор, используя справочные данные по стандартным потенциалам исследованных электродов и учитывая, что в формуле Нернста соотношение концентраций окисленной и восстановленной форм участников электродной реакции ввиду их одинаковой концентрации можно приравнять к соотношению объемов в мл. Сравнить теоретические значения потенциалов с опытными результатами. 3. Определить ЭДС исследованного окислительно-восстановительного гальванического элемента по вычисленным теоретическим значениям потенциалов окислительно-восстановительных электродов и сравнить ее с опытной величиной; 4. Записать суммарное уравнение реакции, происходящей в окислительно-восстановительном гальваническом элементе, подобрав стехиометрические коэффициенты методом составления электронно-ионного баланса.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ 1. Какие гальванические элементы называются окислительно-восстановительными (или редокс-системами)? 2. Рассчитайте величину потенциала окислительно-восстановительного электрода С│Сr3+,Сr2+ при следующих концентрациях ионов: Сr3+ = 0,1 г-ион/л, Сr2+ = 0,1г-ион/л. 3. Определите катод и анод данной окислительно-восстановительной цепи и рассчитать ее ЭДС по стандартным значениям потенциалов: Pt│Со+2,Со+3││Sn+2,SnО32-│Pt.
|
||||
|
Последнее изменение этой страницы: 2021-03-10; просмотров: 139; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.130.96 (0.008 с.) |

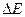 = Ео-в-Ех-с, (потенциал хлорсеребряного электрода при комнатной температуре равен 0,201В).
= Ео-в-Ех-с, (потенциал хлорсеребряного электрода при комнатной температуре равен 0,201В).


