
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа № 6. Определение константы диссоциации слабой кислоты и константы гидролиза солиСодержание книги
Поиск на нашем сайте
Цель работы – определение физико-химических констант электролитов: константы диссоциации уксусной кислоты и константы гидролиза уксуснокислого натрия. Оборудование 1. рН-метр (рН-340) с датчиком. 2. Четыре стеклянные колбочки. 3. Мерные цилиндры. Последовательность выполнения работы Опыт 1. 1. Приготовить в четырех колбах по 30 мл раствора уксусной кислоты СН3СООН разной концентрации (см. табл.), разбавляя дистиллированной водой исходный раствор – О,1 н СН3СООН. 2. Измерить рH растворов на рН-метре (описание прилагается к прибору). 3. Полученные результаты оформить в таблицу.
5. Построить график зависимости рН от логарифма концентрации, отложив по оси абсцисс логарифм концентрации кислоты, а по оси ординат − значения рН. Провести экстраполяцию (продление) полученной прямой на ось ординат. Отрезок, отсекаемый прямой на оси ординат, 6. Рассчитать рН = 1/2 для всех концентраций, найти ее среднее значение и сравнить со значением Опыт 2 1. Для определения константы гидролиза ацетата натрия СН3СООNa приготовить по 30 мл растворов соли разной концентрации (согласно табл. 6.2), разбавляя дистиллированной водой исходный раствор 0,1 н СН3СООNa. 2. Измерить рН растворов на рН-метре.
3. Полученные результаты записать в таблицу
4. По данным таблицы построить график, отложив по оси ординат рН, а по оси абсцисс lgC. проведя экстраполяцию полученной прямой на ось ординат. Отрезок, отсекаемый прямой на оси ординат, соответствует значению 14 – 1/2 lgКГ. 5. Определить Кг и сравнить значение Кг с рассчитанной по формуле Кг = К Н2О/ а К Н2О = 10-14.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ 1. Дайте определение константы диссоциации электролита. В чем заключается ее физический смысл? Обоснуйте влияние различных факторов на величину константы диссоциации. 2. Пользуясь законом разведения, рассчитайте степень диссоциации 0,01 М раствора HF, если константа диссоциации 3. Дайте определение рН раствора и рассчитайте, чему равен рН 0,001 н раствора КОН (α = 1). 4. Какие химические процессы подразумевают, применяя термин «гидролиз солей»? Какие соли дают при гидролизе кислую, а какие щелочную среду? 5. Напишите в ионной и молекулярной форме уравнения реакций гидролиза раствора соли Na2CO3.
|
|||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-10; просмотров: 153; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.148.108.174 (0.007 с.) |

 .
. 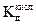 .
. Величину
Величину 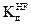 = 10-2.
= 10-2.


