Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Иммунологические нарушения при экстремальных состоянияхСодержание книги
Поиск на нашем сайте
Под влиянием экстремальных факторов (чрезмерные физические нагрузки, обширные хирургические вмешательства, гипоксия, ожоги и интоксикации) развивается комплекс реакций, имеющих неспецифический (стрессовый) и специфический, зависящий от природы действующего фактора характер. Разработаны определенные принципы лечения и компенсации последствий воздействия таких факторов с целью поддержания постоянства внутренней среды организма и сохранения жизнеспособности. Эти достижения заслуженно разделяет реаниматология. Однако развитие познания открыло целую область, практически неизвестную клинической медицине. Это касается закономерностей функционирования иммунной системы и иммунитета как проявления данной функции. Современная реаниматология заслуженно гордится успехами в выведении из состояния клинической смерти, поддержании гемодинамики, функции внешнего дыхания, контролировании состояния ЦНС. Приходится с сожалением признать, что часто после реанимационных мероприятий, когда кажется, что все опасности позади, с угрожающей быстротой нарастают инфекционно-септические осложнения, являющиеся следствием непоправимых нарушений в системе иммунитета. Принято считать, что чувствительность к гипоксии в наибольшей степени выражена в клетках головного мозга. Однако лимфоцит — основной участник иммунных реакций — в силу своей структуры (2—3 митохондрии, слабо развитый эндоплазматический ретикулум, крайне малое количество цитоплазмы) также сильно страдает при гипоксии и других воздействиях антиметаболического характера. В патологии хорошо известен факт, что инволюция лимфоидной ткани является постоянным спутником многих критических состояний. С. С. Baker и соавт. (1985), изучившие в 437 случаях причины смерти в результате множественных травм после автомобильной катастрофы, установили, что у 78% погибших спустя 7 сут после травмы причиной смерти был сепсис. Понимание смысла происходящих событий выходит за рамки теоретического вывода о снижении иммунного ответа и увеличении степени иммунологического риска. С практической точки зрения важно разграничивать такие события, как иммунная недостаточность и иммунодепрессия, — два разных состояния, требующих специальной диагностики и лечения. Разрабатывая тактику терапии, следует учитывать этот динамический процесс в иммунной системе.
Иммунитет и стресс. Вилочковая железа, костный мозг, селезенка и лимфатические узлы одними из первых реагируют на возникновение состояния стресса у человека и экспериментальных животных. Уменьшается масса органов, резко снижается количество клеток. При гистологическом исследовании можно видеть гибель отдельных клеток. В связи с этим возникает вопрос о физиологической сущности и адаптационной значимости данной системной реакции, так как лимфоидным клеткам принадлежит исключительная роль в процессах иммунитета и поддержания клеточного гомеостаза — двух важнейших звеньев многообразия процессов, необходимых для активного сохранения нормальной и притом специфической структуры организма. Изменения иммунологической реактивности, возникающие при стрессе, привлекают внимание исследователей относительно давно. Исследования проводились как при различного рода стрессовых воздействиях, так и при моделировании стресса введением кортикостероидов или AKTF. [Зимин Ю. И., 1979; Rogers М. F. et al., 1979; Schindier В. А., 1975]. Основным выводом данных работ является то, что стресс угнетает иммунный ответ и увеличивает подверженность организма определенным заболеваниям, особенно тем из них, возникновение которых тесно связано с нарушением иммунологических механизмов защиты, — инфекциям, злокачественным опухолям, аутоиммунным заболеваниям. Различные по своей природе стрессовые факторы (травма, кровопотеря, ожоги, инфекции, яды), одинаковым образом действуют через нервные и гуморальные пути на гипоталамус, стимулируя высвобождение химического медиатора — АКТГ-рилизинг-фактора. В результате концентрация АКТГ в крови увеличивается. Возрастание секреции АКТГ вызывает повышение гормональной активности коры надпочечников и уровня кортикостероидов в сыворотке и тканевой жидкости [Selye H., 1960]. Одной из основных функций АКТГ является стимуляция коры надпочечников. На первом этапе происходит быстрый выброс стероидных гормонов, а на втором — увеличивается скорость их синтеза и секреции. Стресс — неспецифическая реакция и представляет собой генерализованную реакцию организма, мало зависящую от качественных свойств воздействия.
Рассмотрим закономерности изменения иммунной системы при стрессе на примере операционной травмы. К настоящему времени накопилось определенное число работ, отмечающих связь между операционным воздействием и последующим снижением резистентности к инфекции, потенциацией роста опухолей и выраженностью метастазирования. Одним из ведущих факторов снижения противоопухолевой и инфекционной резистентности является послеоперационная супрессия системы иммунитета. Исходя из того, что главное место в эффекторной функции иммунитета принадлежит системе клеточных механизмов иммунного надзора, мы изучали количественные изменения Т- и В-лимфоцитов, их функциональных свойств. Особое внимание уделено системе естественной противоопухолевой устойчивости организма — нормальным киллерам (НК) и антителозависимой клеточной цитотоксичности (АЗКД), осуществляемой К-клетками [Зимин Ю. И. и др., 1985]. В группу клинического обследования вошли соматически здоровые пациенты хирургического отделения 18—42 лет, оперированные в плановом порядке. В качестве контроля изучены показатели иммунитета у здоровых доноров соответствующего возраста. В течение 1 сут после операции в циркулирующей крови отмечены уменьшение общего количества лимфоцитов и увеличение содержания нейтрофильных гранулоцитов. Снижение числа лимфоцитов происходило главным образом за счет Т-клеток. Пропорция (но не абсолютное их количество) В-клеток при этом возрастала. Показатели крови нормализовались, как правило, в течение 3—6 сут после операции, если, естественно, послеоперационный период протекал без осложнений (рис. 9.4).
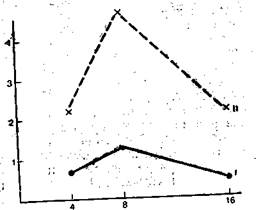
Рис. 9.4. Влияние плазмафереза в объеме 2100 мл на митогенную реактивность лимфоцитов у больного сепсисом. I _ до плазмафереза, II — после него. По оси абсцисс — доза конканавалина-А (КонА) при культивировании лимфоцитов (мкг/мл), по оси ординат — включение 3Н-тимидина, имп/мин <Х106).
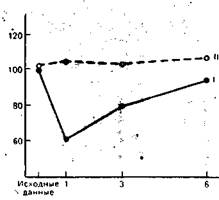
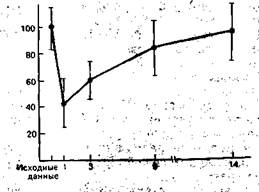
Рис. 9.5. Изменение содержания лимфоцитов в крови при хирургическом вмешательстве. I — Т-лимфоциты; II — В-лимфоциты. По оси ординат — концентрация клеток (в процентах к исходной), по оси абсцисс — время после операции (сутки).
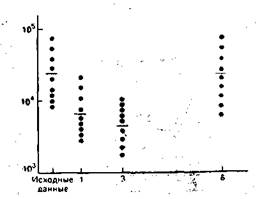
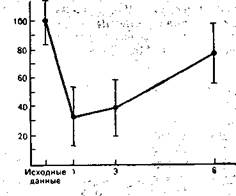
Результаты исследования влияния хирургической травмы на способность лимфоцитов периферической крови претерпевать морфологическую трансформацию и пролиферацию в ответ на митогенный стимул представлены на рис. 9.5. Почти во всех случаях операция сопровождалась значительным и продолжительным снижением синтеза ДНК при культивировании лимфоцитов с фитогемагглютинином (ФГА). На 7—8-е сутки после оперативного вмешательства способность лимфоцитов трансформироваться в бласты восстанавливалась. Интенсивность синтеза ДНК оценивалась по включению в клетки 3Н-тимидина. Динамика активности К- и НК-клеток довольно близко совпадала. Сразу после окончания операции отмечено снижение цитолитической активности киллеров против клеток-мишеней, каковыми были эритроциты барана или клетки линии К-562. Через 72 ч депрессия активности системы естественной цитотоксичности достигала 50% по отношению к контролю. Как правило, у обследуемых на 6—8-е сутки послеоперационного периода наблюдалось восстанбвление показателей активности К- и НК-клеток. Лишь у 2 пациентов 40 и 42 лет период восстановления не закончился на 14-е сутки (рис. 9.6, 9.7).
Для оценки функции К-клеток в реакции АЗКЦ в качестве эффекторов применяли мононуклеарные клетки периферической крови в виде взвеси. В качестве клеток-мишеней использовали эритроциты барана, обработанные гипериммунной антисывороткой кролика. Клетки-эффекторы смешивали с клетками-мишенями в соотношении 5:1. При исследовании НК были использованы также мононуклеарные клетки, выделенные из крови. Мишенями для НК служили клетки лейкоза человека К562, поддерживаемые in vitro и меченные радиоактивным хромом (51Cr). Интенсивность гибели клеток-мишеней оценивали по выходу 51Cr в инкубационную среду.
Рис. 9.6. Митогеннйй ответ культуры лимфоцитов на ФГА при хирургическом вмешательстве. По оси ординат — включение 3Н-тимидина, индивидуальные показатели (нмп/мин); по ос» абсцисс — время после операции (сутки).
Рис. 9.7. Цитотоксическая активность К-клеток при хирургическом вмешательстве (М±20). По оси ординат—активность. К-клеток (в процентах к исходному уровню), по оси абсцисс — время после операции (сутки).
Рис. 9.8. Цитотоксическая активность НК-клеток при хирургическом вмешательстве (М+2о). По оси ординат — цитолитическая активность (в процентах к исходному уровню); по оси абсцисс — время после операции (сутки).
Механизм депрессии активности системы иммунитета при операционном стрессе может быть связан с рядом моментов: иммуносупрессией за счет гиперсекреции глюкокортикоидных гормонов, активацией Т-клеток супрессоров, появлением в сыворотке крови оперированных больных иммуносупрессирующих факторов (рис. 9.8). Стрессовая депрессия активности НК-клеток и эффекторов АЗКЦ (если принять во внимание общность происхождения и механизмы действия клеточных популяций) может быть связана с дефицитом эндогенного интерферона или нарушением продукции интерлейкина-2. Таким образом, при стрессе, вызванном хирургическим вмешательством, происходит существенное угнетение реакций клеточного иммунитета. Данные выводы распространяются не только на больных хирургического профиля. Круг заболеваний человека, при которых снижается функциональная активность лимфоцитов, постоянно расширяется. Многократно повторяющиеся, длительно действующие формы стресса могут воздействовать на имммунную систему, приводить к нарушению ее основной функции — функции иммунологического надзора. С практической точки зрения, лабораторный контроль и иммунокоррекция оправданы при очень многих формах патологии, прямо не затрагивающих органы иммунной системы: различного рода травмах, ожогах, воздействиях токсических агентов, эндокринных нарушениях, голодании, терапии глюкокортикоидными гормонами и др. [Зимин Ю. И., 1983].
Нарушение иммунитета при ожогах. Иммунная защита при ожоговой травме значительно угнетена. При ожоге более 20% поверхности тела с фатальной скоростью нарастает частота септических осложнений. Клинически у больных увеличивается подверженность грибковым, вирусным или грамотрицательным бактериальным инфекциям. Заболевания протекают тяжело и агрессивно. Сепсис является причиной 80—85% летальных исходов. Нарушения иммунного статуса при термальных ожогах тесно связаны с изменениями в структуре лимфоидных тканей и расстройствами функции клеточного иммунитета, связанными с Т-лимфоцитами и нарушениями продукции иммуноглобулинов В-лимфоцитами. В большинстве случаев клеточные иммунные реакции нарушаются в большей степени, чем гуморальные. Эти изменения пропорциональны тяжести поражения и носят обратимый характер [Antonacci А. С., 1987]. При исследовании лимфоидной ткани обращает на себя внимание клеточное опустошение тимусзависимых зон и пролиферация В-лимфоцитов. Абсолютное количество Т-клеток снижено главным образом за счет вспомогательных клеток фенотипа CD4. Относительное количество супрессорных клеток (CD8) возрастает. Многие авторы отмечают корреляцию между снижением соотношения CD4/CD8 и вероятностью возникновения сепсиса. Уменьшение числа вспомогательных клеток, по-видимому, приводит к более тяжелым последствиям, чем увеличение относительного количества супрессорных элементов. Нарушение клеточных иммунных функций выявляется рано по лимфопении, снижению кожных реакций гиперчувствительности замедленного типа, снижению реактивности на ФГА и конканавалина-А (Кон-А). Нарушение специфических иммунных функций касается как первичного, так и вторичного анем-нестического иммунного ответа. Все эти данные свидетельствуют о наличии дефекта на уровне Т-клеток. Что касается природы дефекта, то, по мнению большинства исследователей, скорее происходит снижение числа Т-клеток, их перераспределение, а не нарушение функции на уровне отдельных клеточных элементов. Огромное значение имеет и увеличение специфической активности супрессорных клеток. Содержание сывороточных иммуноглобулинов после термической травмы уменьшается, как правило, параллельно снижению концентрации белков в сыворотке. В большинстве случаев выработка антител и синтез иммуноглобулинов существенно не изменяются. Те отклонения от нормы первичного и вторичного иммунного ответа, которые часто выявляются экспериментально, скорее связаны с нарушениями на уровне иммунорегуляторных клеток [Ninnemann J. L., 1987]. Таким образом, при ожогах достаточно большой (более 20%) площади развивается глубокая, многофакторная иммуно-депрессия, которая является предрасполагающим фактором для возникновения сепсиса. В детском и старческом возрасте изменения иммунного статуса могут проявиться и при поражении: меньшей поверхности тела. Динамическое состояние иммунной системы, поочередное или одновременное существование иммунной недостаточности и иммуносупрессии может проявляться в:
1) полном исчезновении кожной чувствительности к Т-клеточным антигенам (туберкулин, кандидин); 2) появлении в крови эндотоксинов, продуктов деградации тканей, избытка гормонов, цитокинов и лимфокинов с иммуносупрессивными свойствами; 3) активации системы комплемента, как классического, так и альтернативного пути с образованием продуктов расщепления,, обладающих анафилактоидной активностью; 4) угнетении функции моноцитов/макрофагов, усилении их иммуносупрессивной функции, связанной с простагландином Е; 5) транзиторном снижении числа В-клеток и продукции иммуноглобулинов (антитела); 6) угнетении функции нейтрофильных гранулоцитов, включая хемотаксис, фагоцитоз, хемилюминесценцию и внутриклеточный киллинг; 7) уменьшении количества (НК-клеток) и функции лимфо-кинактивированных киллеров; 8) длительной и глубокой депрессии реактивности Т-клеток на поликлональные митогены и усилении их супрессорной функции; 9) реверсии соотношения вспомогательных и супрессорных клеток (CD4/CD8). Два клинических состояния являются критическими для восстановления нарушенных иммунных функций: отторжение погибших и поврежденных тканей и восстановление кожного барьера путем эпителизации и закрытия ран. Иммунологические коллизии персистируют у обожженных до тех пор, пока эти состояния не разрешатся. По мере восстановления раневой поверхности восстанавливается иммунологическая компетентность. Чем раньше начинается клиническая регенерация, тем раньше достигается иммунологическое восстановление и увеличивается вероятность выживания. Попытки стимулирующей терапии в этот период малоэффективны. Любые способы коррекции иммунных изменений и приведения их к норме должны быть экспериментально проверены. Возможно, непосредственной причиной сепсиса является нарушение целости кишечной стенки (язвенного характера) вследствие сильнейшей интоксикации, отрицательного азотистого баланса и гиперсекреции гормонов коры надпочечников. Влияние лекарственной терапии. Различные лекарственные соединения в большей или меньшей степени могут быть иммуно-супрессорами сами по себе либо действовать аддитивно или потенциирующе. В небольшом обзоре трудно представить все возможные комбинации медикаментов. Наиболее часто в медицинских учреждениях приходится оказывать помощь в связи с последствиями применения цитостатиков и глюкокортикоидных гормонов. Те и другие являются мощными иммуносупрессорами и часто вызывают быстро, нередко лавинообразно нарастающие инфекционные осложнения, справиться с которыми чрезвычайно трудно. Кортикостероиды могут в значительной степени влиять на функцию Т-клеток, нарушая как их иммунорегуляторные свойства, так и эффекторные функции. Цитостатические соединения, помимо того, что обладают перечисленными свойствами гормонов, могут приводить к значительному снижению количества циркулирующих нейтрофильных гранулоцитов, к уменьшению числа В-клеток, гипоиммуноглобулинемии и снижению разнообразия антител. Цитостатические соединения и глюкокортикоидные гормоны в больших дозах могут вызывать язвенные процессы в желудочно-кишечном тракте и способствовать проникновению микрофлоры через слизистую оболочку. Это касается верхних отделов желудочно-кишечного тракта и особенно нижних. Среди условно-патогенной флоры наиболее часто попадают в кровоток и вызывают септические процессы Е. coli, К. pneumoniae, P. aeruginosa, S. aureus. Если пациент уже получал антибиотики, то могут преобладать и пенетрировать более резистентные к ним микроорганизмы, такие как различных видов Enterobacter и Candida. Пожалуй, найдется немного областей биологии и медицины, в которых научный прогресс, достигнутый в последние годы, был бы столь стремителен, как в иммунологии. Это обусловлено получением ряда принципиально новых данных, раскрывающих механизмы иммунитета: определением функции вилочковой железы и кооперативного взаимодействия Т-, В-клеток и макрофагов, исследованием структуры и функции иммуноглобулинов, генетическим контролем иммунного ответа, выявлением К-клеток и клеток, относящихся к нормальным киллерам, определением функции клеток, регулирующих иммунные процессы, формированием понятий о первичных и вторичных дефектах иммунной системы и др. Иммунитет играет исключительно важную роль в процессе жизнедеятельности организма при, постоянном воздействии антигенов внешней или внутренней среды. Даже небольшие колебания функционирования иммунной системы могут иметь прямое отношение к развитию патологического процесса и болезни. В последние годы проблема иммунологии критических состояний приобрела выраженный прагматический характер. Стало очевидным, что определение значения иммунологических сдвигов, правильная и своевременная их диагностика и направленная коррекция являются неотъемлемой частью ведения больных в отделениях интенсивной терапии. Глава 10
|
|||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 173; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.233.198 (0.015 с.) |