Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обмен электролитов и его патологияСодержание книги
Поиск на нашем сайте
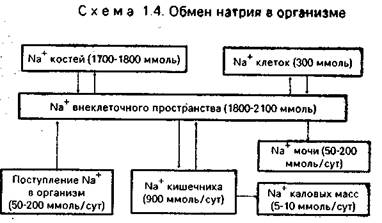
В организме, как правило, не бывает изолированных нарушений обмена какого-либо одного электролита в каком-либо отдельном секторе без индуцированных нарушений обмена других электролитов в соседних секторах. В связи с этим рассмотрение нарушений обмена отдельных электролитов имеет целью облегчить понимание водно-электролитной патологии в целом. Натрий. В организме здорового человека с массой тела, около 70 кг содержится около 3500—4000 ммоль, или 150—170 г, Na+. Из этого количества 25—30% сконцентрировано в костях и непосредственного участия в метаболизме не принимает. Это так называемый фиксированный Na+. Остальное количество (примерно 40 ммоль/кг) представляет собой собственно обменный Na+. Небольшая часть обменного Na+ также размещена в скелете и клетках (мягкие ткани) и участвует в обмене ограниченно. Наконец, самая большая часть Na+ почти полностью находится в жидкости внеклеточного пространства и, следовательно, является основным (или, как его называют, большим) катионом внеклеточной жидкости. Ниже представлена принципиальная схема обмена натрия (схема 1.4).
Нормальная концентрация Na+ в плазме составляет 135—145 ммоль/л. Концентрация Na+ в воде плазмы (за вычетом объема коллоидов и кристаллоидов плазмы) и в интерстициальной жидкости около 150 ммоль/л. Содержание Na+ в плазме, обычно определяемое методом пламенной фотометрии, а в последние годы и ионометрии, может быть также вычислено при добавлении к величине концентрации С1— общей СО2 в количестве 10 ммоль/л. Допустимая ошибка колеблется в пределах ±3 ммоль/л. Этот метод неприменим у тяжелобольных, когда кровь насыщена другими анионами (в частности, при уремии) или имеется высокая концентрация органических анионов (например, лактата, пирувата, кетокислот и других компонентов). У здоровых людей этот тест используют для проверки достоверности результатов по трем нормальным компонентам плазмы (Na+, Cl— и СО2). В норме суточное потребление Na+ соответствует его суточной экскреции почками, что является основой для сохранения постоянства концентрации Na+ в плазме. Концентрация Na+ в моче обычно весьма вариабельна и зависит как от потребления самого Na+, так и от поступлений воды в организм. В нормальных условиях содержание Na+ в моче не ниже 60 ммоль/л. Однако после операции в связи с нормальной активацией антидиуретических механизмов, приводящих к ретенции Na+ на уровне почек, содержание его в моче может падать до 10 ммоль/л и ниже, за исключением тех случаев, когда больной в послеоперационном периоде получает большое количество электролитов и диуретическую терапию.
Рассмотрим причины нарушений натриевого баланса в организме. Причины гипонатриемии (концентрация Na+ в плазме ниже 135 ммоль/л): 1) тяжелые, изнуряющие заболевания, сопровождающиеся снижением диуреза (рак, хроническая инфекция, декомпенсированные пороки сердца с асцитом и отеками, поражения печени, хроническое голодание); 2) посттравматические и послеоперационные состояния (травма костей и мягких тканей, инфекционные процессы, ожоги, послеоперационная секвестрация жидкостей, влияние анестезии); 3) избыточное поступление воды в организм в условиях антидиуретической фазы послеоперационного и посттравматического состояния (избыточное переливание изотонического раствора глюкозы, задержка воды при ирригации толстого кишечника, избыточное питье при ограниченном потреблении пищи); 4) потери Na+ внепеченочным путем (многократная рвота, диарея, образование третьего пространства при острой кишечной непроходимости, тонкокишечные и дуоденальные свищи, обильное потение); 5) бесконтрольное применение диуретиков. Причины гипернатриемии (концентрация Na+ в плазме выше 150 ммоль/л): 1) дегидратация при водном истощении (повышенные потери воды через дыхательные пути во время одышки, при лихорадке, трахеостоме, проведении ИВЛ в условиях недостаточного увлажнения дыхательной смеси, использовании неувлажненного кислорода, открытом лечении ожогов, длительном потении без соответствующей водной компенсации). Избыток каждых 3 ммоль Na+ в 1 л плазмы сверх 145 ммоль/л может в этих случаях означать дефицит 1 л внеклеточной воды; 2) солевая перегрузка организма (кормление через зонд Концентрированными смесями без соответствующего введения воды при длительном бессознательном состоянии, после операций на головном мозге, в связи с обструкцией пищевода, при питании через гастростому); 3) несахарный диабет.
Следует подчеркнуть, что гипонатриемия чаще бывает показателем избытка воды во внеклеточном пространстве, чем истинного дефицита Na+, т. е. концентрация Na+ в плазме не отражает абсолютное содержание этого электролита в организме. Однако общее количество Na+ в организме тесно коррелирует с содержанием воды во внеклеточном пространстве: при избытке Na+ организм задерживает воду, при недостатке — выводит лишнюю воду. Наиболее часто снижение концентрации Na+ в плазме обусловлено избытком воды, реже — истинным дефицитом общего Na+. При дефиците Na+, превышающем 450—600_ммоль/л (дефицит свыше 3—4 л внеклеточной воды), развиваются олигурия (преренального типа) на фоне гипотензии, носящей иногда выраженный ортостатический характер, апатия, тошнота, снижается концентрация Na+ в плазме, повышается гематокрит. Если это состояние своевременно не корригируют, то развивается гиповолемический шок и наступает смерть. Тяжелые операции всегда сопровождаются выраженной задержкой Na+, которая достигает максимума на 2—4-й день после операции [Рябов Г. А. и др., 1977]. Концентрация Na+ в плазме также снижается. С началом диуретической фазы послеоперационного периода концентрация натрия в моче значительно повышается и может достигать весьма высокого уровня, если послеоперационный период протекал со значительной секвестрацией внеклеточной жидкости. Калий. В организме здорового человека с массой тела около 70 кг содержится 3200—3150 ммоль К+ (45 ммоль/кг у мужчин и около 35 ммоль/кг у женщин). Всего 50—60 ммоль К+ находится во внеклеточном пространстве, остальной К+ распределен в клеточном пространстве. Таким образом, К+ является основным клеточным катионом. Ниже представлена принципиальная схема обмена калия (схема 1.5). Концентрация К+ во внеклеточной жидкости, включая плазму, составляет в норме 3,5—5,5 ммоль/л. Концентрация внутриклеточного К+ достигает 150 ммоль/л. С возрастом общее количество К+ в организме уменьшается. В клинической практике оценить содержание К+ в клеточном пространстве невозможно. Приблизительно определить содержание К+ в клетках удается при непосредственном исследовании тканей, например кусочка скелетной мышцы методом пламенной фотометрии. Содержание К+ в эритроцитах обычно не коррелирует с содержанием его в других средах организма и не может, следовательно, использоваться как показатель клеточной концентрации К+. Суточное потребление К+ составляет 60—100 ммоль. Почти такое же количество выделяется с мочой и лишь немного (около 2%) выводится с каловыми массами. В послеоперационном периоде, а также при критических состояниях потери К+ могут значительно превышать его поступление. Исследования, проведенные нами у тяжелобольных, показали, что уже с 1-х суток после операции содержание К+ в эритроцитах прогрессивно снижается и к 4-му дню может достигать 87% исходного значения. Возникающая при этом гиперкалиемия обусловлена в основном катаболизмом поперечнополосатой мускулатуры и тканей как в зоне операции, так и в других частях тела и сопровождается гиперкалийурией. Определенную роль в повышении потерь К+ играет метаболизм печеночного гликогена. Гиперкалиемия может быть также следствием массивных гемотрансфузий, однако важнейшими причинами ее являются потеря К+ клеткой и перемещение его сначала в интерстициальное пространство, а затем и в плазму. У тяжелобольных за неделю из клеточного пространства во внеклеточное перемещается 100—300 ммоль К+ без соответствующей компенсации. Образовавшийся избыток К+ во внеклеточном, и сосудистом секторах начинает немедленно выводиться почками. Отмечено, что потеря организмом К+ находится в тесной зависимости от выведения азота.
Внутриклеточная концентрация К+ снижается при тяжелых заболеваниях, а также при заболеваниях, сопровождающихся гипонатриемией. Как в том, так и в другом случае наблюдается не только снижение содержания электролитов, но и потеря клеточной массы. Непосредственно после травмы и оперативного вмешательства К+ покидает клетку в тесной связи с метаболическим азотом, избыточные количества которого появляются в результате клеточного белкового катаболизма. При этом возможно временное повышение уровня К+ в плазме и обязательно усиливается его экскреция с мочой. Калийурия обычно продолжается в течение всей катаболической фазы заболевания, характеризующейся повышенным выведением из организма.
Имеется множество факторов, обусловливающих перемещение К+ между клеточным и внеклеточным пространством. Осно-ные из них приведены на схеме 1.6.
Схема 1.6. Факторы, определяющие перемещения К+ между внутри- и внеклеточным пространством.
В клинических условиях к гипокалиемии относят концентрацию калия ниже 3,5 ммоль/л, а к гиперкалиемии — выше 5,5 ммоль/л. Рассмотрим основные клинические причины нарушений баланса К+. Причины гипокалиемии (концентрация К+ ниже - 3,5 ммоль/л): 1) потеря жидкостей из желудочно-кишечного тракта (при сопутствующей потере С1~ быстро развивается метаболический алкалоз); 2) длительное лечение осмотическими диуретиками или салуретиками (маннитол, фуросемид), а также диабетическая глюкозурия; 3) стрессовые состояния, сопровождающиеся повышенной адреналовой активностью и диурезом, болезнь Кушинга; 4) недостаточное введение К+ в послеоперационном и посттравматическом периодах в сочетании с задержкой Na+ в организме (ятрогенная гипокалиемия); 5) постгипоксические состояния, в результате которых нарушается функция почек и возникает калийурия; 6) длительная терапия стероидными гормонами; 7) дилюционная гипокалиемия в фазе регидратации после острой или хронической дегидратации; 8) хроническая почечная недостаточность. Причины гиперкалиемии (концентрация К+ выше 5,5 ммоль/л): 1) острая и хроническая'почечная недостаточность нефритического и нефросклеротического происхождения, а также окклюзия почечных сосудов;
2) острая дегидратация и симптоматическая олигурия; 3) обширные травмы, компрессионный синдром, ожоги или крупные операции, усиленные предшествующими тяжелыми заболеваниями; 4) тяжелый метаболический ацидоз и шок; 5) хроническая адреналовая недостаточность; 6) быстрая инфузия концентрированного (более 50 ммоль/л) раствора К.+ (приблизительно 0,4% раствор КС1). Существуют два главных пути потери К+ — желудочно-кишечный тракт и почки. Наиболее массивные потери К+ происходят при многократной рвоте, кишечной непроходимости, а также при заболеваниях, сопровождающихся диареей. Избыточные потери К+ почечным путем наиболее часто возникают в связи с длительной диуретической терапией. Кишечные и желчные свищи, а также обширные ожоговые поверхности — второстепенные каналы потерь К+. Хотя гипокалиемия чаще возникает при чрезмерных внешних потерях К+ организмом, в ряде случаев она наступает и без видимых потерь его, если появляется фактор, способствующий проникновению К+ в клетку, например алкалоз или повышенное содержание инсулина в крови. В таких случаях общее содержание К+ остается прежним, меняется лишь его распределение. Поскольку уровень К+ в крови довольно тесно коррелирует с КОС, в частности с рН крови, появились попытки определять общий дефицит К+ с помощью номограмм. Приводим одну из таких номограмм и правила пользования ею (рис. 1.2). Правила пользования номограммой и расчет дефицита К+ в организме. 1. Определить концентрацию К+ в плазме и рН плазмы. 2. Определить дефицит или избыток К+, используя номограмму. 3. Рассчитать должное содержание К+ у данного больного, используя контрольные нормы содержания К+. У мужчины нормального сложения с массой тела 70 кг общее содержание К+ составляет 3159 (45 Х 70) ммоль. 4. Используя полученные по номограмме данные, выраженные в процентах дефицита или избытка, и данные должного содержания К+, можно вычислить абсолютный дефицит (избыток).
Рис. 1.2. Номограмма для определения общего дефицита К+ в организме по величине рН и концентрации К+ в плазме. По оси абсцисс — дефицит или избыток общего К.+ в организме (в процентах).
1.3. ЭКГ при изменениях концентрации К+ в плазме. а – гипокалиемия; б — гиперкалиемия.
Гиперкалиемия может возникать в связи с избыточным внутривенным введением К+, недостаточным выведением его почками при снижении концентрации альдостерона, а также при усиленном выходе К+ из клеток во внеклеточную жидкость. Внеклеточный ацидоз, имеющий, как правило, метаболическое происхождение, обычно сочетается с гиперкалиемией, а внеклеточный алкалоз ведет к гипокалиемии. Непосредственная опасность общей и главным образом клеточной гнпокалиемии заключается в том, что при ней прежде всего страдает сократительная функция мышц, в том числе миокард и гладкая мускулатура кишечника, и возникает гипорефлексия. При гипокалиемии возможно развитие параличей скелетной мускулатуры, паралитической непроходимости, сердечных аритмий, а также повышенной чувствительности к препаратам наперстянки. При выраженной и длительной гипокалиемии наблюдается резкая слабость, иногда сопорозное состояние. Нарушения баланса К+ оказывают большое влияние на ЭКГ (рис. 1.3). Длительная гипокалиемия, вызванная острыми или хроническими потерями К+ через желудочно-кишечный тракт, неизбежно сочетается с метаболическим алкалозом. Довольно часто гипокалиемия сочетается с потерей С1—, и тогда метаболический алкалоз становится не только гипокалиемическим, но и гипохлоремическим. Обычно при этом концентрация К+ в плазме падает ниже 3 ммоль/л, С1—— ниже 90 ммоль/л. Механизм алкалоза при гипокалиемии связан с перемещением части Н+ из внеклеточного пространства (где их можно определить) в клеточное взамен покинувших клетку катионов К+. Таким образом, определяемый нами гипокалиемический (плазменный) алкалоз почти всегда означает развитие клеточного ацидоза. Совсем иной механизм имеет алкалоз, возникающий в результате первичной потери С1—. В этом случае организм начинает задерживать НСО3—, чтобы уравновесить потерю С1—. В отличие от гипокалиемического этот вид метаболического алкалоза является истинным и не сопровождается накоплением Н+ в клетке.
Для лечения этих состояний целесообразно вводить раствор КС1, так как первоначальная потеря С1— в условиях алкалоза обязательно сопровождается усиленным выделением почками К+ при увеличении канальцевой реабсорбции НСО3— и, следовательно, при задержке его в организме. При этом моча имеет выраженную кислую реакцию (парадоксальная ацидурия). При алкалозе любого происхождения переход кислой реакции мочи в щелочную должен оцениваться как благоприятный симптом, означающий начало разрешения алкалоза. Лечение гипокалиемии состоит во введении раствора КС1, концентрация которого не должна превышать 40 ммоль/л. Напомним, что в 1 г КС1, из которого приготовляют раствор для внутривенного введения, содержится 13,6 ммоль К+. Следовательно, для того чтобы получить, раствор нужной концентрации, в 1 л воды следует растворить 3,3 г КС1. Концентрация вводимого в растворе КС1 не должна превышать 1%. Скорость введения раствора не должна превышать 30 ммоль/г, за исключением случаев, когда лечение проводят по жизненным показаниям, в частности при гипокалиемической интоксикации наперстянкой или гипокалиемическом параличе. Терапевтическая доза К+ составляет 60—120 ммоль/сут, однако по показаниям его применяют и в больших количествах. Мы наблюдали больного М.,. 28 лет, у которого в результате длительной диуретической терапии лазиксом, проводимой в течение 2 мес по поводу асцита и отеков миокардиального происхождения, развились глубокая гипокалиемия и умеренная гипонатриемия на фоне декомпенсированного гипокалиемического алкалоза. При поступлении: содержание в плазме К+ 2,5 ммоль/л, Na+ 134 ммоль/л, рН крови 7,62, BE 18 ммоль/л. При массе тела 55 кг рассчитанный дефицит К+ 180 ммоль. В 1-е сутки назначены 150 ммоль К+ в виде 1% раствора КС1 (11,2 г соли) в изотоническом растворе глюкозы, инсулин подкожно (1 ЕД на 4 г сухого вещества глюкозы). В течение 2 сут больной получил 107 ммоль К+ (8 г КС1) и 40 ммоль Na+ (около 250 мл изотонического раствора хлорида натрия), в течение 3 — 54 ммоль К+ и 40 ммоль Na+. Уже к началу 2-х суток лечения наметилась тенденция к снижению гипокалиемии и метаболического алкалоза. В течение последующих 4 сут введено по 40 ммоль К+ и Na+ под контролем лабораторных данных. К исходу 1-й недели лечения зарегистрирована нормализация всех показателей, что позволило прекратить инфузионное лечение. Восстановились диурез и нормальная экскреция электролитов. При олигурии К+ следует назначать с осторожностью. В большинстве случаев лучше не применять его. Обычно в течение 24—48 ч после тяжелой операции или травмы нет необходимости назначать К+, так как его уровень в крови в данном периоде продолжает оставаться нормальным. Обычно это совпадает с олигурической фазой послеоперационного периода. В дальнейшем может возникнуть необходимость в лечении гипокалиемии и предупреждении метаболического алкалоза. Если диурез составляет не менее 30 мл/ч, то лечение препаратами К+ показано даже в острой фазе посттравматического и послеоперационного периода. Целесообразно вводить около 40 ммоль К+ (около 3 г КС1) или аспарагината калия (панангин). Гиперкалиемия возникает либо в результате острой почечной недостаточности, либо при ошибочном лечении препаратами К+ на фоне начинающейся или хронической почечной недостаточности. Диагноз гиперкалиемии можно поставить при содержании К+ в плазме выше 5,5—6 ммоль/л. Концентрация 7 ммоль/л представляет значительную угрозу для жизни. Основная опасность гиперкалиемии — внезапная остановка сердца. Лечение гиперкалиемии направлено на снижение уровня К+ в плазме. Целесообразна такая последовательность мероприятий. 1. Внутривенно вводят лазикс (240—1000 мг). Диурез считается удовлетворительным, если в течение суток выделилось не менее 1 л мочи нормальной плотности. С теоретических позиций освобождение внеклеточной жидкости от избытка К+ при достаточно сохранившейся функции почек — задача не слишком сложная. У взрослого человека объем внеклеточной жидкости, в том числе плазмы, составляет около 22% массы тела и равен 15,5 л. Следовательно, задача заключается в том, чтобы вывести из организма всего 31 ммоль К+, чтобы его концентрация снизилась с опасного уровня (7 ммоль/л) до 5 ммоль/л. Это составляет всего 1209 мг (31X39), т. е. 1,2 г калия. Однако при тяжелой почечной недостаточности даже с этой задачей справиться трудно. 2. Другой путь заключается в том, чтобы направить часть внеклеточного К+в клетку, связав его каким-либо метаболическим процессом. Наиболее подходящим является синтез гликогена, который в норме протекает с участием К+. Для этого вливают внутривенно около 1 л 10% раствора глюкозы с инсулином в расчетной дозе (1 ЕД на 4 г чистого вещества глюкозы), который вводят только подкожно. 3. Внутривенно вводят глюконат кальция для уменьшения влияния гиперкалиемии на сердце. 4. В отсутствие эффекта терапевтических мероприятий показан гемодиализ. Кальций. В человеческом организме кальция содержится больше, чем других минеральных веществ, однако лишь небольшая часть его (около 1000—1500 г) может быть определена химическим анализом. Кальций, составляющий основу костной ткани, является практически необмениваемым, и учесть его невозможно. Только небольшая часть кальция, участвующего в метаболизме, может быть определена лабораторными методами. В норме кальций всасывается в желудочно-кишечном тракте и выделяется главным образом кишечником. Почечная экскреция кальция невелика и составляет в сутки не более 200 мг. Более высокая почечная экскреция кальция, достигающая 800—1000 мг/сут, наблюдается при заболеваниях, нарушающих кальциевый обмен,— гиперпаратиреозе и костных метастазах рака. Нормальное содержание кальция в плазме составляет 2,1—2,65 ммоль/л. Около 50% общего кальция плазмы связано с белками, преимущественно с альбумином, 10% находится в составе растворимых комплексов, 40% — в свободной ионизированной форме. С точки зрения клиники и метаболизма наиболее важной частью общего пула кальция является ионизированный (Са2+), поскольку именно его изменения обусловливают возникновение клинических симптомов. До появления потенциометрических анализаторов Са2+ измерение их концентрации традиционными лабораторными методами было трудоемким и приходилось ориентироваться по результатам определения общего кальция плазмы и различным номограммам. В частности, считалось, что уменьшение содержания альбумина в плазме крови на 10 г/л обычно сопровождается снижением концентрации Са2+ на 0,2 ммоль/л. В настоящее время определение концентрации Са2+ не представляет затруднений. Гиперкальциемия (уровень кальция в плазме выше 2,75 ммоль/л при многократном исследовании). Кроме чисто лабораторных ошибок, недостоверные результаты исследований (завышение) могут быть связаны с наложением жгута на конечность при взятии крови на анализ. Ацидоз повышает уровень кальция в крови. Гиперкальциемия принципиально может быть обусловлена тремя группами причин: разрушением костного пула кальция (множественная миелома, метастазы опухолей молочной железы, легких, почек и др. в кости, гиперпаратиреоз, длительная иммобилизация, гипертиреоз и аддисонова болезнь), повышением всасывания из кишечника (саркоидоз, интоксикация витамином D и гиперпаратиреоз) и снижением интенсивности удаления кальция из плазмы (диуретическая терапия с использованием диуретиков группы бензотиадизина, например дихлотиазида, адреналовая недостаточность, потеря фосфатов). При выраженной гиперкальциемии могут возникать головная боль, утомляемость, усталость, жажда, иногда психотические состояния. Развиваются также анорексия, тошнота и рвота, боли в животе, запор, полиурия. На ЭКГ можно видеть укорочение интервала Q— Т. Интенсивность лечения гиперкальциемии зависит не только, от лабораторных показателей, но и от выраженности клинических симптомов. Обычно путем гидратации больного изотоническим раствором хлорида натрия (по 200 мл/ч) и введением фуросемида (40—80 мг каждые 2 ч) удается активировать почечную экскрецию кальция. Иногда добавляют гидрокортизон по 50—100 мг внутривенно каждые 6 ч (или преднизолон по 40— 100 мг в сутки) в сочетании с кальцитонином по 50 ME каждые 3 ч [Binstock M. L., Mundy G. R., 1980]. Гипокальциемия (уровень кальция в плазме ниже 2,1 ммоль/л). Наиболее общей и частой причиной ее является гипоальбуминемия, развивающаяся при нефротическом синдроме, хронических заболеваниях печени, сепсисе и других тяжелых состояниях. Поскольку концентрация Са2+ при этом не меняется, лечить подобную гипокальциемию введением растворов хлорида (глюконата) кальция бессмысленно; необходимо повысить уровень альбумина. Причинами истинной гипокальциемии, обусловленной снижением концентрации Са2+ в плазме, могут быть гипопаратиреоз (обычно после тиреоидэктомии), дефицит в организме витамина D, отклонения от рекомендованной диеты и нарушения всасывания в кишечнике, почечные болезни, длительная стероидная терапия, панкреатит, синдром Кушинга, почечный канальцевый ацидоз, дефицит магния в организме и прием фенобарбитала. Клинически гипокальциемия проявляется тетанией, спазмом мышц кистей и стоп, положительными симптомами Хвостека и Труссо. Возможны расстройства сознания. На ЭКГ удлиняется интервал Q—Т. Для лечения внутривенно медленно вводят 10—30 мл 10% раствора глюконата кальция. Темп введения не должен превышать 2 мл/мин. Затем в течение 4—12 ч капельно вводят 15 мг/кг Са2+ в форме хлорида (или глюконата; необходим соответствующий расчет) в 1000 мл полиглюкина. Для взрослого человека это составит примерно 100 мл 10% глюконата кальция. Магний. Нормальное содержание магния в плазме крови составляет 0,75—1,6 ммоль/л. Поскольку магний хорошо экскретируется почками, истинная гипермагнезиемия (уровень магния в плазме больше 1,6 ммоль/л) может наблюдаться у больных с острой почечной недостаточностью. При этом возникает необходимость гемодиализа, который, как правило, дает хорошие результаты. Возможны две конкретные причины гипермагнезиемии: неконтролируемый прием антацидных средств при скрытой почечной недостаточности и лечение токсикоза беременных внутривенным введением сульфата магния. Клинические симптомы (мышечная слабость вплоть до параличей, гипорефлексия и ослабление дыхательной мускулатуры) могут развиваться при концентрации плазменного магния свыше 2—4 ммоль/л, полный паралич дыхательной мускулатуры — при 7—8 ммоль/л. Для лечения в легких случаях бывает достаточно прекратить введение магния. У больных в критических состояниях гипомагнезиемия (содержание магния в плазме ниже 0,75 ммоль/л) встречается не столь редко. В известной степени этому способствует то обстоятельство, что определение концентрации в плазме магния не входит в скрининговый список анализов даже у больных в критических состояниях (так называемый забытый ион, по терминологии американских авторов). Основные причины гипомагнезиемии: 1) недостаточное питание, например у больных алкоголизмом; 2) потери магния через желудочно-кишечный тракт, в частности при острой кишечной непроходимости, остром панкреатите; 3) состояние высокого осмотического диуреза, например ги-леральдостеронизм, диабетический кетоацидоз, другие варианты осмотической полиурии; 4) фармакологический диурез (фуросемид, аминогликозиды, дигиталис). Дефицит магния в плазме часто сочетается с гипокальциемией. В отдельных случаях это может быть опосредовано угнетающим действием магния на функцию паращитовидной железы, что приводит к снижению уровня кальция в крови. Клинически это состояние наиболее часто выражается мышечной слабостью, иногда тоническими судорогами (главным образом вследствие гипокальциемии) и дисфагией. В случаях высокого диуреза гипомагнезиемия, как правило, сочетается с гипокалиемией. При хронической гипомагнезиемии лечение может быть достаточно эффективным при назначении 4—5 г (32—40 ммоль) сульфата магния внутрь. При критических состояниях вводят внутривенно капельно по 20—40 мл 25% раствора сульфата магния. Хотя препараты магния относительно безопасны, быстрое внутривенное введение их (особенно больным с токсемией) может вызвать гипотензию и гипорефлексию вплоть до ослабления дыхания. Хлор. Общее содержание С1— в организме здорового человека с массой тела 70 кг составляет около 2000 ммоль, т. е. около 30 ммоль/кг. Q- является главным внеклеточным анионом. Его концентрация во внеклеточной жидкости и плазме составляет 103—110 ммоль/л. Небольшая часть С1— имеется и в клетках (до 6 ммоль/л). В клетках слизистой оболочки желудка, которая продуцирует НС1 в больших количествах, содержание С1~ значительно превышает эту цифру. Человек получает большое количество С1— с пищей, и их избыток выводится с мочой. Обычны изменения концентрации Na+ как при дилюционной солевой гипотонии, так и при истинном водном истощении. Возможны также отклонения в соотношениях концентраций Na+ и С1—, которые в основном объясняются тем, что эти электролиты могут покидать организм не только общими, но и разными путями. Например, С1— в значительно большей степени, чем Na+, способен выделяться с желудочным содержимым (в виде соляной кислоты). При некоторых заболеваниях в почках С1— задерживается больше, чем Na+. Ретенция С1— возможна также после пересадки мочеточников в толстый кишечник. Причины гипохлоремии (содержание С1— плазмы ниже 98 ммоль/л): 1) потери С1— через желудок при многократной рвоте в связи с язвой двенадцатиперстной кишки, высокой кишечной непроходимостью, стенозом привратника, а также интенсивные потери электролитов на других уровнях без соответствующего возмещения. Такое состояние обычно сочетается с гипонатриемней; 2) неконтролируемая диуретическая терапия (сочетается с гипонатриемией); 3) компенсаторный механизм при хроническом респираторном ацидозе; 4) гипокалиемический метаболический алкалоз; 5) хроническая и острая почечная недостаточность; 6) плазмодилюция с увеличением объема внеклеточного пространства, сопровождающаяся гипонатриемией и наблюдающаяся при тяжелых изнуряющих заболеваниях, задержке воды в организме. Причины гиперхлоремии (содержание хлоридов плазмы выше 110 ммоль/л): 1) водное истощение, сахарный диабет и повреждения ствола мозга (сочетается с гипернатриемией); 2) состояние после уретеросигмостомии (в связи с повышенной реабсорбцией С1— в толстом кишечнике). Для лечения гипохлоремических состояний внутривенно вводят растворы хлоридов в виде NaCl или КС1.
|
|||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 226; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.46.87 (0.019 с.) |