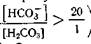Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизмы поддержания кислотно-основного состояния организмаСодержание книги
Поиск на нашем сайте
Основные механизмы элиминации кислых продуктов жизнедеятельности следующие: буферирование, экскреция СО2 легкими и экскреция фиксированных кислот почками. Буферные системы. Главным буфером плазмы и интерстициальной жидкости является бикарбонат (НСО3—). В клетках тканей, эритроцитах преобладают белковая буферная система (включая гемоглобин, частично определяющий буферные свойства внеклеточной жидкости) и фосфаты. Фактором, определяющим равновесие между буферными системами, является рН. В качестве материала для изучения и оценки активности буферных систем организма в клинической практике исследуется кровь. В известной мере это ограничивает возможность суждения о буферных свойствах белков и фосфатов, но вместе с тем обеспечивает возможность оценки главного буфера — бикарбоната и, следовательно, оценки всего кислотно-основного баланса. Для простоты буферные системы крови могут быть разделены на две группы: бикарбонатную и небикарбонатную (гемоглобин) буферные системы. В соответствии с этим буферирование и транспорт угольной кислоты (в виде НСО3—) может происходить при участии небикарбонатных буферных систем по следующей схеме: Н2СО3 + Буфер— →Буфер + НСО3— СО2 поступает из тканей в легкие главным образом в форме бикарбоната плазмы, образовавшегося внутри эритроцита в процессе буферирования угольной кислоты гемоглобином. Оставшаяся часть существует в крови в виде карбаминовых соединений и растворенной СО2. Эти реакции в легочных капиллярах происходят в обратном порядке, и СО2 экскретируется легкими со скоростью, определяемой темпом ее образования в организме. Буферирование фиксированных кислот происходит с участием бикарбонатного буфера в форме образования угольной кислоты:
Н+ + НСО3— →Н2СО3 или с участием небикарбонатного буфера: Н+•Буфер— → Н • Буфер Буферные основания Буферные кислоты
Продукция эндогенных Н+ (т. е. фиксированных кислот) может буферироваться как бикарбонатной, так и небикарбонатной буферными системами, в результате чего буферные основания превращаются в буферные кислоты. Восполнение теряемых при этом буферных оснований прямо зависит от способности дистальных почечных канальцев синтезировать бикарбонат. Это непременное условие выделения Н+ почками. В процессах буферирования фиксированных кислот бикарбонатная система количественно является наиболее важной. В каждой цельной буферной системе (т. е. смеси слабой кислоты и ее соли с сильным основанием) соотношение между кислотным и основным компонентами не равнозначно. Так, в бикарбонатной системе:
Именно этим отношением (т. е. явным преобладанием основного компонента над кислотным) и определяется величина рН, равная в норме 7,4. Как известно, концентрация свободных водородных ионов в бикарбонатной буферной системе может быть вычислена по формуле:
где К — константа диссоциации. После логарифмирования это уравнение может быть записано так:
где рН= — lg [H+]; рК=— IgK. Это уравнение называется уравнением Гендерсона — Гассельбалха. [Н2СО3] может быть заменен выражением Рсо2-0,03, так как Н2СО3 находится в равновесии с растворенной СО2, которая в свою очередь.находится в равновесии с альвеолярным или тканевым Рсо2. В представленном выражении 0,03 [ммоль/(л-мм рт. ст.)] является коэффициентом растворимости СО2 в плазме при 37 °С. Следовательно:
Так как в нормальных условиях рК составляет 6,1, а [НСО3~] 25 ммоль/л и РСО2 40 мм рт. ст., то:
Отсюда ясно, что при увеличении содержания угольной кислоты в организме отношение Эта же формула позволяет понять, что снижение рН возможно не только при увеличении содержания Н2СО3, но и при уменьшении содержания НСОз отношение (
Дыхательная регуляция КОС. Основная роль легких в отношении кислотно-основного гомеостаза состоит в экскреции СО2 и стабилизации РСО2 артериальной крови (Расо,) около. 40 мм рт. ст. При нормальной функции легких альвеолярное Рсо2 и Рас0; фактически идентичны. Экскреция СО2 равна продукции СО2. Следовательно:
где К — коэффициент пропорциональности. Дыхательный центр быстро реагирует на малейшие изменения РаСО2, поэтому всякие изменения продукции СО2 в организме сопровождаются соответствующими изменениями альвеолярной вентиляции. Почечная регуляция КОС. Почки участвуют в регуляции КОС путем стабилизации содержания [НСО3—] плазмы на уровне, близком к 22—26 ммоль/л. Основной механизм почечной регуляции связан с выведением Н+ через клетки почечных канальцев, образующихся из угольной кислоты, а также с задержкой Na+ в канальцевой жидкости (моча). Конечный результат зависит от характера буфера в канальцевой моче. Каждый миллимоль Н+, экскретируемых в форме титруемых iкислот и (или) ионов аммония (NH4+) добавляет в плазму крови 1 ммоль НСО3—. Таким образом, экскреция Н+ теснейшим образом связана с синтезом НСО3—. Количество синтезируемого бикарбоната обычно достаточно, чтобы пополнить израсходованное на нейтрализацию титруемых кислот и на буферирование эндогенного Н+. При расстройствах КОС почки могут регулировать экскрецию Н+, чтобы поддержать необходимую концентрацию его во внеклеточной жидкости или чтобы восстановить нарушенный его баланс. Почечная регуляция КОС является медленным процессом, требующим часов и даже дней для полной компенсации, и лишь финальным этапом элиминации кислот из организма. Существуют четыре возможных варианта расстройств кислотно-основного состояния: респираторные ацидоз и алкалоз, метаболические ацидоз и алкалоз (табл. 2.2). Респираторные расстройства КОС начинаются с изменений Рсо2. Для компенсации включаются буферные или почечные механизмы, которые приводят к изменениям концентрации НСО3—, способствующим восстановлению рН до исходных (хотя не всегда нормальных) величин. Метаболические расстройства вызываются изменениями содержания в плазме НСО3—. Они индуцируют дыхательный ответ, который приводит к компенсаторному (или вторичному) изменению РСО2, в результате чего восстанавливается исходный (или нормальный) уровень рН. Таким образом, компенсаторные реакции не являются самостоятельными (или независимыми) изменениями КОС, а представляют собой непременную и ин- тегрированную часть всего кислотно-основного баланса. Компенсаторные сдвиги КОС развиваются, как правило, немедленно и продолжаются (если сохранены резервы организма) до восстановления нормального кислотно-основного баланса, что выражается в нормализации рН.
2.3. Показатели кислотно-основного состояния крови и методы их определения
Показатели КОС определяют классическим эквилибрационным микрометодом Аструпа (с интерполяционным расчетом Рсо2) или методами с прямым определением Рсо2 (табл. 2.3). В основу метода Аструпа положена взаимная тесная физико-химическая зависимость между главными компонентами, от которых зависит равновесие кислот и оснований в организме. Для этого используют метод построения линий на специальной (криволинейной) номограмме Сиггаарда-Андерсена по истинному рН и величинам рН в двух пробах крови, эквилибрированных в газовой среде с содержанием СО2 4 и 8%. Таблица 2.2. Расстройства КОС
Таблица 2.3. Показатели кислотно-основного состояния
В диагностике расстройств КОС важна не только констатация самого факта расстройства, но правильная его интерпретация. Возможны три подхода к оценке выявленных фактов: на основе существующих номограмм, на основе таблиц и логический. Первые два являются классическими подходами и рассмотрены нами выше. Последний же может быть осуществлен при учете трех логических аксиом, которые были предложены Ассоциацией кардиологов США,— так называемых трех золотых правил. Хотя все три аксиомы принципиально вытекают из уравнения Гендерсона — Гассельбалха, они основаны на предположении, что это уравнение может оказаться справедливым не во всех случаях. Главное достоинство «золотых правил» в том, что они облегчают клиническую сторону интерпретации расстройств КОС организма. 1. Изменение Рсо2 крови на 10 мм рт. ст. обусловливает реципрокное изменение рН на 0,08. Например, если Рсо2 повысилось на 10 мм рт. ст. против нормального (40 мм рт. ст.), то рН в нормальной ситуации должно.снизиться с 7,4 до 7,32. Это будет указывать на чисто респираторный характер найденного изменения рН. Если показатель рН изменяется сильнее, чем ожидается при расчете по первому «золотому» правилу, то имеются основания считать, что в изменениях рН принимает участие, помимо респираторного, и метаболический компонент, например накопление органических кислот. 2. Изменение рН на 0,15 является результатом изменения концентрации буферных оснований на 10 ммоль/л. В сущности эта величина, если отбросить компенсирующие респираторные факторы, представляет собой понятие избытка (или дефицита) оснований (BE). В этом случае изменение рН является разницей между истинным рН и рН, рассчитанным на основе первого «золотого правила». Например, если измеренная величина рН составила 7,25, а Рсо2 — 40 мм рт. ст., то это, как известно, свидетельствует об отсутствии респираторной компенсации и означает, что отклонение рН от нормального (7,4) обусловлено дефицитом оснований, т. е. BE составляет — 10 ммоль/л. Следовательно, ацидоз носит чисто метаболический характер. Оба правила позволяют выявить не только изолированные, но и одновременные изменения метаболического и респираторного компонентов, но не позволяют ответить на вопрос, какая патология первична, а какая является компенсирующим изменением. Возможна также ситуация, когда оба выявленных изменения (и респираторное, и метаболическое) имеют первичный характер и возникают независимо друг от друга. Например, при Рсо2 55 мм рт. ст. и рН 7,36 мы делаем заключение о наличии гиповентиляции. Но по первому правилу при такой величине Рсо2 следовало бы ожидать снижения рН до 7,28. Установленная разница рН, равная 0,08, указывает на участие в кислотно-основном статусе метаболического фактора в форме избытка оснований приблизительно 5 ммоль/л. Таким образом, у больного имеется респираторный ацидоз в сочетании с метаболическим алкалозом. Случай, типичный, например, для хронического обструктивного заболевания легких, когда задержка СОг сочетается с компенсаторной реакцией почек, приводящей к задержке бикарбонатов в организме. Подобная ситуация может возникнуть также внезапно, например после остановки сердца при неадекватной вентиляции легких и избыточном введении бикарбоната для коррекции ацидоза. 3. Это правило представляет собой формулу для быстрого расчета избытка или дефицита бикарбоната в целостном организме и основано на предположении, что внеклеточное пространство, включая плазму (т. е. водный объем распределения бикарбоната), составляет 1/4 массы тела:
Варианты расстройств кислотно-основного состояния организма Метаболический ацидоз. Это состояние вызывается снижением содержания бикарбоната в плазме крови, которое может быть вызвано следующими причинами: 1) потерей организмом бикарбоната через кишечник или почки в результате диареи, кишечного свища, проксимального канальцевого ацидоза, ингибиции активности карбоангидразы; 2) увеличением продукции органических кислот (лактат, кетокислоты), избытком органических кислот при отравлениях ядами, например этиленгликолем; 3) нарушением почечной экскреции Н+ при почечной недостаточности и некрозе дистальных канальцев; 4) избыточным поступлением в организм кислых продуктов (NH4C1, гидрохлориды лизина или аргинина при печеночной недостаточности) или С1—, реабсорбируемых толстым кишечником у больных после наложения уретеросигмоанастомоза. Конечная концентрация НСО3—, определяющая ацидоз, зависит не только от интенсивности поступления кислот или потери бикарбоната, но также от выраженности компенсирующей почечной реакции на ацидоз. При нормальной функции почек после некоторой задержки, продолжающейся 2—3 дня, общая экскреция Н+ (а следовательно, и синтез бикарбоната канальцами) при ацидозе может превышать норму в 10 раз. Дыхательная компенсация метаболического ацидоза реализуется путем стимуляции стволовых центров, увеличивающей легочную вентиляцию. Эта вторичная компенсирующая реакция ведет к снижению Рсо2, в результате чего частично повышается рН. Она развивается и достигает максимума через 12—24 ч, поскольку гематоэнцефалический барьер довольно долго удерживает равновесие бикарбоната между плазмой и ликвором. Клинические наблюдения показывают [Albert M. D. et al., 1967J, что при устойчивом метаболическом ацидозе имеется следующее равновесие между бикарбонатом и Рсо2: Рсо2=1,5[НСО3—] +8±2.
Состояние метаболического ацидоза обычно сочетается с явлением так называемого анионного несоответствия («анионный провал»), суть которого заключается в существенном расхождении показателя, отражающего концентрацию Na+, и суммы С1— и НСО3— [Emmett M., Narins R. G., 1977]. Чтобы понять принципиальную сущность явления, следует напомнить электролитные взаимоотношения в плазме, используя так называемую диаграмму [Gamble, 1950] (рис. 2.1). Поскольку в электролитном балансе взаимодействуют ионы различной валентности, диаграмма выражается в миллиэквивалентах, а не в миллимолях. Сумма концентраций катионов равна 153 мэкв/л (149,5 ммоль/л, из которых Na+ составляет 142 мэкв/л). Для сохранения электронейтральности сумма концентрации анионов также должна составлять 153 мэкв/л. Эту сумму обеспечивают главным образом С1— (101 мэкв/л), НСО3— (24 мэкв/л) и анионные группы белков (17 мэкв/л).
Рис. 2.1. Диаграмма Гэмбла. Объяснение в тексте.
Если принять, что сумма концентраций малых плазменных катионов (K++Ca2++Mg2+), пределы колебаний которой невелики, составляет примерно 11 мэкв/л и равна сумме концентраций остаточных анионов, то электролитное равновесие можно представить следующим образом: [Na+] ≈[Cl—] + Bfl, т. е. BB ≈ [Na+] — [Cl—]. При истощении бикарбонатного (а в ряде случаев и хлоридного) пула электрическая эквивалентность поддерживается за счет возросшего содержания остаточных и фиксированных органических анионов [Oh M. S., Carroll H. J., 1977]. Таким образом, возникает как бы несоответствие между концентрацией Na+ и суммой концентраций НСО3— и С1—, которое в американской литературе именуют анионным несоответствием (провалом) (anion gap), столь характерным для метаболического ацидоза [Norman J., 1990]. Величина анионного несоответствия может быть вычислена следующим образом: Анионное несоответствие = [Nа+]пл—([С1]пл+[НСОз ]пл). На основе выраженности анионного несоответствия можно /различать два вида метаболического ацидоза, один из которых характеризуется высоким, а другой — нормальным анионным несоответствием. Клиническая картина метаболического ацидоза может характеризоваться гипервентиляцией (например, дыхание Куссмауля при диабетическом ацидозе и особенно при диабетической коме) и нарушением некоторых функций ЦНС, например сопорозным состоянием или комой. Следует подчеркнуть, что клинических симптомов, патогномоничных для метаболического ацидоза, не наблюдается. У некоторых больных состояние ацидоза может вызывать тошноту и рвоту, однако с патогенетических позиций наиболее опасны вызываемое ацидозом угнетение сократимости миокарда и периферическая вазодилатация, которые могут вести к перегрузке левых отделов сердца и отеку легких. При метаболическом ацидозе внутриклеточное накопление водородных ионов способствует движению К+ из клеточного во внеклеточное пространство. Возникает гиперкалиемия во внеклеточном секторе, которая особенно выражена у больных с почечной недостаточностью и олигурией. Гиперкалиемия наиболее часто наблюдается при ацидозе, вызванном накоплением неорганических кислот, и реже при ацидозе в связи с повышением концентрации органических кислот. При этом ацидоз нередко маскирует значительную потерю К+, которая становится очевидной лишь при проведении интенсивной корригирующей терапии. Как мы указывали, при различных вариантах метаболического ацидоза анионное несоответствие выражено по-разному или отсутствует. В определенной степени этот признак может иметь дифференциально-диагностическое значение и может облегчать клиническое понимание синдрома. В табл. 2.4 приведены основные возможные варианты изменений концентрации НСО3—, С1— и анионного несоответствия при различных типах нарушений КОС. В клинической практике метаболический ацидоз наиболее часто встречается при кислородном голодании тканей и образовании недоокисленных продуктов обмена (при переходе тканей на преимущественно бескислородный тип обмена веществ — анаэробный гликолиз) [Norman G., 1990]. Такое кислородное голодание чаще всего выявляется при тяжелых нарушениях кровообращения в результате массивной кровопотери или прогрессирующей сердечно-сосудистой недостаточности. Особенно большое количество недоокисленных продуктов образуется при полном прекращении кровообращения (клиническая смерть). Начало реанимационных мероприятий (массаж сердца и восстановление кровообращения) сопровождается выбросом этих кислых продуктов в общий кровоток. В подобных ситуациях метаболический ацидоз может быть резко выражен.
Таблица 2.4. Концентрации анионов при расстройствах КОС
Примечание. Стрелкой обозначено снижение или повышение концентрации.
Обусловленный усиленным образованием кетокислот метаболический ацидоз является постоянным спутником тяжелого сахарного диабета. Больная П., 24 лет, поступила с диагнозом: карбункул подбородочной области. В течение 4 дней температура тела высокая. С 10-летнего возраста страдает сахарным диабетом и постоянно получает инсулин (138 ЕД/сут). Обычно содержание сахара в крови 13—15 ммоль/л, в моче 130— 150 ммоль/л. Состояние при поступлении тяжелое: холодные кожные покровы, цианоз губ; возбуждение. Частота дыхания 36—40 мин—1, пульс 168 мин, артериальное давление 125/80 мм рт. ст. Содержание сахара в крови 15 ммоль/л. Несмотря на немедленное применение инсулина (80+20+10+10 ЕД) в сочетании с дезинтоксикационной трансфузионной и кардиотоническои терапией, состояние в течение 7 ч не улучшилось, в связи, с чем больная в прекоматозном состоянии переведена в отделение реанимации. Содержание сахара в крови 18,5 ммоль/л, ацетона в моче 4+. Величина рН капиллярной крови 7,01. Остальные показатели КОС выходили за рамки расчетных. Последовательно перелиты 3 дозы (по 200 мл) 4% раствора NaHCO3. После переливания первой дозы рН 7,0, второй —7,23, третьей — 7,35. К этому времени Рсо2=22 мм рт. ст., АВ =11,6 ммоль/л, SB =15 ммоль/л, ВВ =34,5, BE -12 ммоль/л. В дальнейшем трансфузионная терапия в сочетании с инсулином позволила быстро улучшить состояние больной и добиться полной нормализации показателей КОС. Распространенные воспалительные заболевания (перитонит, панкреатит и т. п.) также приводят к возникновению метаболического ацидоза. Больная Б., 78 лет, поступила с диагнозом: острый холецистит, перитонит. Срочно оперирована. Обнаружены перфоративный холецистит, разлитой перитонит. Произведены холецистэктомия, дренирование брюшной полости. Состояние после операции крайне тяжелое из-за основного заболевания, преклонного возраста и сопутствующих заболеваний: кардиосклероза, ишемической болезни сердца, мерцательной аритмии. Показатели КОС: рН 7,18, Рсо2 32,5 мм рт. ст., АВ 11,6 ммоль/л, SB 13 ммоль/л, ВВ 33 ммоль/л, BE —16 ммоль/л, Ро2 64 мм рт. ст. После переливания 400 мл 4% раствора гидрокарбоната натрия и 500 мл свежецитратной крови: рН 7,49, Роо2 26 мм рт. ст., АВ 19 ммоль/л, SB 22,5 ммоль/л, ВВ 45 ммоль/л, BE —2,1 ммоль/л, Ро2 80 мм рт. ст. Состояние несколько улучшилось, но в последующем возникла двусторонняя пневмония, прогрессировали явления перитонита. На 6-е сутки после операции больная умерла. Не менее часто метаболический ацидоз встречается при появлении относительного избытка нелетучих кислот, обусловленного значительной потерей оснований (кишечные и желчные свищи, диарея). Таким образом, основными признаками метаболического ацидоза являются снижение в крови показателей SB, ВВ и BE. Компенсаторно снижается Рсо2. При декомпенсированных состояниях происходит снижение рН крови. Острый метаболический ацидоз при рН менее 7,1 чрезвычайно опасен, так как при этом развиваются симптомы сердечно-сосудистой недостаточности. В клинических условиях столь низкий рН наиболее часто наблюдается при диабетической коме (кетоацидоз), после клинической смерти и других эпизодов угнетения системного кровообращения (лактат-ацидоз), при различных типах острых отравлений (этиленгликоль, соли аммония и др.). Примером могут служить следующие показатели метаболического ацидоза:
Метаболический ацидоз, возникающий в связи с избыточной продукцией и накоплением лактата, называют лактат-ацидозом. R. В. Cohen и Н. F. Wood (1976) описали два типа лактат-ацидоза. Лактат-ацидоз типа А (классический) возникает как следствие различных вариантов снижения перфузии тканей и прежде всего при шоке различного происхождения. Лактат-ацидоз типа В развивается вследствие диабета (не путать с кетоацидозом), при почечной и печеночной недостаточности, инфекционных заболеваниях, токсических реакциях на лекарственные вещества, применении противодиабетических препаратов группы бигуанидов (например, метформина) и при наследственных расстройствах метаболизма, в частности при дефиците глюкозо-6-фосфата. Клиническая картина лактат-ацидоза типа А определяется характером критического состояния, его вызвавшего. Как правило, наблюдаются гипотензия, цианоз, холодный пот в сочетании с гипервентиляцией. При лактат-ацидозе типа В чаще возникают симптомы отравления организма, проявляющиеся спутанностью сознания (вплоть до комы), одышкой. При этом в происхождении самого ацидоза центральную роль играет почечная недостаточность. Ацидоз, развивающийся у больных с тяжелыми отравлениями салицилатами, этиленгликолем, метанолом, паральдегидом и антифризами, как правило, является лактат-ацидозом. Уровень лактата в крови при этом повышается в 3—10 раз и достигает 8—20 ммоль/л. Лечение острого метаболического ацидоза состоит в инфузии 50 мл 8,4% раствора гидрокарбоната натрия (50 ммоль) в течение 30—40 мин. Определяют рН и, если существенных изменений этого показателя не произошло, вводят гидрокарбонат натрия повторно в той же дозе. При тяжелом кетоацидозе необходимая доза гидрокарбоната натрия составляет 100— 150 ммоль [Ireland J. Т. et al., 1980], при лактат-ацидозе — от 500 до 1500 ммоль. Раствор гидрокарбонат натрия готовят ex tempore. Стерилизацию порошка осуществляют кварцеванием с последующим его растворением в стерильной дистиллированной воде (стерилизация раствора кипячением не допускается). Гидрокарбонат натрия применяют внутривенно в виде 5% и 10% растворов либо 8,4% и 4,2% растворов для удобства перерасчета на миллимоли NaHCO3. Поскольку 1 ммоль NaHCO3 весит 84 мг, в 1 мл 8,4%, раствора содержится 1 ммоль NaHCOs, в 1 мл 4,2% раствора — 0,5 ммоль. Для приблизительного расчета необходимого количества гидрокаброната натрия при лечении метаболического ацидоза пользуются следующими формулами: а) ВЕ х масса тела/2 =Х мл 5% раствора NaHCO3 (например, BE — 7 ммоль/л; масса тела 70 кг. Для коррекции метаболического ацидоза внутривенно надо перелить 7 х 70/2 =245 мл 5% раствора гидрокарбоната натрия); б) 0,3 х ВЕ х масса тела = Х ммоль NaHCO3 (например, BE — 6 ммоль/л; масса тела 70 кг. Для коррекции метаболического ацидоза необходимо внутривенно перелить 0,3х6х70= 126 ммоль NaHCOs, т. е. 120—130 мл 8,4% раствора гидрокарбоната натрия). В последние годы к лечению метаболического ацидоза большими дозами NaHCO3 стали относиться с осторожностью. Выявлен ряд нежелательных последствий, возникающих в связи с избыточным введением Na+. Важнейшими из них являются гипернатриемия и водная перегрузка, гипокалиемия и гипокальциемия. Гипернатриемия и водная перегрузка. Первая чаще возникает при лечении лактат-ацидоза гипертоническим (8,4%) раствором NaHCO3. Наиболее опасным следствием подобной гипернатриемии является гиперосмоляльный синдром с высокой тоничностью плазмы (см. главу 1). Особенно нежелательно такое состояние при почечной недостаточности. Введение изотонического раствора NaHCO3 позволяет несколько снизить опасность этого осложнения. Рекомендуется также диуретическая терапия. В ряде случаев возникает необходимость прибегнуть к гемодиализу. Практика показывает, что врачи нередко злоупотребляют внутривенным введением NaHCO3 с целью коррекции метаболического ацидоза после остро развившейся гипоксии дыхательного или циркуляторного происхождения, например после клинической смерти. Иногда в погоне за немедленной нормализацией КОС вводят очень большие дозы NaHCO3, не считаясь с возможностью задержки Na+. В процессе лечения следует учитывать, что в критических ситуациях, а тем более при клинической смерти организм переносит тяжелейшую биохимическую травму, равносильную стрессу в результате шока или другого критического состояния. Эта травма затрагивает все клеточные структуры, в первую очередь паренхиматозные органы и мозг. Существенным образом меняется и функциональная активность почек, которые становятся неспособными к нормальной экскреции электролитов. Немалую роль играет и развивающаяся после подобной травмы активация секреции альдостерона, приводящая к задержке Na+. Приводим собственное наблюдение. У больной 37 лет с опухолью спинного мозга в периоде индукции анестезии наступила клиническая смерть с фибрилляцией желудочков. Из этого состояния больная выведена комплексом реанимационных мероприятий. Развился тяжелый метаболический ацидоз со сдвигом рН до 7,1 при BE —21 ммоль/л. С целью коррекции ацидоза внутривенно перелито 300 мл 8,4% раствора NaHCO3 (300 ммоль). По мнению врачей, результат не был достигнут, поскольку BE оставался неудовлетворительным (—10 ммоль/л). В связи с этим больная в течение ближайших 4 ч получила еще 250 ммоль NaHCO3. К вечеру метаболический ацидоз был корригирован полностью. Однако утром следующего дня выявлен декомпенсированный метаболический алкалоз со сдвигом рН до 7,55 и BE +12 ммоль/л. Диурез составил 500 мл/сут при плотности мочи 1,012 г/л. Состояние больной, несмотря на полное сознание и отсутствие явных признаков нарушения сердечной деятельности (кроме тахикардии) и дыхания, оставалось тяжелым. В течение последующих 2 сут лечение (помимо других общепринятых мероприятий) было направлено на форсирование диуреза с помощью лазикса. Эффект достигнут только на 3-й сутки лечения. Нормализация КОС наступила лишь на 5-е сутки. В этом наблюдении врачи не сумели правильно прогнозировать течение болезни и перегрузили организм гидрокарбонатом натрия, который оказался скорее вредным, чем полезным, в условиях олигурии и задержки экскреции НСО3— и Na+. Гипокалиемия возникает при интенсивной коррекции ацидоза гидрокарбонатом натрия, которая ведет к перемещению К+ в клеточное пространство. При этом осложнении целесообразно вводить препараты калия. Гипокальциемия. При хронической почечной недостаточности концентрация Са2+ плазмы всегда низкая. Терапия гидрокарбонатом натрия в этом случае может привести к углублению гипокальциемии, так как возникающий относительный алкалоз усиливает связывание кальция с белками. Может развиться кальцийзависимая тетания. Алкалоз. Возможно развитие как метаболического, так и респираторного алкалоза во время лечения острого метаболического ацидоза, возникшего в связи с задержкой органических анионов. При этом можно наблюдать быстрое повышение концентрации бикарбоната, а респираторная компенсация отстает из-за задержки восстановления равновесия уровня НСО3— между плазмой и цереброспинальной жидкостью. Рсо2 остается низким, не соответствующим повышенному уровню бикарбоната. При введении малых доз гидрокарбоната натрия опасность развития некомпенсированного алкалоза существенно уменьшается. Ухудшение оксигенации тканей. В условиях хронического ацидоза в силу влияния эффекта Бора [Рябов Г.А., 1988] оксигенация тканей облегчается, так как сродство гемоглобина к кислороду уменьшается (смещение кривой оксигенации гемоглобина вправо). Однако этот эффект в определенной степени нивелируется снижением в условиях ацидоза концентрации 2,3-дифосфоглицерата. При терапии гидрокарбонатом натрия ввиду эффекта Бора сродство гемоглобина к О2 усиливается, но синтез 2,3-ДФГ запаздывает и эффект сдвига кривой оксигенации гемоглобина влево повышается. В результате, несмотря на хорошую оксигенацию гемоглобина, ткани страдают от дефицита кислорода [Narins R. G., Gardner L. В., 1981]. Парадоксальные изменения рН цереброспинальной жидкости. При терапии ацидоза гидрокарбонатом натрия, особенно у больных с кетоацидозом, повышение рН угнетает вентиляцию (действует хеморецепторный механизм регуляции дыхания) и Рсо2 возрастает. Как известно, коэффициент диффузии СО2 в отличие от гидрокарбоната натрия высок и быстро проникающая в цереброспинальную жидкость СО2 вызывает парадоксальное снижение ее рН. В результате возможно развитие ряда неврологических симптомов вплоть до судорог, сопора и комы [Posner J. В., Plum F., 1967]. Это обстоятельство должно быть использовано как аргумент против слишком активной терапии ацидоза бикарбонатом. Применение ощелачивающего раствора трисамина для лечения ацидоза распространено меньше из-за трудности получения этого препарата и относительной его дороговизны. Некоторые преимущества трисамина (лучшее по сравнению с гидрокарбонатом натрия проникновение внутрь клетки) нивелируются побочными явлениями, возникающими при внутривенном введении препарата (в крови снижается содержание сахара и Са2+, повышается уровень К+, несколько угнетается легочная вентиляция). Лечение трисамино
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 442; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.017 с.) |






 станет меньше, чем 20:1, логарифм этого отношения станет меньше 1,3 и рН снизится, что будет отражать степень возникшего ацидоза. Наоборот, при увеличении содержания основной соли (бикарбонат) в крови отношение
станет меньше, чем 20:1, логарифм этого отношения станет меньше 1,3 и рН снизится, что будет отражать степень возникшего ацидоза. Наоборот, при увеличении содержания основной соли (бикарбонат) в крови отношение 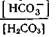 станет большим, чем 20: 1, логарифм отношения i-----L-l_ увеличится до 1,4—1,5, рН возрастет до 7,5—7,6, что будет характеризовать степень возникшего алкалоза.
станет большим, чем 20: 1, логарифм отношения i-----L-l_ увеличится до 1,4—1,5, рН возрастет до 7,5—7,6, что будет характеризовать степень возникшего алкалоза.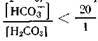 ), а возрастание рН возможно не только при увеличении содержания в крови бикарбоната, но и при уменьшении содержания угольной кислоты (отношение
), а возрастание рН возможно не только при увеличении содержания в крови бикарбоната, но и при уменьшении содержания угольной кислоты (отношение