Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Иммунная недостаточность и сепсис
Согласно современным концепциям этиологии инфекционного процесса, при нарушении специфического защитного механизма возникает инфекция, тип которой зависит от природы иммунного дефекта. Если ранее иммунная недостаточность рассматривалась как редкое событие, то сейчас считается, что она встречается довольно часто: в неонатальном периоде, при недостатке белка или витаминов в пище при различного рода интоксикациях, злокачественных опухолях и в процессе их лечения, при различного рода стрессах, нарушениях обмена и др. Существуют и генетические поздно проявляющиеся дефекты. Реализм сменил эйфорию, продолжавшуюся несколько десятилетий и связанную с успешным применением антибиотиков. Возникли проблемы, связанные с инфекциями микроорганизмами, являющимися частью нормальной микрофлоры, с которыми больной еще несколько дней назад поддерживал мирное сосуществование. При нарушении иммунной защиты происходят быстрый рост и распространение безвредной в норме микрофлоры дыхательных путей, кожи, желудочно-кишечного тракта, мочевыводящих путей. Сепсис представляет собой тяжелейшую форму генерализованной инфекции, являющуюся следствием несостоятельности защитных реакций. В механизмах его возникновения и патогенезе в определенные периоды на первый план могут выступать различные факторы: снижение фагоцитоза, обусловленное недостаточностью или потреблением антител, появление в крови блокирующих субстанций и вторичный иммунный дефицит, смена или присоединение другого возбудителя, интоксикация и поражение внутренних органов, нарушение в свертывающей системе крови и др. Нарушение иммунной защиты при сепсисе. В системе противоинфекционной защиты организма существуют три функциональных уровня. Первый — это барьеры на пути инвазии. Они включают кожу, слизистые оболочки, секрет, который нередко оказывает бактерицидное или бактериостатическое действие, механически выводит микроорганизмы или стимулирует рост одних микробов, препятствующих размножению других. В большинстве случаев клиническим проявлениям сепсиса предшествуют механические, физические или трофические нарушения целости кожных покровов или слизистых оболочек. Входными воротами инфекции могут быть локальные очаги воспаления, места инъекций, введения катетера и др. Тщательно собранный анамнез и клиническое обследование в большинстве случаев позволяют выявить места повреждения.
Второй уровень — фагоцитоз. Микробы, проникшие через барьеры, обнаруживаются, поглощаются и перевариваются в результате процесса, известного как фагоцитоз. Фагоцитарная система организма представлена циркулирующими в крови и содержащимися в рыхлой соединительной ткани нейтрофильными гранулоцитами и моноцитами, а также клетками ретикулоэндотелиальной системы. Фагоцитарная система — мощная, хорошо развитая и организованная, эффективная система защиты. Однако для ее нормального функционирования объект фагоцитоза должен быть обязательно «промаркирован» антителами (иммуноглобулины). Это необходимо для распознавания микроорганизмов в качестве чужеродного материала. Если нет антител, то фагоцитоз отсутствует или крайне мало выражен. Большинство пиогенных и кишечных бактерий патогенны только в отсутствие фагоцитов. Попадая внутрь фагоцита, они быстро погибают. В большинстве случаев патогенность этих бактерий проистекает от неспособности иммунной системы достаточно эффективно опсонизировать их антителами (рис. 9.1).
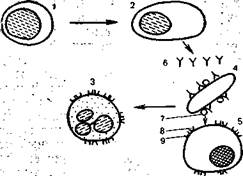
Рис. 9.1. Аллергическая атоническая реакция с участием клеток иммунной системы, гуморальных факторов и клеток-мишеней (схема). 1 — Ig Е — образующая клетка; 2 — лаброцит; 3 — клетки-мишени; 4 — lg Е-антитела; 5 — аллергены; 6 — медиаторы.
Кроме антител, главным опсонином является комплемент, особенно его третий компонент — С3b. Например, антитела к пневмококку типа 7 не инициируют фагоцитоз нейтрофильными гранулоцитами, выделенными из крови человека. Только после того, как С3b фиксируется на стенке бактерий, происходит иммунное прилипание и фагоцитоз становится эффективным. Инкапсулированные стафилококки могут быть опсонизированы как антителами, так и С3b-компонентом комплемента. В ряде случаев опсонизация может быть нарушена и ничто не сдерживает лавинообразного нарастания концентрации патогенного фактора и продуктов его метаболизма. Сказанное можно проиллюстрировать следующими примерами.
1. При изучении плевральной жидкости у больных тяжелым гнойным плевритом определялись продукты расщепления IgG. Протеазы Streptococcus pneumoniae разрушают иммуноглобулины (антитела) у человека. Аналогичным образом могут действовать и протеазы Pseudomonas aeruginosa [Doring G. et al, 1984]. 2. Свободно циркулирующие бактериальные поверхностные антигены, такие как полирибозилфосфат, при инфекции Hemophilus influenzae могут адсорбировать антитела, перед тем как последние примут участие в фагоцитозе. Это состояние получило название «синдром селективной недостаточности потребления» [Barandum S. et al., 1983]. 3. Процесс фагоцитоза может быть нарушен в самом начале и привести к непредсказуемым осложнениям. Так, циркулирующие антитела класса IgA, не активирующие систему комплемента и не инициирующие фагоцитоз, могут своим присутствием на бактериальной стенке блокировать начальный период иммунного эффекторного механизма фагоцитоза, что может привести к генерализации инфекции. Такой опосредованный IgA-ингибирующий эффект может представлять большую опасность при менингите. Этим феноменом объясняются слабая опсонизация менингококка и нередкий летальный исход при менингите. В то же время свободно циркулирующие в крови иммунные комплексы независимо от их природы могут блокировать рецепторы к Fc IgG на поверхности фагоцитов и снижать их бактерицидную активность. Эта ситуация нередко встречается при уже развившейся инфекции. При уточнении анамнеза в таких случаях выясняется, что сепсису предшествовало заболевание, протекавшее с повышением температуры и клиническими проявлениями нарушения функций легких, кишечника или мочеполовых органов. Снижение фагоцитоза в условиях инфекции, не контролируемой антибиотиками, быстро приводит к генерализации процесса и присоединению вторичной инфекции — грибковой, бактериальной, вирусной. Блокирование рецепторов на поверхности фагоцитов и их «ослепление» встречаются довольно часто при аутоиммунных процессах, протекающих с высоким уровнем иммунных комплексов в сыворотке крови: системной красной волчанке, синдроме Фелти, ревматоидном артрите. Третий уровень защиты организма от патогенных факторов бактериальной природы представлен антителами, образующимися в плазматических клетках и циркулирующими в сыворотке, а также большим количеством лимфокинов — трансмиттеров иммунной системы, образуемых сенсибилизированными лимфоцитами. Идентифицировано 5 классов иммуноглобулинов (IgA, IgM, IgG, IgE, IgD), или антител, каждый из которых выполняет специфическую гуморальную иммунную функцию. После контакта с инородным материалом (антиген) или после «сигнала» от Т-лимфоцитов или макрофагов В-лимфоциты быстро делятся и дифференцируются в плазматические клетки, активно продуцирующие антитела. Последние в количествах, превышающих необходимые, начинают появляться в кровотоке спустя 48—72 ч после первичного контакта В-лимфоцитов с антигеном [Петров Р. В., 1983]. Диагностика иммунной недостаточности. Современная лаборатория клинической иммунологии имеет довольно широкий набор диагностических тестов. Существуют тесты общего порядка: Т- и В-лимфоциты, бласттрансформация, уровень иммуноглобулинов в сыворотке крови. При необходимости выполняются дополнительные исследования [Зимин Ю. И. и др., 1982].
Неспособность человека образовывать антитела в нужных количествах или задерживать их в циркуляции способствует развитию характерных клинических проявлений, известных как «синдром недостаточности антител». Больные в таких случаях аномально подвержены инфекциям, особенно рецидивирующим-бактериальным. Инфекции с трудом поддаются терапии антибиотиками. При иммунологическом обследовании обращает на себя внимание уменьшение в сыворотке крови концентрации всех классов иммуноглобулинов или отсутствие повышения их уровня, характерного для инфекционного процесса. Однако при селективных формах недостаточности антител генерализованные инфекции могут протекать при нормальном или даже повышенном уровне иммуноглобулинов. У детей, родившихся преждевременно (срок беременности: 30—37 нед), обнаруживается выраженная гипогаммаглобулинемия. Она является следствием незрелости плаценты и ее неспособности транспортировать IgG, а также отсутствия синтеза антител у плода. У детей, рожденных в срок, сохраняется довольно высокий уровень IgG в сыворотке. Однако данный белок имеет материнское происхождение и концентрация его понижается в течение первых недель жизни. Частота тяжелых генерализованных инфекций у новорожденных составляет от 0,2 до 1,5%. Следует помнить, что в 35% случаев смерть в течение первого года жизни является следствием сепсиса или септической пневмонии. Иммунологическая незрелость плода является важнейшим фактором возникновения перинатальных инфекций. Даже в настоящее время, несмотря на антибиотики, летальность новорожденных при сепсисе очень высока. По мере инволюции органов иммунной системы у лиц пожилого или старческого возраста первичный иммунный ответ может существенно не изменяться. Однако снижение разнообразия иммуноглобулинов (антитела) прогрессирует. Их концентрация в сыворотке может оставаться нормальной, а за счет избыточной моноклональной пролиферации даже увеличиваться. Врожденная недостаточность антител проявляется как аномальная подверженность инфекциям, особенно рецидивирующим инфекциям респираторного или желудочно-кишечного тракта. Нередко начало септицемии связано с локальным воспалительным процессом. Врожденные нарушения проявляются клинически в раннем детском возрасте или позже, особенно в 20—30 лет. Диагностика этой формы недостаточности антител основывается обычно на определении иммуноглобулинов сыворотки крови. Происходит снижение уровня всех иммуноглобулинов или отдельных классов, или субклассов. Селективный врожденный дефект, проявляющийся отсутствием или снижением синтеза одного из субклассов IgG или отсутствием антител определенной специфичности, возможен и при нормальном уровне иммуноглобулинов.
Рис. 9.2. Клеточный и гуморальный иммунные ответы (схема). 1 — В-лимфоцит; 2 — плазматическая клетка: 3— нейтрофильный гранулодит; 4 — бактерия; 5 — звездчатый ретику-лоэндотелиоцит; 6 — иммуноглобулины (антитела); 7 — С3b-компонент комплемента; 8 —рецептор к С3b; 9 —рецептор к Fc иммуноглобулина.
Приобретенный (симптоматический) синдром недостаточности антител встречается довольно часто при многих заболеваниях. Не всегда можно установить, является недостаточность антител вторичной для данного заболевания или она была причиной и вызвала его. Нарушения этого типа наиболее характерны при опухолях лимфоретикулярных тканей, особенно имеющих В-клеточную природу: хроническом лимфолейкозе, лимфомах, доброкачественной и злокачественной парапротеинемии и др. Происходит уменьшение числа или полное исчезновение нормальных поликлональных, секретирующих иммуноглобулины плазматических клеток в костном мозге и лимфоидной ткани. Нормальные клетки замещаются злокачественными, внешне имеющими интактную структуру. В некоторых случаях ткани, участвующие в формировании иммуноглобулинов, могут быть разрушены лимфотропным вирусом (в частности, при инфекционном мононуклеозе). В отсутствие иммунологических нарушений недостаточность специфических антител может развиться в процессе инфекционного заболевания, если продукция специфических антител отстает от их потребления, иначе говоря, связывания антигена. Этот синдром получил название «селективная недостаточность потребления». Возникает временная селективная недостаточность антител, которая часто ассоциируется с нормо- и даже гипериммуноглобулинемией. Такое маскированное иммунодефи-цитное состояние постоянно прогрессирует, если синтез нормальных антител ограничен (например, у недоношенных детей, при старении и фармакологической или лучевой иммунодепрессии) [Barandum S. et al., 1983]. В большинстве случаев при сепсисе изменяются многие иммунологические показатели. Характеризуя состояние иммунной системы при сепсисе в целом, можно говорить о глубоком иммунном дефиците, который, несомненно, является причинным и осложняющим фактором в течении заболевания. Сепсис, начавшись на фоне иммунной недостаточности, усугубляет ее, нередко до фатального состояния. Этим можно объяснить присоединение другой инфекции, смену возбудителя, появление аллергических процессов, нарушение регенерации.
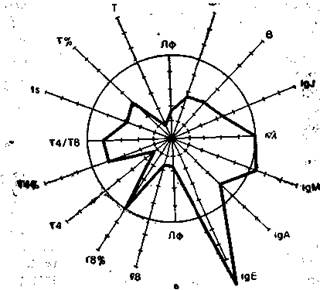
На рис. 9.3 в виде радиусов в системе полярных координат отложены иммунологические показатели, конкретных людей в процентах к норме (группа из 25 здоровых людей), представленной в виде окружности. Результаты отдельных тестов, характеризующих функционирование иммунной системы, представлены в виде векторов: лимфоциты в 1 мм3 крови (Лф), Т-лимфоциты в абсолютных значениях на 1 мм3 крови и в процентах (Т, Т%), вспомогательные клетки (Т4 и Т4%), супрессорные Т-клетки (Т8 и Т8%), реакция бласттрансформации in vitro под влиянием КонА (Is), IgM, IgA, IgG, IgE —иммуноглобулины в сыворотке крови, В-лимфоциты (В), фагоцитоз (Фг), соотношение к- и А,-цепей иммуноглобулинов в сыворотке. Иммунологические показатели интактного донора (см. рис. 9.3) отличаются не более чем на 10% от средних значений нормы. Площадь многоугольника, в определенной степени характеризующая иммунный статус человека, приближается к площади круга (норма).
Рис. 9.3. Иммунный статус интактного донора (а), больного в предсептиче-ском состоянии (б) и при сепсисе (в). Объяснение в тексте.
Результаты обследования больного представлены на рис. 9.3, б, в (предсептическое состояние и сепсис). При сепсисе быстро уменьшается площадь многоугольника. Происходит как бы «коллапс» в иммунной системе, причем это касается как реакций клеточного иммунитета (левая сторона многоугольника), так и гуморального (правая сторона). Следствием дисбаланса в иммунной системе может быть повышение уровня IgE, имеющего прямое отношение к аллергическим реакциям (см. выше). Принципы профилактики и терапии септических состояний. Адекватная терапия заболеваний, вызывающих недостаточность иммунитета, компенсация сопутствующих нарушений микроциркуляции, водно-солевого баланса, потери белка, а также хирургическая санация абсцесса, флегмоны или эмпиемы, детоксицирующая терапия и др. являются важными моментами эффективной профилактики и терапии сепсиса. К основным принципам терапии и профилактики сепсиса необходимо отнести: уход, применение антибиотиков, выведение ингибирующих факторов (плазмаферез, гемосорбция, гемодиализ, селективная плазмафильтрация), заместительную терапию (препараты иммуноглобулинов для внутривенного введения, тимопептиды, свежезамороженная плазма, гипериммунная сыворотка, лейкоцитная масса), стимуляцию эффекторного звена клеточного иммунитета. Независимо от природы иммунной недостаточности (гипопротеинемия, облучение, интоксикация, кровопотеря и др.) у больных выявляется повышенная чувствительность к инфекции. В соответствии с этим и строится режим. В особо тяжелых случаях (агаммаглобулинемия, агранулоцитоз) больного помещают в палату, где обеспечивается стерильное содержание. Антибиотики были и остаются эффективным средством лечения инфекционных осложнений при иммунной недостаточности. Следует указать на два важных аспекта. Во-первых, антибиотики эффективны только при сохранившихся иммунных реакциях. Многолетний опыт лечения больных с врожденным иммунодефицитом свидетельствует, что без иммунного ответа не удается достигнуть положительных результатов. Во-вторых, при нарушении фагоцитоза рекомендуется использовать антибиотики, избирательно накапливающиеся в макрофагах (например, рифампицин). Некоторые микроорганизмы способны выживать в фагоцитах и даже размножаться в них, следствием чего нередко бывает хроническая инфекция. Антибиотики, накапливающиеся в фагоцитах, усиливают функцию инактивирования бактерий. Успех лечения антибиотиками зависит от ряда факторов: 1) идентификации возбудителя, что является крайне сложной задачей, если лечение сепсиса уже начато; 2) чувствительности микроорганизма к антибиотику; 3) транспорта антибиотика к месту инфекции в достаточной терапевтической концентрации. Опыт показывает, что необходимы дополнительные знания, касающиеся взаимоотношений между организмом, антибиотиком и микробом. Антибиотики сами по себе недостаточно эффективны при лечении септических состояний. В лучшем случае они помогают выиграть время для проявления защитных реакций и для иммунологической ликвидации инфекции. В тех нередких случаях, когда защитные системы организма не работают, ан-тибиотикотерапия безуспешна. При многих септических состояниях в сыворотке крови появляются блокирующие факторы макромолекулярной природы, препятствующие нормальному течению иммунных реакций. Это могут быть иммунные комплексы, продукты жизнедеятельности микроорганизмов, эндо- и экзотоксины, разного рода протеазы, продукты распада тканей. Применение плазмафереза, гемосорбции или гемодиализа может способствовать восстановлению иммунного реагирования (рис. 9.3). На фоне детоксикационной терапии, достигаемой экстракорпоральными методами, повышается эффективность всех последующих вмешательств. Классическим показанием к заместительной терапии препаратами иммуноглобулинов для внутривенного введения является гуморальная иммунная недостаточность. Этот вид лечения рекомендуется при тяжелых бактериальных или вирусных инфекциях у больных со сниженным или нормальным уровнем иммуноглобулинов в сыворотке. При назначении препаратов этой группы исходят из того, что в основе тяжелых инфекций лежит либо первичная, либо вторичная недостаточность (потребление) антител. Поливалентные препараты иммуноглобулинов (иммуноглобулин внутривенный, гипериммунная сыворотка) содержат по крайней мере 10 млн различных типов антител. Стимуляция эффекторного механизма клеточного иммунитета позволяет усилить, иммунный ответ при профилактике бактериальных и вирусных инфекций. Результат зависит от дозы и времени применения, а также от возраста больного и генетических факторов. Препараты иммуноглобулинов эффективны при хронических рецидивирующих инфекциях и при вспомогательной терапии у больных различными видами опухолей. Их используют с целью компенсации иммунодепрессии, вызванной облучением, химио- или стероидной терапией, а также при различного рода стрессах. К стимуляторам эффекторного механизма иммунных реакций относят левамизол, диуцифон, цимети-дин, интерферон и его индукторы. Таким образом, достижения клинической иммунологии и иммунофармакологии и накопленный в последние годы опыт коррекции иммунодефицитных состояний позволяют сделать вывод, что современная клиническая медицина располагает средствами диагностики, профилактики и лечения иммунной недостаточности, предшествующей сепсису или усугубляющейся на фоне era течения.
|
|||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 247; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.53.209 (0.021 с.) |