
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Факторы, влияющие на скорость химической реакцииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Скорость химической реакции зависит от условий, в которых она протекает. Рассматриваемые ниже факторы, влияющие на скорость протекания реакций, относятся к гомогенным реакциям I. Природа реагирующих веществ. Под природой реагирующих веществ понимают природу химической связи в молекулах реагентов и ее прочность. Разрыв связей и образование новых связей определяют величину константы скорости, и тем самым влияют на процесс протекания реакции. II. Концентрация реагирующих веществ. Необходимым (но не достаточным) условием для того, чтобы молекула А прореагировала с молекулой В, является столкновение этих молекул. Вероятность столкновения молекул напрямую зависит от количества молекул в единице объема, а оно определяется концентрациями реагирующих веществ. Вероятность столкновения двух молекул равна произведению вероятностей нахождения каждой из молекул в точке столкновения. Следовательно, скорость элементарной химической реакции, заключающейся в одновременном взаимодействии одной или нескольких частиц, пропорциональна произведению концентраций реагирующих веществ в степенях, указывающих количество молекул данного сорта, участвующих в реакции (стехиометрические коэффициенты). Зависимость скорости элементарной химической реакции: аА + bВ = dD + еЕ от концентраций реагирующих веществ описывается следующим уравнением: V = k·[А]a · [В]b, где k— константа пропорциональности, называемая константой скорости химической реакции, [А], [В] — концентрации веществ А и В, выраженные в единицах моль/л, а, b — стехиометрические коэффициенты. Если в уравнении, связывающем скорость реакции с концентрациями, приравнять их к единице, то получим, что скорость реакции будет равна постоянной величине k. Из этого равенства следует физический смысл константы скорости химической реакции. Константа скорости химической реакции численно равна скорости реакции при концентрациях реагирующих веществ, равных одному молю на литр, т. е. константа скорости равна удельной скорости реакции. Однако, как уже отмечалось выше, подавляющее большинство реакций идёт в несколько стадий. Поэтому кинетическое уравнение обычно имеет вид: V = k∙[А]m ∙ [В]n где т, п — величины, определяемые экспериментально. Пусть реакция А+2В=АВ протекает в две стадии: V1 = k1∙[А] ∙ [В]1,1 экспериментально определенная скорость реакции
Сумма показателей степеней концентраций реагентов в кинетическом уравнении реакции называется порядком химической реакции. Для уравнения, приведенного выше, порядок реакции равен (т + п). Порядок по данному веществу (частный порядок) определяется как показатель степени при концентрации этого вещества. Так порядок по веществу А равен т. Например, общий порядок реакции: Н2 + I2 = 2 НI равен двум, частные порядки по водороду и по иоду равны единице. Данная реакция относится к простым реакциям, т.е. протекает в одну стадию в соответствии со стехиометрическим уравнением. Химические реакции можно классифицировать по числу частиц, участвующих в одном элементарном химическом акте. Количество частиц, участвующих в элементарном химическом акте называется молекулярностью реакции. В соответствии с этим признаком реакции делятся на: мономолекулярные — реакции, в которых такой акт представляет собой химическое превращение одной молекулы (реакции изомеризации, диссоциация молекул, радиоактивный распад); бимолекулярные — реакции, в которых элементарный акт осуществляется при столкновении двух молекул; тримолекулярные — реакции, протекающие при столкновении трех молекул. Элементарный акт реакции состоит в таком соударении молекул, при котором разрываются старые и образуются новые связи. Совокупность реакций из элементарных стадий называется механизмом реакции. Вероятность столкновения трех молекул при нормальном давлении мала, поэтому тримолекулярные реакции весьма редки. Реакции большей молекулярности практически не встречаются. Стехиометрическое уравнение реакции отражает материальный баланс, но не механизм реакции. Большинство реакций представляют собой совокупность нескольких последовательных стадий, каждая из которых может относиться к любой из указанных выше кинетических групп. И только для небольшого числа реакций механизм реакции совпадает со стехиометрическим уравнением. Молекулярность реакции — теоретическое понятие. Для того чтобы определить молекулярность реакции, необходимо знать механизм ее протекания. Порядок реакции является экспериментальной величиной и определяется по зависимости скорости реакции от концентраций веществ, найденной из опытных данных. Только для простых реакций, механизм которых соответствует стехиометрическому уравнению, порядок реакции и молекулярность имеют одинаковое значение. Например, реакция синтеза иодоводорода формально является бимолекулярной реакцией, и порядок ее согласно уравнению равен двум. В большинстве же случаев порядок реакции и молекулярность не совпадают. Общий порядок реакции определяется порядком наиболее медленно идущей стадии. Таких стадий может быть несколько, и поэтому экспериментально определенный порядок реакции может быть дробной величиной. Реакция взаимодействия хлора с водородом формально является реакцией второго порядка. Хорошо известно, что эта реакция протекает при освещении по цепному механизму со взрывом. Заполним сосуд смесью водорода с хлором и опустим его открытым горлом в эксикатор с водой. Гипотетически предположим, что эта реакция будет протекать с измеримой скоростью. Образующийся хлороводород мгновенно растворяется в воде. За счет этого вода начнет заполнять колбу, уменьшая объем непрореагировавшей смеси водорода и хлора. Так как в реакцию вступают два объема реагентов и образуются два объема хлороводорода, на которые уменьшается объем реакционной смеси, концентрации реагирующих веществ меняться не будут. Иными словами, реакция будет протекать с постоянной скоростью и не будет зависеть от концентраций реагирующих веществ. Такое возможно лишь в том случае, когда общий порядок реакции равен нулю. Реакции, протекающие с постоянной скоростью, не зависящей от концентрации, являются реакциями нулевого порядка: V = kּС° = k III. Температура. С увеличением температуры увеличивается кинетическая энергия молекул, а следовательно, и скорость их движения. Увеличение скорости приводит к увеличению числа столкновений молекул и, как следствие этого, к увеличению скорости реакции. Экспериментально было установлено, что при увеличении температуры на каждые 10° скорость химической реакции возрастает в два-четыре раза:
где v1 — скорость реакции при температуре T1, v2 — скорость при температуре Т2. Коэффициент γ называется температурным коэффициентом скорости реакции, и его значение для большинства неорганических реакций варьирует от двух до четырех. Эта закономерность носит название правила Вант-Гоффа. При увеличении температуры скорость реакции увеличивается, и при этом концентрации реагирующих веществ не меняются. Следовательно, константа скорости будет изменяться с изменением температуры. Экспериментальное изучение зависимости скорости реакции от температуры позволило Аррениусу предложить уравнение, названное его именем: ln k = - Из этого уравнения следует, что константа скорости реакции экспоненциально растет с увеличением температуры. Аррениус предположил, что константа А равна отношению энергии активации к универсальной газовой постоянной, а константа В, ее чаще обозначают через ln k0, учитывает число эффективных (то есть приводящих к химической реакции) столкновений. С учетом этого уравнение Аррениуса можно привести к виду:
Если построить график зависимости экспериментально найденных величин ln kот обратной температуры, то получим прямую линию (рис. 7.2). Отрезок, который отсекает эта прямая на оси ординат при 1 / Т —> 0, равен ln k0, а тангенс угла φнаклона прямой tgφ = -
Из величины тангенса угла наклона прямой можно определить энергию активации.
Рис.7.2. Зависимость логарифма константы скорости химической реакции от обратной температуры.
Найти энергию активации можно, измерив скорость реакции при двух разных температурах. Отношение скоростей реакций равно отношению констант скоростей или разности их логарифмов, что позволяет исключить ln k0:
Безусловно, скорость химической реакции зависит от числа столкновений молекул реагирующих веществ. Но не всякое столкновение приводит к протеканию реакции. Образование продуктов реакции происходит лишь при столкновении «активных» молекул, т.е. молекул, обладающих энергией выше определенного энергетического барьера. При любой заданной температуре молекулы обладают различными энергиями. Существует распределение молекул по энергиям. Зависимость числа молекул от самой энергии приведена на рис.7.3. Математически эта зависимость выражается уравнением:
Рис. 7.3. Кривая распределения молекул по кинетическим энергиям.
На рис.7.3 приведены две кривые распределения молекул по энергиям при разных температурах, причем Т2>Т1. Из рисунка видно, что средняя кинетическая энергия увеличивается, а число молекул, обладающих средней кинетической энергией, уменьшается. Это происходит из-за того, что площадь под кривой, соответствующая общему числу молекул, не меняется, так как число молекул остается постоянным. Пусть Еа — энергия, соответствующая энергетическому барьеру начала реакции. Тогда площадь, заштрихованная под кривой, будет определять число молекул, способных вступить в реакцию, т.е. «активных» молекул. Энергия, соответствующая Еа, называется энергией активации. С увеличением температуры увеличивается площадь, соответствующая количеству молекул, обладающих энергией больше энергии активации реакции, что и определяет увеличение скорости реакции. Данное утверждение справедливо для предположения, что энергия активации не зависит от температуры. В общем случае это не так, но это допущение корректно для ограничения интервала температур. Промежуточная неустойчивая группировка, образующаяся при столкновении активных частиц и находящаяся в состоянии перераспределения связей называется активированным комплексом. Физический смысл энергии активации легко понять из рис. 7.4, если по оси ординат отложить изменение энтальпии, а по оси абсцисс - направление хода реакции.
Рис. 7.4. Энергетические диаграммы хода некатализируемой (1) и катализируемой (2) химических реакций.
В этом случае разность между суммой энергий исходных веществ и максимумом кривой 1 соответствует величине энергии активации прямой реакции, а разность между суммой энергий продуктов реакций и этим же максимумом — энергии активации обратной реакции. Ввиду того, что сумма энергий исходных веществ больше суммы энергий продуктов реакции, график, приведенный на рис.7.4, относится к экзотермической реакции. Из него следует, что для прямой экзотермической реакции энергия активации всегда меньше энергии активации обратной. Для эндотермической реакции характерно обратное их соотношение. Состояние активированного комплекса соответствует максимуму на кривой 1. IV. Катализатор. Катализ представляет собой распространенное явление, которое состоит в том, что введение в систему малых количеств посторонних веществ, получивших название катализаторы, существенным образом изменяет скорость химической реакции. Катализаторами называют вещества, которые изменяют скорость химической реакции, не расходуются в ее процессе и не входят в стехиометрическое уравнение реакции. Катализаторы могут как увеличивать скорость реакции, так и уменьшать ее. В соответствии с этим различают положительный и отрицательный катализ. Как правило, термин «катализатор» применяют к тем веществам, которые увеличивают скорость химической реакции. Вещества, которые уменьшают скорость реакции, называют ингибиторами. Катализаторы принимают самое непосредственное участие в процессе, но по окончании его могут быть выделены из реакционной смеси в исходном количестве. Для катализаторов характерна селективность, т.е. способность влиять на прохождение реакции в определённом направлении. Из одних и тех же исходных веществ могут быть получены различные продукты в зависимости от используемого катализатора. Например, оксид углерода (II) и водород в зависимости от применяемого катализатора, температуры реакции и соотношения реагентов могут давать различные продукты реакции: метанол, смесь различных спиртов (синтол), метан, смесь углеводородов:
Взаимодействие аммиака с кислородом без катализатора протекает следующим образом: 4 NH3 + ЗО2 = 2 N2 + 6 Н2О, а в присутствии катализатора (Рt) — в соответствии с уравнением: 4NH3 + 5 О2 = 4 NO + 6 Н2О. Особое место занимают биокатализаторы — ферменты, представляющие собой белки. Ферменты оказывают влияние на скорости строго определенных реакций, т. е. обладают очень высокой селективностью. Ферменты ускоряют реакции в миллиарды и триллионы раз при комнатной температуре. При повышенной температуре они теряют свою активность, так как происходит денатурация белков. Различают два типа катализа: гомогенный катализ, когда реагирующие вещества находятся в одной фазе, и гетерогенный — реакции происходят на поверхности катализатора, т.е. катализатор и исходные вещества находятся в разных фазах. Катализатор не влияет на состояние равновесия в системе, а лишь изменяет скорость, с которой достигается это состояние. Это следует из того, что равновесию отвечает минимум изобарно-изотермического потенциала (энергии Гиббса), и константа равновесия имеет одинаковое значение, как в присутствии катализатора, так и без него. Действие гомогенного катализатора заключается в том, что он реагирует с одним из исходных веществ с образованием промежуточного соединения, которое, в свою очередь, вступает в химические реакции с другим исходным веществом, давая желаемый продукт реакции и «освобождая» катализатор. Таким образом, при гомогенном катализе процесс протекает в несколько стадий, но с меньшими значениями энергии активации для каждой стадии, чем для прямого некаталитического процесса. Пусть вещество А реагирует с веществом В, образуя соединение АВ: А+В=АВ Реакция протекает с незначительной скоростью. При добавлении катализатора К протекают следующие реакции: А+К=АК АК+В=АВ+К Сложив эти два уравнения, получим: А+В=АВ Концентрация катализатора мала и не меняется до окончания процесса. Влияние катализатора на скорость реакции хорошо иллюстрирует кривая 2 на рис.7.4. Она имеет два максимума, первый из которых соответствует энергии активации реакции образования промежуточного соединения одного исходного соединения (А) с катализатором (К), а второй — энергии активации реакции промежуточного соединения (АК) с другим исходным веществом (В) с образованием нужного продукта реакции (АВ) и катализатора. Оба максимума ниже максимума некатализируемой реакции. Примером реакции, протекающей с участием гомогенного катализатора, может служить реакция окисления оксида серы (IV) до оксида серы (VI): SО2 + 0,5О2 = SО3 с катализатором NO2: SО2 + NO2 = SО3+NO NO + 0,5O2 =NO2 Эти реакции лежат в основе нитрозного метода получения серной кислоты. Для объяснения механизма действия гетерогенного катализатора рассмотрим свойства атомов или молекул на поверхности любого кристаллического вещества. На поверхности фазы свойства атомов отличаются от свойств атомов, находящихся внутри кристаллической решётки. Кристалл каждого вещества обладает присущей ему трехмерной периодичностью расположения молекул, атомов или ионов. Для простоты изложения рассмотрим двухмерную решетку, изображенную на рис. 7.5. Из рисунка видно, что силы, которые действуют на атом «А», находящийся внутри фазы, со стороны других атомов, полностью скомпенсированы. Другая картина наблюдается, если атом расположен на поверхности кристалла (атом «В»). В этом случае силы, действующие на атом, не скомпенсированы. В жидкостях это приводит к появлению поверхностного натяжения. В твердых телах поверхностные атомы стремятся компенсировать свою ненасыщенность взаимодействием с молекулами газов (или жидкостей), окружающих кристалл. Молекулы газа (или жидкости) адсорбируются на поверхности кристалла, что приводит к перераспределению электронной плотности в адсорбированных молекулах и ослаблению химической связи в них вплоть до полной диссоциации молекулы на атомы. Это значительно облегчает взаимодействие адсорбированных молекул (атомов) реагирующих веществ между собой. Естественно, что чем больше поверхность, тем эффективнее катализатор.
Рис. 7.5. Механизм действия гетерогенного катализатора.
В качестве катализаторов широко используются металлы, такие как никель, платина, палладий, медь и др. Эти металлы используют в реакциях гидрирования и дегидрирования, платину применяют также в реакциях каталитического окисления, например, при окислении аммиака до оксида азота (II). Очень хорошими катализаторами являются кристаллические алюмосиликаты — цеолиты, Аl2Оз, А12(SО4)з. Эти вещества образуют кристаллогидратные соединения с водой, поэтому их используют как катализаторы в реакциях гидратации и дегидратации. Часто в качестве факторов, влияющих на скорость гетерогенных химических реакций, указываются поверхность реагирующих веществ и давление. В гетерогенных реакциях взаимодействие веществ происходит на поверхности раздела фаз, и чем больше площадь этой поверхности, тем выше скорость реакции. Это положение хорошо иллюстрирует реакция взаимодействия твердых сульфата меди и иодида калия: 2 СuSО4 + 4 КI = 2 СuI↓ +I2 + 2 К2SО4 О протекании этой реакции можно судить по появлению коричневой окраски, обусловленной образованием иода. Если смешать эти вещества в ступке без растирания, появляется слабая коричневая окраска. По мере растирания смеси окраска становится более интенсивной. При добавлении к смеси нескольких капель воды смесь мгновенно буреет. Наблюдаемые явления легко объяснить: растирание увеличивает поверхность соприкосновения, следовательно, скорость реакции возрастает. При добавлении воды компоненты смеси частично растворяются, что приводит к практически мгновенному протеканию реакции. Отсюда видно, что в гетерогенных реакциях увеличение поверхности соприкосновения соответствует увеличению концентрации реагирующих веществ. На скорость реакций с участием газообразных веществ влияет изменение давления. Уменьшение или увеличение давления приводит к соответствующим изменениям объема, а поскольку количества веществ при этом не изменяются, будут изменяться концентрации реагирующих веществ. Таким образом, выделять поверхность реагирующих веществ и давление в отдельные факторы, влияющие на скорость химических реакции, вряд ли целесообразно, так как их изменение в соответствующих реакциях равносильно изменению концентраций в гомогенной реакции.
7.3 Экспериментальные методы определения констант скорости химической реакции Реакции первого порядка. Примером такой реакции являются реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.): H2S → H2 + S
Для реакций первого порядка кинетическое уравнение имеет следующий вид: V = Роль концентрации при радиоактивном распаде играет количество радиоактивных атомов N. Заменив в предыдущем уравнении концентрацию на количество атомов и перенеся члены уравнения, включающие N, влево, время — вправо (эта операция называется разделением переменных), получим:
Интегрируя полученное уравнение по времени от 0 до t и по числу атомов от N0 до Ntполучим:
Потенцируя это уравнение, получим: Nt = Nо ּe-kt Уравнение Аррениуса, записанное через разность логарифмов, представляет уравнение прямой в координатах 1n N — время. В общем случае для реакции первого порядка выполняется аналогичная зависимость ln С — t. Построив соответствующий график (Рис.7.6), определим значение константы скорости для реакции первого порядка, как тангенс угла наклона прямой.
Рис. 7.6. Определение константы скорости реакции первого порядка.
Реакции второго порядка. Реакция димеризации ацетилена 2 С2Н2 =С4Н4 является реакцией второго порядка. Кинетическое уравнение этой реакции имеет следующий вид: Проведя разделение переменных и проинтегрировав обе части уравнения в тех же пределах, что и в уравнении реакции первого порядка, получим
Если ввести следующие обозначения: у =1/Ct; х = t; А =k; В =1/C0, то уравнение представляет собой уравнение прямой у = А • х + В. Отложив по оси ординат 1/C, а по оси абсцисс время, и построив экспериментальную прямую (рис.7.7), аналогичную прямой, приведенной на рис. 7.6, найдем значение константы скорости для реакции второго порядка, как тангенс угла ее наклона. Наклон построенной прямой будет противоположен наклону прямой на рис. 7.6, так как при уменьшении концентрации со временем обратная ей величина возрастает. Рис. 7.7. Определение константы скорости реакции второго порядка.
Для рассмотрения реакции третьего порядка можно получить соответствующие соотношения, используя приведенный выше подход. Из рис. 7.8, на котором приведены зависимости изменения концентрации от времени протекания реакции для различных порядков, видно, что наиболее резко концентрация вещества меняется со временем в реакции первого порядка, более медленно в реакции 2-го порядка и т.д. Здесь принимается, что значения констант скорости для всех порядков численно равны.
Рис. 7.8. Изменение концентрации реагента в реакциях первого -третьего порядков в зависимости от времени протекания реакции.
Размерность константы скорости. В зависимости от порядка реакции меняется и размерность константы скорости. Для реакции I-го порядка, подставив размерность скорости и концентрации в соответствующее уравнение, получим:
отсюда
По аналогии, для константы скорости реакции второго порядка, имеем:
откуда получаем:
7. 4 Сложные реакции Реакции, протекающие в одну стадию, называют простыми (элементарными) реакциями, а реакции, включающие несколько стадий - сложными. Энергетическая диаграмма простой реакции приведена на рис. 7.9 (а), сложной (двухстадийной) - на рис. 7.9 (б).
Так, например, многие органические реакции являются сложными и идут в несколько элементарных стадий (последовательных или параллельных). Общая скорость сложной химической реакции определяется скоростью ее наиболее медленной (лимитирующей) стадии. Например, в приведенной на рис. 7.9(б) диаграмме лимитирующей является стадия 1 с более высокой энергией активации Еа '. К кинетически сложным реакциям относят также последовательные, параллельные, сопряженные, цепные, фотохимические и некоторые другие. Фотохимические реакции Реакции, протекающие под воздействием светового излучения, называются фотохимическими, а раздел, изучающий фотохимические превращения, – фотохимией. Основной закон фотохимии – закон квантовой эквивалентности (А. Эйнштейн, 1912 г): каждый поглощенный квант света hν вызывает изменение одной молекулы. Важнейшим параметром фотохимической реакции служит квантовый выход γ:
В зависимости от типа фотохимической реакции квантовый выход может меняться в широких пределах. Это связано с возможностью потери поглощенной энергии до фотопревращения. Если время существования фотовозбужденной молекулы и скорость фотодиссоциации совпадают, то γ ~ 1. При γ >> 1 фотореакция идет по цепному механизму. В частности для реакции H2 + Cl2 = 2HCl γ = 105. Типы фотохимических реакций: 1. Фотодиссоциация (фотолиз) приводит к разложению исходного вещества, поглотившего световую энергию. Примерами реакции фоторазложения служат такие: разложение галогенидов серебра (основа серебряной фотографии), фотолиз паров ацетона CH3CO CH3 → CO + другие продукты. 2. Фотосинтез приводит к образованию более сложных соединений. Примерами реакций фотосинтеза служат: · фотосинтез озона в верхних слоях атмосферы, создающий защитный озоновый слой: фотодиссоциация:
· фотосинтез органических соединений из углекислого газа, воды, минеральных веществ зелеными растениями. В частности, синтез глюкозы может быть описан уравнением:
Последовательные реакции Последовательными называют реакции с промежуточными стадиями, когда продукт предыдущей стадии служит исходным веществом для последующей:
Например, последовательный гидролиз карбоксильных групп диалкилоксалатов: AlkylO2C-CO2Alkyl + H2O → AlkylO2C-CO2H + H2O → HO2C-CO2H Параллельные реакции Реакции, в которых исходные вещества способны образовывать разные продукты реакции или одно вещество одновременно способно реагировать с несколькими веществами, называются параллельными.
Например, при нагревании хлората калия одновременно могут протекать реакция разложения (I) и диспропорционирования (II):
Сопряженные реакции Сопряженные реакции – это две реакции, одна (I) из которых может протекать совместно с другой (II), т.е. она индуцируется последней:
А + В → М (I) 2HI + H2O2 = 2H2O + I2
A + C → N (II) 2FeSO4 + H2O2 = 2Fe(ОН)SO4
Вещество С (FeSO4) служит индуктором первой реакции. Механизм химической индукции заключается в участии одних и тех же промежуточных. активных частиц в каждой из двух сопряженных реакций. Одна из реакций порождает такие частицы в количестве, достаточном для квазистационарного течения обеих реакций. Реакцию ведут радикалы
Реакция (II) может индуцировать протекание других реакций окисления. Например, взаимодействие бензола с перекисью водорода протекает с участием в качестве индуктора сульфата железа, аналогичным образом генерирующего гидроксид-радикалы:
Цепные реакции Реакции, в которых возможность протекания каждого элементарного акта взаимодействия между активными молекулами реагирующих веществ обусловлена успешным исходом предыдущего акта и, в свою очередь, обусловливает возможность последующего называются цепными. К ним относят реакции, протекающие с образованием свободных радикалов, способных превращать реагенты в конечные продукты, поддерживая постоянство свободных радикалов или даже увеличивая их (разветвленная цепная реакция). В цепных реакциях выделяют три стадии: зарождение (иницирование) цепи, ее развитие (продолжение, рост) и обрыв. Зарождение происходит под воздействием светового, радиационного, термического или другого воздействия. Примером неразветвленной цепной реакции, в которой взаимодействие инициированного радикала с молекулой вещества приводит к возникновению одного нового, может служить H2 + Br2 = 2HBr. Зарождение цепи осуществляется термо- и фотодиссоциацией: зарождение цепи:
рост цепи (развитие):
обрыв цепи: Акт последовательности (I) + (II), называемый звеном цепи, продолжается дальше и число звеньев может достигать сотен тысяч (длина цепи). Стадия цепного процесса, приводящая к исчезновению радикалов, называется обрывом цепи. Цепь может оборваться в результате соударения двух радикалов (III) или в результате взаимодействия радикала с поверхностью стенки сосуда. По цепному механизму протекает реакция хлорирования углеводородов: Cl2 +
В разветвленных цепных реакциях взаимодействие свободного радикала с молекулой исходного вещества приводит к образованию не одного а двух и большего числа новых. Один из них продолжает старую цепь, а другие дают начало новым; цепь разветвляется, и реакция прогрессивно ускоряется. Горение водорода относится к разветвленным цепным реакциям:
Химическое равновесие Кинетическое химическое равновесие – состояние химической системы, при котором возможны реакции, идущие с равными скоростями в противоположных направлениях. При химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются со временем. Необратимые и обратимые реакции. Если слить растворы кислоты и щелочи, образуется соль и вода, например, HCl + NaOH = NaCl + H2O, и если вещества были взяты в нужных пропорциях, раствор имеет нейтральную реакцию и в нем не остается даже следов соляной кислоты и гидроксида натрия. Если попытаться провести реакцию в растворе между образовавшимися веществами – хлоридом натрия и водой, то никаких изменений не обнаружится. В подобных случаях говорят, что реакция кислоты со щелочью необратима, т.е. обратная реакция не идет. Практически необратимы при комнатной температуре очень многие реакции, например, H2 + Cl2 = 2HCl, 2H2 + O2 = 2H2O и др. Необратимые реакции протекают до конца – до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Многие реакции обратимы уже в обычных условиях, это означает, что в заметной степени протекает обратная реакция. Например, если попытаться нейтрализовать щелочью водный раствор очень слабой хлорноватистой кислоты, то окажется, что реакция нейтрализации до конца не идет и раствор имеет сильнощелочную среду. Это означает, что реакция HClO + NaOH RCOOH + R'OH Как и многие другие понятия в химии, понятие обратимости во многом условно. Обычно необратимой считают реакцию, после завершения которой концентрации исходных веществ настолько малы, что их не удается обнаружить (конечно, это зависит от чувствительности методов анализа). При изменении внешних условий (прежде всего температуры и давления) необратимая реакция может стать обратимой и наоборот. Так, при атмосферном давлении и температурах ниже 1000° С реакцию 2Н2 + О2 = 2Н2О еще можно считать необратимой, тогда как при температуре 2500° С и выше вода диссоциирует на водород и кислород примерно на 4%, а при температуре 3000° С
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 817; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.018 с.) |







 , где NEa - количество молекул обладающих энергией выше энергии активации (на рисунке это заштрихованная площадь), N0 - общее количество молекул.
, где NEa - количество молекул обладающих энергией выше энергии активации (на рисунке это заштрихованная площадь), N0 - общее количество молекул.




























 , образующиеся при окислении пероксидом Fe2+ до Fe3+. В этом примере сопряженная реакция - окисление HI и окисление Fe2+, обе реакции идут с участием
, образующиеся при окислении пероксидом Fe2+ до Fe3+. В этом примере сопряженная реакция - окисление HI и окисление Fe2+, обе реакции идут с участием 






 → 2Cl
→ 2Cl


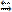 NaClO + H2O обратима, т.е. продукты этой реакции, реагируя друг с другом, частично переходят в исходные соединения. В результате раствор имеет щелочную реакцию. Обратима реакция образования сложных эфиров (обратная реакция называется омылением):
NaClO + H2O обратима, т.е. продукты этой реакции, реагируя друг с другом, частично переходят в исходные соединения. В результате раствор имеет щелочную реакцию. Обратима реакция образования сложных эфиров (обратная реакция называется омылением): RCOOR' + H2O, многие другие процессы.
RCOOR' + H2O, многие другие процессы.


