
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Понятие о химическом процессеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Химико-технологическим процессом, как было показано выше, называют сочетание связанных друг с другом и проводимых в определенной последовательности химических, физико-химических, физических и механических операций с целью получения конечного продукта. Собственно химический процесс это вторая и главная подсистема ХТС. Эффективность его требует соблюдения некоторых условий, содержание которых определяется технологическим режимом. Технологический режим – это совокупность параметров, обеспечивающих устойчивое и максимально эффективное проведение химического процесса. Параметром технологического процесса называют величину, характеризующую один из показателей режима работы аппарата. Как правило, параметр – это количественная величина, позволяющая дать количественную оценку работы аппарата. Основными параметрами химического процесса являются температура, давление, соотношение реагентов, их расход в единицу времени, время контакта, объемная скорость подачи сырья, активность катализатора, коэффициент рециркуляции, сила тока, напряжение и т.д. Сочетание оптимальных параметров позволяет вести процесс с максимально возможными выходом и качеством целевого продукта с высокой скоростью и минимальной себестоимостью. Как было сказано выше, химический процесс составляет главную подсистему – химического превращения сырья. Он протекает в одну или несколько химических реакций, сопровождаемых явлениями массо- и теплообмена. Если процесс химического превращения протекает в одну стадию в соответствии со стехиометрическим уравнением, то его называют простым. Остальные реакции являются сложными. К ним можно отнести обратимые, цепные, параллельные, последовательные, сопряженные и другие реакции. Химические реакции классифицируются по ряду признаков: - по фазовому состоянию реакционной системы (гомофазное или гетерофазное); - по механизму взаимодействия; - по обратимости (обратимые и необратимые); - по знаку теплового эффекта [ экзотермические (+ - по применению катализатора (каталитические и некаталитические); - по температуре (низкотемпературные и высокотемпературные); - по порядку реакции. Ниже представлена табл. 5.1 технологической классификации химических реакций. Интенсификация гомогенных процессов. Если реакция протекает в объеме фазы, то она называется гомогенной. К гомогенным реакциям относят, например, реакции в растворах. В гомогенных системах реакция протекает во всем объеме реактора. Скорость реакции в таких процессах возможно интенсифицировать изменением состава реакционной среды, температуры и давления. Влияние состава реакционной среды зависит от величины концентрации реагентов и их физико-химических свойств. Известно, что, согласно закону действующих масс, для гомогенной реакции типа (- VA) = kCaACb B, (5.1)
где (V A) – скорость химической реакции; СА, СВ – молярные концентрации реагентов А и В; a, b - порядок реакции по реагентам А и В; k - константа скорости реакции.
Таблица 5.1
А, В – исходные реагенты; V – скорость реакции; k - константа скорости; С – концентрация. Таким образом, скорость реакции пропорциональна произведению концентраций реагентов, взятых в степенях, равным порядку реакции, на основе чего следуют выводы: 1) чем выше значение концентраций, тем больше скорость реакции; 2) скорость реакции в большей степени зависит от реагента, входящего в уравнение скорости с большей степенью; 3) если одновременно протекают реакции с разными порядками, то изменение концентрации сильнее скажется на скорости реакции с более высоким порядком. Данные закономерности лежат в основе технологического приема – избытка одного из реагентов. При этом выгоднее в избытке брать реагент, входящий в уравнение реакции с более высоким стехиометрическим коэффициентом. Но существует ряд причин, по которым во многих газофазных и жидкофазных процессах реагенты разбавляют растворителем, т.е. понижая их концентрацию. Этому есть несколько причин: а) возможность перегрева реакционной массы при проведении сильно экзотермической реакции с большой скоростью; б) использование низких концентраций – требование селективного протекания сложных реакций, если побочная реакция более высокого порядка; в) улучшения условий протекания сопровождающих реакцию физических процессов, т.к. разбавление позволяет понизить вязкость, облегчить равномерное перемешивание реакционной массы и ее транспорт, обеспечить более интенсивный и равномерный теплообмен. Влияние температуры на скорость реакции описывается уравнением Аррениуса: k = A где k – константа скорости; А – предэкспоненциальный множитель; Е - энергия активации, кДж/моль; R - газовая постоянная, кДж/моль; Т – температура,о К. Из этого уравнения следует, что, поскольку температура входит в показатель степени, то она оказывает очень большое влияние на скорость реакции. По этой же причине существенно влияние на скорость значения энергии активации, но с другим знаком. Применяемый в химической технологии диапазон давлений очень широк. В нефтепереработке в большой части процессов давление составляет в пределах 1-5 МПа, но есть процессы с давлением до 32МПа (гидрокрекинг) и в вакууме (ректификация мазута). В нефтехимии известны процессы при давлении до 100Мпа (полимеризация этилена). Имеется несколько причин, по которым повышенное давление, несмотря на высокие энергозатраты, широко применяется в химической технологии: 1. Давление существенно повышает скорость газофазных процессов, т.к. в этом случае резко повышается концентрация реагентов. 2. Давление влияет на положение химического равновесия для обратимых реакций, при этом повышение давления смещает равновесие в сторону прямой реакции, если процесс протекает с уменьшением объема. 3. Давление повышает температуры кипения и плавления. Этот эффект используется для проведения процессов жидкой фазе для веществ, которые при стандартном давлении находятся в газообразном состоянии. 4. Повышение давления во многих случаях позволяет снизить температуру синтеза, что важно в системах с низкой термостабильностью реагентов или продуктов процесса. Интенсификация гетерогенных процессов. Гетерогенные системы состоят из непрерывной (сплошной) среды и дискретной фазы, включающей один или более компонентов. Примеры таких систем приведены в табл. 5.2. В гетерогенной системе областью химического взаимодействия являются поверхности раздела фаз. Скорость гетерогенной реакции является сложной функцией параметров нескольких процессов, протекающих параллельно: массопередачи извне в реакционную среду, собственно химической реакции и выведения продуктов процесса из реакционного пространства. Элементарные стадии гетерогенной реакции протекают с разной скоростью. При этом в условиях стационарного процесса скорости всех стадий будут одинаковы и равны скорости самой медленной стадии. Эту стадию называют лимитирующей. Поэтому, в гетерогенных процессах их интенсификация связана с ускорением лимитирующей стадии. Для решения этой проблемы в теорию гетерогенных процессов введено понятие области протекания реакции. По этой теории гетерогенная реакция может протекать в кинетической, диффузионной или переходной (диффузионно-кинетической) области. Название этих областей связано непосредственно с лимитирующей стадией. Таблица 5.2 Типы дисперсных систем
Г – газ; Ж – жидкость; Т – твердое тело
Если лимитирующей стадией является химическое превращение, то говорят о кинетической области протекания процесса. К числу кинетических факторов относят температуру, давление, концентрацию реагентов и катализатора, природу и активность последнего и др. Если лимитирующей стадией является скорость массопередачи, то реакция протекает в диффузионной области. Известно, что для процессов, протекающих в этой области, скорость пропорциональна площади границы раздела фаз и движущей силе процесса (изменению концентрации), под действием которой происходит массопередача: V = k S где k – коэффициент пропорциональности; S – площадь поверхности раздела фаз;
Из данного уравнения следует, что скорость процесса можно поднять, увеличив площадь соприкосновения фаз. Эта цель достигается измельчением твердого катализатора и развития его внутренней структуры (пористости). В системах с участием жидких продуктов для увеличения поверхности контакта применяют такие приемы, как использование насадочных устройств, барботаж, пенный слой и т.д. Значение константы скорости определяется следующим соотно-шением: k = D/ где D – коэффициент диффузии;
С повышением температуры коэффициент диффузии возрастает, но в значительно меньшей степени, чем скорость химической реакции. Тем не менее, температурный фактор часто используется для повышения скорости диффузионных процессов. Более эффективным является прием интенсификации перемешивания контактирующих фаз, чем достигается уменьшение толщины диффузионного слоя, что приводит к резкому увеличению константы скорости процесса массопередачи. Для увеличения движущей силы процессов массопередачи (
где С и С* - действительная и равновесная концентрации компонента в передающей фазе, используют следующие приемы: 1) повышение концентрации компонентов сырья; 2) удаление продуктов процесса из реакционной зоны; 3) смещение равновесия в направлении, повышающем градиент концентрации Таким образом, к диффузионным факторам, определяющим интенсивность процессов массопередачи, можно отнести линейные скорости движения фаз, число оборотов перемешивающих устройств, характеристики границы раздела фаз и др. Поскольку диффузионные факторы во многом определены гидродинамикой потоков, то их часто называют гидродинамическими. Если скорости массопередачи и реакции соизмеримы, то говорят, что процесс протекает в переходной области. Проведение реакции в кинетической области (отсутствует диффузионное торможение) наиболее предпочтительно с точки зрения кинетики, однако ряд промышленных процессов реально осуществляют в диффузионной области. Это касается прежде всего высокотемпературных процессов, когда трудно избежать диффузионных торможений по причине высоких скоростей химических реакций. Подводя итоги, можно сделать следующие выводы: - скорость гетерогенной реакции определяется скоростью лимитирующей стадии; - в качестве лимитирующих могут быть как процессы химического превращения, так и процессы массопередачи; - для интенсификации гетерогенной реакции следует использовать как кинетические, так и диффузионные факторы; - для интенсификации процессов, протекающих в кинетической области, следует применять кинетические факторы, а в диффузионной – диффузионные. Интенсификация процессов, основанных на необратимых реакциях. К необратимым относят реакции, протекающие только в прямом направлении. При разработке технологии проведения такого процесса преследуют две основные цели: повышение скорости реакции и выхода целевого продукта. Выход продукта в таких процессах пропорционален степени пре При разработке технологии проведения сложной необратимой реакции все внимание уделяют повышению селективности процесса. Эта цель достигается подбором оптимальных концентраций реагентов и температур, а также подбором наиболее селективных катализаторов. Селективность S реакции можно оценить соотношением скоростей основной и побочной реакций:
S = V1 / V2 =k1CAa / k2 CAb = k CAa – b, (5.5)
где k = k1 / k2. На основе данного уравнения можно сделать выводы о влиянии концентрации на селективность: 1) при a > b (порядок целевой реакции выше побочной) селективность пропорциональна максимальному значению концентрации; 2) при a < b селективность пропорциональна минимальным значениям концентрации; 3) при a = b концентрация не влияет на селективность: S = kCA0 = k. Катализ – наиболее сильное воздействие на селективность реакции. Катализ – это сложная система реакций, в результате которых снижаются многие затруднения в протекании реакции по сравнению с некатализируемым процессом. Этот эффект связан с понижением энергии активации и / или увеличением предэкспоненциального множителя в кинетическом уравнении реакции. Интенсификация процессов, основанных на обратимых реакциях. К обратимым относят реакции, протекающие одновременно в прямом и обратном направлениях. В обратимой реакции aA + bB = dD в соответствии с законом действующих масс, скорости прямой и обратной реакций будут следующие: Vпр = k/ CAa CBb ; (5.6) Vоб = k// CDd, (5.7) где С – концентрация; k/, k// - константы скорости прямой и обратной реакций; a, b, d –стехиометрические коэффициенты (порядки реакции) при участниках процесса A, B, D. Суммарная скорость обратимой реакции равна разности скоростей прямой и обратной реакции: V = Vпр - Vобр В момент равновесия Vпр = Vобр
CDd / CAa CBb = k/ / k// = Kр, (5.8)
где КР – константа равновесия. Степень превращения, при которой устанавливается равновесие, называют равновесной. В производственных условиях систему, как правило, не доводят до состояния равновесия, т.к. в состоянии равновесия производительность реактора равна нулю. Реактор работает в режиме, удаленном от состояния равновесия, в зависимости от стоимости затрат на смещение равновесия в направлении образования продуктов реакции. Существуют реакции с легко смещаемым равновесием и с неблагоприятным положением равновесия, для которых приемлемая конверсия может составлять 30 % и даже меньше. Смещение равновесия при изменении давления, температуры, концентрации подчиняется принципу Ле-Шателье, которое гласит: внешнее воздействие на систему с установившимся равновесием смещает его в сторону уменьшения этого воздействия. В качестве примера действия принципа Ле-Шателье рассмотрим реакцию синтеза аммиака: 3Н2 + N2 Такой же эффект можно получить при увеличении давления в системе. Действительно, повышая давление, мы увеличиваем концентрацию всех участников процесса, но увеличение концентрации реагентов будет более значительным, т.к. число молей исходных веществ больше, чем продуктов реакции. Движущей силой этого процесса является разность объемов конечных и исходных продуктов. Поэтому, в случае равенства объемов конечных и исходных продуктов сместить равновесие путем изменения давления в системе невозможно. Влияние изменения температуры на смещение равновесия в данной реакции таково. Поскольку реакция экзотермическая, то сместить равновесие в направлении образования аммиака возможно путем понижения температуры процесса. Движущей силой в этом случае является абсолютная величина такого изменения температуры. Принцип Ле-Шателье позволяет качественно оценить влияние основных параметров процесса на направление протекания обратимой химической реакции. Количественную оценку на смещение равновесия при изменении температуры или саму возможность протекания данной реакции при постоянном давлении (а именно при постоянном давлении в промышленных химико-технологических процессах, как правило, ведут химические реакции) можно, если известны знак и величина изменения в этом процессе свободной энергии Гиббса:
где Gнач. и Gкон . – значения свободной энергии Гиббса реагентов и продуктов процесса. Отрицательное значение этой разности означает принципиальную возможность протекания реакции в прямом направлении. Чем больше абсолютная величина этой разности, тем больше движущая сила процесса. Как известно:
где
Ннач., Нкон., Sнач., Sкон . – состояния системы, отвечающие начальным и конечным значениям энтальпии и энтропии соответственно. В соответствии с этим уравнением значение и знак Согласно 1-му закону термодинамики:
где
В рассматриваемых условиях Изменение энтропии в первом приближении можно оценить, учитывая, что ее можно рассматривать как меру беспорядка системы. Процессы, протекающие с его возрастанием (расширение газа, растворение, испарение, плавление, реакции разложения), которые протекают с увеличением объема, характеризуются возрастанием энтропии. Процессам, протекающим с уменьшением беспорядка (конденсация, кристаллизация, реакции присоединения, комплексообразования), соответствует уменьшение энтропии. При выборе оптимальных параметров ведения технологического процесса в случае обратимых реакций, кроме термодинамических закономерностей следует учитывать и особенности процессов, связанных с их кинетикой. Характер влияния температуры на скорость и положение равновесия для обратимых экзо- и эндотермических реакций различен. Для обратимой экзотермической реакции при малых степенях превращения, когда концентрация исходных продуктов в реакционной массе достаточно велика и мала концентрация продуктов реакции, обратимая реакция протекает, как необратимая. Поэтому с повышением температуры ее скорость возрастает. По мере увеличения концентрации конечных продуктов и снижения концентрации исходных, разность скоростей между прямой и обратной реакциями сокращается и наступает момент, когда они сравниваются и наступает равновесие, при этом технологический процесс прекращается. Чтобы этого не происходило, в непрерывных химико-технологических процессах при стационарном режиме имеет место непрерывная подача свежего сырья и непрерывный вывод продуктов процесса. В обратимой эндотермической реакции при увеличении температуры скорость прямой реакции возрастает быстрее, чем обратной. В результате этого разность скоростей между прямой и обратной реакциями также возрастает. На основе вышеизложенного можно обосновать выбор температурного режима химико-технологического процесса для обратимых реакций следующим образом: 1) поскольку в случае обратимой эндотермической реакции повышение температуры положительно влияет на оба критерия оптимизации (на скорость и на смещение равновесия), такую реакцию лучше проводить при постоянной повышенной температуре. 2) неоднозначное влияние температуры на критерии оптимизации обратимой экзотермической реакции требует использования режима понижающейся температуры: начинают процесс при более высокой температуре, а затем ее снижают по линии оптимальных температур. Такой прием применим для периодических процессов. В непрерывных процессах поддерживают постоянную температуру, т. к. нет явления накопления конечных продуктов и невозобновляемого расхода исходного сырья.
Контрольные вопросы 1. Объясните понятие «химико-технологический процесс». 2. Дайте определение понятия «технологический режим». Какие параметры его определяют? 3. Представьте классификацию реакций, определяющих основу ХТП. 4. Напишите уравнение закона действующих масс. Объясните с позиции этого закона влияние концентрации на приемы интенсификации гомогенных процессов. 5. Напишите уравнение Аррениуса. Объясните на основе этого уравнения влияние температуры и энергии активации на скорость химических процессов. 6. Объясните влияние давления на скорость гомогенных процессов. Какие давления по абсолютной величине применяют в химической технологии? Приведите примеры. 7. Приведите классификацию гетерогенных систем. Приведите примеры. 8. Назовите элементарные стадии гетерогенных процессов. 9. Дайте определение лимитирующей стадии процесса. В каких областях может протекать гетерогенная реакция? 10. От каких факторов зависит скорость гетерогенной реакции, протекающей в диффузионной области? Дайте соответствующее уравнение этой зависимости. 11. Что такое движущая сила процесса массопередачи? Как она влияет на скорость гетерогенных процессов? Как можно повысить градиент концентраций? 12. Дайте определение понятия «химическое равновесие». Как его можно нарушить? Принцип Ле-Шателье. 13. Напишите уравнение Гиббса. На его основе объясните принципиальную возможность протекания химической реакции и величину движущей силы процесса.
ТЕМА 6 ПРОМЫШЛЕННЫЙ КАТАЛИЗ Современную нефтепереработку и нефтехимию в настоящее время без применения катализаторов представить невозможно. Около 90 % промышленных химико-технологических процессов ведут с применением катализаторов в качестве активаторов. В качестве примеров можно привести технологии производства аммиака, азотной и серной кислот, метанола, стирола, бутадиена, в нефтепереработке – это каталитический крекинг и риформинг, гидроочистка и гидрокрекинг, алкилирование изобутана и изомеризация парафиновых углеводородов, производство оксигенатов и т.д. Каталитические процессы имеют ряд важных преимуществ, по сравнению с некаталитичес-кими. Кроме того, что применение катализаторов резко ускоряет скорости химических реакций, процессы с их применением могут быть организованы как непрерывные, безотходные, менее энергоемкие. Они отличаются высокими технико-экономическими показателями, обеспечивают более высокий выход целевых продуктов. Применение катализаторов позволяет интенсифицировать химико-технологические процессы, а в ряде случаев осуществлять процессы, которые на практике без применения катализаторов не могут быть реализованы. Особое значение имеет применение катализаторов при обратимых экзотермических процессах, в которых использование катализаторов позволяет существенно снижать температуру процесса и добиться приемлемой степени превращения сырья. Катализ является наиболее эффективным методом повышения скорости и селективности химических реакций. Понятие катализа включает сложную систему реакций, в результате которых снижаются энергетические, стерические и прочие затруднения на реакционном пути по сравнению с процессом без катализатора. В зависимости от фазового состояния реагентов и катализатора различают гомогенный и гетерогенный катализ. Если реагенты и катализатор находятся в одной жидкой или газовой фазе, то это гомогенный катализ, если – в разных (газ – твердое тело или жидкость – твердое тело), то это гетерогенный катализ. Существует и гомогенно-гетерогенный катализ, когда начавшаяся на гетерогенном катализаторе реакция продолжается затем в объеме другой фазы.
Гетерогенный катализ
Этот вид катализа наиболее распространен в химической технологии. Он имеет ряд достоинств, например, простота разделения с продуктами процесса, высокая термостойкость, сравнительная легкость регенерации. Каталитические гетерогенные реакции сопровождаются рядом явлений, связанных со свойствами твердых тел, неоднородных по химическому и фазовому составу. Важнейшую роль играют нарушения структуры (дефекты) кристаллической решетки катализаторов. Эти нарушения обуславливают энергетическую неоднородность поверхностных атомов и обеспечение определенной сорбционной способности поверхности катализатора. В целом эффективность применения катализаторов определяется комплексом его химических и физических свойств. Химические свойства катализаторов. К основным свойствам катализаторов относятся активность (А), селективность (S) и производительность (П). Активность (кг / м2 ч) – общая скорость реакции на катализаторе и может быть рассчитана по формуле А = Gп / F где Gп - количество превращенного реагента за время Весь цикл работы катализатора можно разделить на три периода: 1) разработка катализатора; 2) период постоянной активности – срок жизни катализатора; 3) дезактивация катализатора. Под термином «разработка» понимают самопроизвольный рост активности катализатора под воздействием реакционной среды. Период постоянной активности для разных катализаторов может меняться в широких пределах: от нескольких минут до нескольких лет, требования к сроку жизни катализатора определяются стоимостью замены дезактивированного катализатора свежим и возможностью его регенерации. При высокой стоимости замены сокращение числа этих операций дает весьма ощутимый экономический эффект. Явление падения активности катализатора называют старением, утомлением или отравлением. Старение – это естественный процесс, при котором активность уменьшается по всему слою катализатора. Утомление – это неравномерное падение активности в слое катализатора – опасный процесс, т.к. проявляется задолго до истечения срока жизни катализатора в результате неправильной его эксплуатации. В числе основных причин дезактивации катализатора можно назвать следующие: зауглероживание, синтеринг, отравление контактными ядами и минерализацию. Зауглероживание происходит в процессах переработки углеводородного сырья. Катализатор покрывается углеродистыми отложениями (коксом) в форме высоко-конденсированных ароматических структур, которые образуются в результате глубоких химических превращений. Среди подобных процессов можно назвать каталитический крекинг и риформинг, гидрокрекинг, дегидрирование и изомеризацию. Отложения кокса блокируют поверхность катализатора, вследствие чего его активность резко снижается за короткое время, которое иногда составляет 10-30 мин. Синтеринг (спекание) обычно является результатом окислительной регенерации, во время которой температура катализатора достигает 600 о С и выше, либо следствием высокотемпературного процесса с плохо организованным теплоотводом. Спекание сокращает величину активной поверхности в результате укрупнения кристаллитов металлического или оксидного катализатора и повышает гидравлическое сопротивление аппарата. Поэтому одной из задач в решении этой проблемы является стабилизация структуры компонентов катализатора. Стабилизация осуществляется путем структурного промотирования. Таким промотором, например, при синтезе аммиака служит оксид алюминия Al2O3, который, внедряясь между кристаллами железа, предотвращает их агломерацию. Аналогичное действие оказывает на никелевый катализатор в процессе гидрирования углеводородов оксид хрома Cr2O3 . Не менее важной является также стабилизация носителя, ибо он обеспечивает металлическому катализатору высокоразвитую поверхность. Отравление – это частичная, либо полная потеря активности катализатора под действием веществ, называемые контактными ядами. При отравлении наблюдается специфическое действие яда по отношению и к катализатору, и к самой реакции. Механизм отравления бывает различным. По действию на металлические катализаторы контактные яды можно разделить на три типа: 1) молекулы, содержащие неметаллы N, P, As, O, S, Se, в т.ч. и свободные элементы из этой группы, кроме азота, связывающие металл катализатора за счет неподеленных электронных пар (сероводород, тиофен, арсин, фосфин и др.); 2) отсоединения металлов (ионы ртути, свинца, висмута, олова, кадмия, железа и т.д.) с образованием интерметаллических соединений с участием d –электронов; 3) молекулы, содержащие кратные связи (СО, НСN и др.), с более высокими адсорбционными характеристиками, чем другие вещества реакционной массы. Защиту катализаторов от контактных ядов ведут несколькими способами: 1) переводом яда в неактивное состояние; 2) очисткой сырья от контактных ядов на стадии его подготовки; 3) применением катализаторов, устойчивых к контактным ядам. В качестве примера применения первого способа защиты можно привести прием удаления СО, содержащегося в поступающем на синтез аммиака водороде, с помощью самого водорода (СО – контактный яд для железного катализатора): ZnO
Получаемый метан – инертная примесь к водороду и поэтому не представляет вреда для катализатора. Примером второго способа защиты катализатора является предварительная гидроочистка бензиновых фракций от серо-, азот- и кислородсодержащих соединений перед направлением их на риформинг на платиновом катализаторе: RSH + H2 = RH + H2S; RNH2 + H2 = RH + NH3; ROH + H2 = RH + H2O. Приведенные выше реакции протекают на алюмо-кобальт-молибденовом катализаторе (АКМ). Наиболее интересным и перспективным направлением является разработка каталитических композиций, стойких к ядам. Указанные выше способы защиты катализаторов от ядов не являются независимыми друг от друга и поэтому могут применяться в одном процессе одновременно. Еще одной причиной падения активности катализатора является отложение на его поверхности минеральных примесей, содержащихся в сырье. Эти примеси хемосорбируются, изменяя химический состав поверхности катализатора. Селективность (избирательность) – важнейший показатель качества катализатора, который заключается в преимущественном ускорении целевой реакции в сравнении с побочными. Она измеряется величиной относительной скорости образования целевого продукта: S = - VA / R = - VA / A. (6.2) где VА – скорость образования целевого продукта, рассчитанная по реагенту А; A=R – общая скорость реакции (активность). Величина селективности может изменяться довольно в широких пределах, в зависимости от самого катализатора и от технологического процесса. Принято считать приемлемой селе
|
||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 1877; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.224.116 (0.013 с.) |

 Н) и эндотермические (-
Н) и эндотермические (-  Н)];
Н)];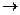 cC + dD записывается так:
cC + dD записывается так: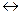 SO3
3H2 + N2
SO3
3H2 + N2  е- E /RT (5.2)
е- E /RT (5.2) (5.4)
(5.4)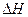 ,
, 
 , (6.1)
, (6.1)
 СО + 3Н2 CH4 + H2O.
СО + 3Н2 CH4 + H2O.


