
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пути совершенствования сернокислотного производстваСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1. Расширение сырьевой базы за счет использования отходов ТЭЦ, нефтепереработки, нефтехимии, металлургии и других производств. 2. Повышение единичной мощности установок. Например, повышение мощности установки в 2-3 раза снижает себестоимость продукции на 25–30 %. 3. Интенсификация процесса обжига FeS 2 путем использования O 2 или обогащенного им воздуха. Это уменьшает газoбаланс и повышает производительность установки. 4. Повышение давления процесса, что повышает интенсивность работы основной аппа-ратуры. 5. Применение новых высокоактивных катализаторов с низкой температурой зажигания. 6. Повышение доли диоксида серы в печном газе, подаваемом на контактирование. 7. Максимальная утилизация теплоты реакции. 8. Внедрение комбинированных технологических схем, включающих производство серной кислоты и выработку электроэнергии за счет тепла реакции. Особенно перспективным в этом направлении представляется процесс получения серной кислоты из серы, как наиболее теплоемкий (табл. 9.4). Таблица 9.4 Динамика использования различных источников сырья
Контрольные вопросы 1. Приведите перечень основных областей использования серной кислоты. 2. Чем объясняется абсолютное первенство серной кислоты в объеме мирового производства, по сравнению с другими минеральными кислотами. 3. Приведите диаграмму кристаллизации системы «SO3 – H2O» 4. Представьте диаграмму кипения системы «SО3 – Н2О» при атмосферном давлении. 5. Назовите источники сырья для производства серной кислоты. 6. Чем объясняется, что в мировой практике в качестве сырья для производства серной кислоты наблюдается тенденция увеличения доли серы? 7. Каков химизм процесса производства серной кислоты из железного колчедана? 8. Приведите структурную схему обжига железного колчедана. 9. Почему необходима специальная очистка обжигового газа перед контактированием 10. Какие катализаторы применяют в производстве серной кислоты? Назовите состав контактных масс БАВ и СВД. 11. Как влияют на скорость процесса окисления SO 2 в SO 3 температура, давление и состав контактирующего газа? 12. В чем преимущество способа производства серной кислоты по методу ДК-ДА? 13. Из каких условий выбирается абсорбент на стадии абсорбции оксида серы (VI)? 14. Каковы достоинства производства серной кислоты из серы? Приведите технологическую схему. 15. В чем преимущество производства серной кислоты из сероводорода? Представьте технологическую схему. Почему в ней отсутствует стадия абсорбции? 16. Назовите пути совершенствования сернокислотного производства.
ТЕМА 10 ПРОИЗВОДСТВО АММИАКА Вопрос производства аммиака тесно связан с более широким вопросом – проблемой «связанного» азота. Известно, что соединения азота имеют огромное значение для различных отраслей промышленности и сельского хозяйства. Промышленность использует их для производства азотной кислоты, полимеров, взрывчатых веществ, ракетных топлив, красителей, лекарственных препаратов. Сельскому хозяйству необходимы азотные удобрения. Хотя азот принадлежит к достаточно широко распространенным элементам, основное его количество находится в свободном состоянии в атмосфере Земли, где его доля составляет 78 %. Кларк азота в земной коре равен всего 0,04 %. Азот является незаменимым элементом для существования жизни на Земле. В составе живой клетки его доля равна 12–19 %. Промышленные месторождения связанного азота известны в ограниченном количестве. Единственное в мире крупное месторождение натриевой и калиевой селитр (NaNO 3 и KNO 3 соответственно) находится в Чили. Поэтому неудивительно, что взоры ученых давно были обращены на возможность фиксации атмосферного азота, энергия диссоциации которого составляет 940,5 кДж/моль. В настоящее время известны три основных способа связывания азота из воздуха. Цианамидный, протекающий при температуре 1000 оС: СаС2 + N2 = CaCN2 + C + 301,5 кДж/моль и далее СаСN2 +3H2O = CaCO3 + 2NH3.
Однако этот метод очень энергоемкий (104 кВт
Плазменный основан на прямом взаимодействии азота и кислорода при низкотемпературной плазме (более 2200о К) N2 + O2 = 2NO – 179,2 кДж/моль
В природе такой процесс наблюдается при грозовых разрядах. Первый завод по этой технологии был пущен в 1904 г. В этом процессе атмосферный воздух пропускался через пламя электрической дуги. Из-за высокого расхода энергии и низкого выхода оксида азота (менее 5 %) этот способ надолго был забыт. Однако в последние десятилетия интерес к этому способу вновь возродился в виде плазмохимического процесса, осуществляемого в низкотемпературной воздушной плазме, с помощью новейших устройств – плазмотронов. Процесс протекает при 5000–10 000о С, давлении – 2 МПа и времени контакта – 10-4 с, что обеспечивает довольно высокую производительность установки. А комбинирование плазменной установки с магнитогидродинамическим генератором (МГД) позволит использовать вторичные энергоресурсы и обеспечивать возврат энергии. Аммиачный метод ранее считался наименее перспективным, но в настоящее время получил почти исключительное распространение. Процесс описывается следующей химической
В основу технологии получения аммиака синтезом азота с водородом легли многолетние исследования таких выдающихся ученых, как Оствальд, Нернст, Габер, Бош, Ле-Шателье и др. Последние трое получили Нобелевскую премию по химии за промышленное освоение и разработку процесса синтеза аммиака из азота и водорода. Аммиачный метод в 2,5 раза менее энергоемкий, чем цианамидный и в 15 раз – чем дуговой. Аммиак является важнейшим соединением азота и промышленное его производство является самым многотоннажным из всех азотсодержащих веществ. О разнообразии областей его использования можно судить по данным рис. 10.1.
Карбамид Жидкие минераль- Нитрат аммония Сульфат аммония ные удобрения
Аммофос Карбонат аммония АММИАК Гербициды Мочевиноальдегид- ные ВМС
Азотная Полиуретаны Полиамиды Полиакрилонитрил кислота
Рис. 10.1. Области применения аммиака
Получение азота и водорода для синтеза аммиака. Источником азота, а также кислорода является атмосферный воздух. Разделение его можно вести переводом в жидкое состояние с последующей ректификацией. Для этого необходимо глубокое охлаждение воздуха до температуры ниже критической, которая для азота составляет – 147 о С при давлении 0,34 МПа. Такие условия могут быть созданы лишь при многократном цикле «сжатие – расширение – совершение работы» с помощью турбокомпрессоров и значительных затратах энергии. Практическое получение водорода обычно осуществляют конверсией метана, входящего в состав природного газа в количестве 90–98 %. Сущность конверсии состоит в окислении метана и его гомологов по одной из следующих реакций:
Для производства азотоводородной смеси применяют реакции (а) и (б). Получаемый в этих реакциях синтез-газ, представляющий собой смесь монооксида углерода и водорода, применяют также для синтеза метанола, высших спиртов, синтетической олифы, моющих средств, восстановления ряда металлов из руд. Для получения азотоводородной смеси или водорода из синтез-газа его подвергают вторичной обработке водяным паром с целью конверсии СО:
Если суммировать реакции (а) и (г), то получим:
и реакция требует подвода энергии. Для смещения равновесия вправо применяют избыток водяного пара и повышенную температуру. При соотношении СН 4: Н2О = 1:2 и температуре 800 о С уже достигаются условия синтеза аммиака, когда в исходном сырье содержится не более 0,5 % СН 4. Но скорость реакции мала даже при 1000 о С. Поэтому процесс ведут на никельсодержащем катализаторе, с применением которого скорость конверсии метана резко возрастает. Равновесие на нем достигается уже при 800–850 о С. Процесс ведут при 1-4 МПа, причем давление создается применением природного газа, подаваемого на завод под давлением. По характеру применяемого окислителя различают парокислородную и паровоздушную конверсии. В парокислородной конверсии компенсацию потерь теплоты в эндотермической реакции (а) проводят путем одновременной реализации в одном каталитическом реакторе экзотермической реакции (б) и частичного сгорания метана до СО 2 и Н 2 О. Для этого в реактор шахтного типа подают смесь природного газа, водяного пара и воздуха, обогащенного кислородом до Паровоздушную конверсию ведут в две стадии с целью более полной утилизации тепла конвертируемого и дымовых газов. Первую стадию - реакцию (а) - проводят в каталитическом реакторе трубчатого типа идеального вытеснения, в трубках которого помещают катализатор. При этом компенсацию потерь тепла достигают путем сжигания природного газа в межтрубном пространстве реактора. Температура в реакторе – 800–850 о С. Выходящий газ содержит 8–10 % СН 4 (об.). Вторую стадию – конверсию непревращенного метана – осуществляют по реакции (б) в шахтном каталитическом реакторе при 900–1000 о С. Эта температура поддерживается за счет теплоты самой реакции. Конверсия СО – обратимая экзотермическая реакция, протекающая без изменения объема. Снижение температуры смещает равновесие вправо, но даже при Т = 500 о С скорость реакции очень мала даже в присутствии катализатора. Константа скорости реакции описывается уравнением: K = 4,92 где Е = 77,5 кДж/моль. Конверсию СО ведут на высокотемпературном железохромовом катализаторе, промотированном оксидами алюминия, кобальта и калия при температуре не менее 450 о С. При этом Технологическое оформление процесса представлено на рис. 10.2. Описание технологической схемы. Согласно данной схеме, природный газ после нагрева в теплообменнике 1 и очистки от серосодержащих соединений в аппаратах 2 и 3 смешивают с водяным паром в соотношении 1:3,5. Парогазовая смесь, нагретая дымовыми газами, отходящими из трубчатого реактора, до 380 о С в теплообменнике 4, поступает на 1-ую ступень конверсии в трубчатый реактор-конвертер 5. Конвертированный на 1-ой ступени газ, смешивают с воздухом и направляют на 2-ую ступень конверсии в шахтный реактор-конвертер 6 при температуре
дымовой
воздух 6 8 10
пар
воздух конвертиро- ванный газ СН4 7 9 5 пар
Рис. 10.2. Схема установки паровоздушной конверсии метана: 1 – подогреватель 7,9 – котел-утилизатор; 8 – реактор конверсии СО 1-ой ступени;
Очистка природного и конвертированного газа. Она необходима для защиты катализаторов конверсии метана СО и синтеза аммиака от действия ядов, которыми являются соединения серы, СО, СО 2, и О 2. Очистку газов от серосодержащих соединений мокрым (абсорбционным) или/и сухим (адсорбционным) методами. На 1-ой стадии (мокрой) очистку ведут путем поглощения СО 2 водой или растворами моноэтаноламина, гидроксидов натрия или калия. Если доля СО в газе выше Очистку газа от СО 2 водой ведут при повышенном давлении по реакции
Действие щелочей основано на следующих реакциях
Этаноламин поглощает сероводород и углекислый газ по следующей схеме
Очистку от угарного газа ведут при давлении 10–32 МПа и температуре 10 о С аммиачным раствором ацетата меди
Окончательное удаление вредных примесей из газа ведут каталитическим гидрированием на никель-алюминиевом катализаторе при 250–300 оС и давлении 30 МПа. При этом протекают следующие реакции:
О2 + Н2 = 2Н2О.
В итоге всех ступеней очистки получают азотоводородную смесь (АВС), поступающую на синтез аммиака, следующего состава, oб %: N 2 – 24,75; Ar – 0,25; H 2 – 71,25; CH 4 – 0,25.
Синтез аммиака Обратимая реакция синтеза аммиака идет с поглощением тепла и двойным уменьшением объема:
В реальных условиях процесса (Т = 500 о С, Р = 30 МПа) Константа равновесия этой реакции
К р/ = Зависимость константы равновесия от температуры описывается следующим эмпирическим уравнением lg(1/ K p) = - Коэффициенты
Таблица 10.1 Зависимость коэффициентов
Доля аммиака в равновесной газовой смеси возрастает с ростом давления и понижением температуры (табл. 10.2). Таблица 10.2 Зависимость доли аммиака в газовой смеси от параметров процесса
Из таблицы следует, что даже при 100 МПа достаточно высокий выход аммиака может быть достигнут при температуре менее 400 о С. Но при такой температуре очень низка скорость процесса и велико время достижения равновесия. Промышленный синтез аммиака удалось осуществить при температуре 450–500 о С и высоком давлении с участием катализаторов и цикличностью процесса Эта реакция катализируется рядом металлов: железо, вольфрам, рений, родий, осмий, платина, уран. Наиболее активны осмий и уран, но они очень дороги и высокочувствительны к ядам. Кроме того, уран радиоактивен. В российской азотной промышленности применяют катализатор ГИАП (государственный институт азотной промышленности) состава:
[ Fe + Al2O3 + K2O + CaO + SiO2].
В этой каталитической системе железо является главным компонентом композиции, оксид алюминия и диоксид кремния имеют функцию носителей-промоторов, оксиды калия и кальция – только промоторов.
Процесс синтеза аммиака включает следующие стадии: 1) диффузию Н 2 и N 2 к поверхности катализатора; 2) проникновение Н 2 и N 2 в поры катализатора; 3) активированную адсорбцию (химическую) Н 2 и N 2 поверхностью катализатора; 4) химическую реакцию с последовательным образованием имида NH, амида NH 2, и, наконец, аммиака NH 3; 5) десорбцию NH 3 из пор катализатора к поверхности; 6) десорбцию NH 3 из пор катализатора к поверхности; 7) удаление NH 3 из реакционной зоны. Лимитирующей стадией синтеза аммиака на железном катализаторе является 3-я стадия – активированная адсорбция азота поверхностью катализатора. Скорость реакции описывается уравнением Темкина–Пыжова: U = U 1 – U 2 = где k 1, k 2 – константы скорости прямой и обратной реакций, соответственно; р N
Энергия активации прямой реакции равна в условиях процесса 170 кДж/моль. При температурах 400 – 500о С максимальная степень превращения в процессе составляет Исследования по оптимизации параметров технологического процесса синтеза аммиака, позволили установить следующие их значения: температура – 450–550 о С; давление - 30–32 МПа. Объемная скорость подачи сырья – (3 – 4) 104 м 3 /м 3 Состав азотоводородной смеси – стехиометрический (N 2: Н 2 = 1:3). На рис. 10.3 представлена технологическая схема процесса. Процесс синтеза аммиака осуществляется следующим образом. Циркуляционный газ турбокомпрессором 8 подается на смешение со свежей азотоводородной смесью в смесителе 3 и далее в конденсационную колонну 4, где из циркуляционного газа конденсируется часть аммиака, а остальное количество рециркулирует в реактор-колонну 1. Выходящий из колонны газ, содержащий до 20 % аммиака, направляется в водяной холодильник-конденсатор 2, а затем в газоотделитель 5, где из него выделяют жидкий аммиак. Несконденсированный газ компремируют турбокомпрессором 8, смешивают со свежей азотоводородной смесью и направляют в конденсационную колонну 4, а затем в испаритель жидкого аммиака 6, где при -20 о С также конденсируется большая часть аммиака. Промышленность выпускает аммиак 1-го сорта с концентрацией аммиака 99,9 % и 2-го сорта с концентрацией 99,6 % и аммиачную воду с долей аммиака 25 %. Аммиак 1-го сорта используют в качестве хладоагента в холодильных агрегатах и удобрений, 2-го сорта – в производстве азотной кислоты. циркуляционный газ NH3 (газ)
пар вода
Рис. 10.3. Технологическая схема процесса синтеза аммиака: 1 – колонна синтеза;
Контрольные вопросы 1. Расскажите о распространении азота в природе. В чем заключается проблема «связанного» азота? 2. Дайте сравнительную оценку эффективности «связывания» азота различными промышленными способами. Приведите химизм процессов. 3. Назовите основные направления использования аммиака. 4. Назовите источники получения азота и водорода для синтеза аммиака. 5. Приведите химизм процессов конверсии метана. 6. В чем состоят особенности парокислородной и паровоздушной конверсии аммиака? 7. Представьте технологическую схему паровоздушной конверсии метана. Дайте ее 8. Объясните необходимость очистки природного и конвертированного газа. Приведите химизм процессов очистки. 9. Расскажите о катализаторах конверсии метана. 10. Сделайте анализ процесса синтеза аммиака с точки зрения термодинамики и кинетики. 11. Опишите промышленные условия синтеза аммиака. Какой катализатор используется в процессе? 12. Приведите технологическую схему процесса синтеза аммиака. Дайте ее описание. 13. Почему в производстве аммиака применяют циклическую схему? ТЕМА 11 ПРОИЗВОДСТВО БУТАДИЕНА Известно, что в производстве синтетических каучуков широко применяют углеводороды диенового ряда и их производные: бутадиен – С 4 Н 6; изопрен – С 5 Н 8: хлоропрен – С 5 Н 7 Сl, а также стирол – С 6 Н 5 СН = СН 2 и
СН3
Как правило, перечисленные мономеры получают дегидрированием соответствующих насыщенных углеводородов. Впервые в мире промышленное производство синтетического мономера – бутадиена было организовано в 1932 г. в СССР по технологии, предложенной С.В. Лебедевым из этанола в одну стадию по следующей реакции:
Zn 2С2Н5ОН = CH2=CH – CH= CH2 + 2H2O + H2.
При этом выход бутадиена по этанолу составляет 75 %. Основная реакция сопровождается рядом побочных, в результате которых образуется до 60 других веществ. В связи с высокой себестоимостью исходного сырья, этот процесс устарел и почти не применяется. До недавнего времени бутадиен получали почти исключительно путем дегидрирования В двухстадийном способе на 1-ой стадии дегидрируют н-бутан в бутилены:
СН3 – СН=СН – СН3 28 % 2-бутилен-транс Все реакции протекают с поглощением энергии. Основными параметрами данного процесса являются температура, давление, время контакта, природа катализатора и примесей и концентрация последних в сырье. Поскольку реакция идет с поглощением тепла и с увеличением объема, то равновесие может быть сдвинуто при повышении температуры и снижении давления, причем, чем ниже давление, тем ниже может быть температура процесса. На рис. 11.1 и 11.2 приведены графики зависимости равновесных концентраций участников процесса от температуры и давления, а также влияния температуры на время контакта. Как следует из представленных графиков, выход бутиленов возрастает с повышением температуры и понижением давления. При этом время контакта сокращается. Обычно 1-ую ступень дегидрирования ведут при 530–600 о С и атмосферном давлении на алюмо-хромовом катализаторе, нанесенном на оксид алюминия. При 550–575 о С оптимальное время контакта 2 с при объемной скорости подачи сырья 300–500 ч-1. Алюмо-хромовый катализатор промотируется оксидами калия или магния, или бериллия, или циркония. Катализатор |

 ч / т) и поэтому не получил широкого распространения.
ч / т) и поэтому не получил широкого распространения.
 N2 +3H2 2NH3.
N2 +3H2 2NH3.
 СН4 + Н2О СО + 3Н2 – 206 кДж/моль (а)
СН4 + Н2О СО + 3Н2 – 206 кДж/моль (а) СН4 + 0,5О2 СО + 2Н2 + 35 кДж/моль (б)
СН4 + 0,5О2 СО + 2Н2 + 35 кДж/моль (б) СН4 + СО2 2СО + 2Н2 – 248 кДж/моль (в)
СН4 + СО2 2СО + 2Н2 – 248 кДж/моль (в)
 СО + Н2 СО2 + Н2 + 41 кДж/моль (г)
СО + Н2 СО2 + Н2 + 41 кДж/моль (г)
 СН4 +2Н2О СО2 +4Н2 – 165 кДж/моль
СН4 +2Н2О СО2 +4Н2 – 165 кДж/моль газ Н2 2 3
газ Н2 2 3
 СО2 + Н2О Н2СО3.
СО2 + Н2О Н2СО3.
 Н2S + 2OH- 2H2O + S2-;
Н2S + 2OH- 2H2O + S2-;
 +HS-;
+HS-;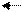
 CO2 + H2O + CH2OH – CH2NH2
CO2 + H2O + CH2OH – CH2NH2  +НСО
+НСО  .
.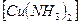 + + СH3COOH + CO + NH3 =
+ + СH3COOH + CO + NH3 =  + +CH3COONH4.
+ +CH3COONH4.


 СО + 3Н2 СН4 + Н2О; СО2 + 4Н2 СН4 + 2Н2О;
СО + 3Н2 СН4 + Н2О; СО2 + 4Н2 СН4 + 2Н2О;
 N2 + 3H2 2NH3 +
N2 + 3H2 2NH3 +  Н.
Н. .
. + 2,4943lg T +
+ 2,4943lg T +  T – 1,8564*10-7 T 2 – J.
T – 1,8564*10-7 T 2 – J. Катализатор готовят плавлением в кислородной среде смеси оксидов Fe3O4, K 2 O, CaO и SiO 2 с последующим восстановлением водородом или азотоводородной смеси магнетита (Fe 3 O 4) до металла. Промоторы создают высокоразвитую поверхность катализатора, препятствуют его рекристаллизации и повышают активность основного компонента катализатора – железа. Железный катализатор быстро и необратимо отравляется сернистыми соединениями, образуя сульфиды. СО и СО 2 отравляют железо обратимо, т.е. его можно в этом случае восстановить.
Катализатор готовят плавлением в кислородной среде смеси оксидов Fe3O4, K 2 O, CaO и SiO 2 с последующим восстановлением водородом или азотоводородной смеси магнетита (Fe 3 O 4) до металла. Промоторы создают высокоразвитую поверхность катализатора, препятствуют его рекристаллизации и повышают активность основного компонента катализатора – железа. Железный катализатор быстро и необратимо отравляется сернистыми соединениями, образуя сульфиды. СО и СО 2 отравляют железо обратимо, т.е. его можно в этом случае восстановить. =
= 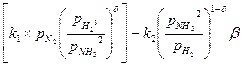 ,
, ; p H
; p H  ; p NH
; p NH  - парциальные давления азота, водорода и аммиака соответственно
- парциальные давления азота, водорода и аммиака соответственно - для железного катализатора равен 0,5.
- для железного катализатора равен 0,5.













 АВС
АВС









 8 3
8 3





















 6
6
















 1
1




















 4 4 NH3 (ж.)
4 4 NH3 (ж.)


 7
7 - метилстирол:
- метилстирол: С6Н5 – С=СН2
С6Н5 – С=СН2
 СН2= СН – СН2 – СН3 34 %
СН2= СН – СН2 – СН3 34 % 1-бутилен
1-бутилен 



 н- С4Н10 Н2 + СН3 – СН=СН – СН3 38 %
н- С4Н10 Н2 + СН3 – СН=СН – СН3 38 %


