
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Описание технологической схемы процессаСодержание книги
Поиск на нашем сайте
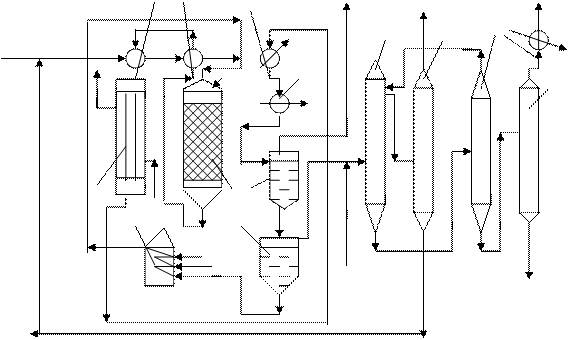
Свежий этилбензол перед подачей в реактор 5 смешивают с этилбензолом-рециркулятом и небольшим количеством пара и направляют последовательно в испаритель 2 и теплообменник 3, в которых нагрев сырья ведется за счет тепла продуктов реакции, которые после теплообменников отдают остаточное тепло в котле-утилизаторе 1 для получения водяного пара. Перед входом в реактор сырье смешивают с перегретым до 700 о С водяным паром, получаемым в трубчатой печи за счет сжигания газообразного топлива. После того, как продукты реакции покидают котел-утилизатор, они окончательно охлаждаются в водяном холодильнике 6 и рассольном холодильнике 7 и поступают в сепаратор 8 для разделения газа и конденсата. Углеводородный газ используют для сжигания в печи 4, а конденсат подают во второй сепаратор 9, где его разделяют на углеводородную и водную фазы. Водяной слой направляют в печь 4 и используют для получения водяного пара, а углеводородную фазу («печное масло») подают на ректификацию. Состав печного масла следующий: стирол – до
этилбен- 10 11 12 зол вода пар 7 воздух рассол 13 5 8 1 вода 4 9 воздух газ ингибитор водный остаток слой
Рис. 12. 4. Технологическая схема производства стирола дегидрированием этилбензола: 1 – котел-утилизатор; 2 – испаритель; 3 – теплообменник; 4 – трубчатая печь; 5 – реактор;
Кубовый продукт колонны 10, содержащий целевой продукт – стирол, подают в колонну 12, работающую также под вакуумом, где в качестве дистиллята выводят остатки этилбензола с частью стирола, который возвращают в колонну 10 в качестве острого орошения. Кубовый продукт колонны 12 подают на окончательную ректификацию в колонну 13, из которой выводят дистиллят, содержащий товарный стирол с чистотой 99,8 %.
Основной аппарат установки – адиабатический реактор. Он футерован огнеупорным материалом для максимального снижения тепловых потерь. Реактор имеет диаметр 4 м и высоту
Показатели процесса
Температура – 590–620 о С Объемная скорость подачи сырья – 0,35 – 0,5 ч -1 Соотношение этилбензол:пар (мас) – 1:2,6 Конверсия этилбензола – 45 % мас. Селективность – 90 % Выход стирола за один проход – 40 %
Контрольные вопросы
1. Расскажите о физических свойствах стирола и областях его применения. 2. Каковы источники сырья для получения стирола и промышленные способы его 3. Назовите основное сырье для получения стирола. Как получают этилбензол? Напишите реакции его синтеза. 4. Какой катализатор применяют при получении этилбензола алкилированием этилена? Разберите реакцию Фриделя-Крафтса с точки зрения термодинамики и кинетики процесса. 5. Приведите побочные реакции при синтезе этилбензола алкилированием этилена. Каковы параметры этого процесса? 6. Приведите химизм процесса синтеза стирола при дегидрировании этилбензола. Укажите побочные реакции. Назовите параметры и катализаторы этого процесса. 7. Приведите технологическую схему процесса синтеза стирола из этилбензола. Дайте ее описание.
ТЕМА 13 ПРОИЗВОДСТВО ЭТАНОЛА Этанол – С 2 Н 5 ОН - бесцветная жидкость с характерным запахом. Т кип. = 78,4 о С,
Мировое производство этанола составляет примерно 3 млн. т /год. Такая большая потребность в этаноле объясняется обширным перечнем областей его применения. При этом около половины его производства идет на получение ацетальдегида по реакции:
2СН3СН2ОН = 2СН3СНО + Н2.
Другие области применения: - для получения диэтилового эфира
2СН3СН2ОН = СН3СН2 – О – СН2СН3 + Н2О;
- для получения хлораля
СН3СН2ОН + 4Сl2 = CCl3 – CHO + 5HCl;
- для получения этилацетата О
СН3СН2ОН + СН3СООН = СН3СН2 – С – СН3;
- для получения хлорэтила
СН3СН2ОН + НСl = CH3CH2Cl + H2O.
Этанол используется также в качестве растворителя, в парфюмерии, медицине, а также как компонент автомобильного и авиационного топлива. Известно также его применение в производстве антифризов и тормозной жидкости на основе этиленгликоля. Впервые этиловый спирт был получен ректификацией виноградного вина еще в 11–12 веках. Отсюда и второе его название – винный спирт. Применение спирта в медицине известно с 12 века. В настоящее время все промышленные производства этилового спирта делятся на 4 группы и, соответственно, производят 4 сорта спирта: - гидратация этилена (синтетический этанол); - гидролиз древесины (гидролизный этанол); - осахаривание крахмала (ферментативный или пищевой этанол); - переработка сульфитных щелоков (сульфитный этанол). Последние три способа производства этилового спирта являются биохимическими и основаны на явлении брожения углеводосодержащего сырья с образованием в качестве промежуточных продуктов сахара и/или глюкозы. Метод гидратации этилена позволяет получить наибольший выход спирта – до 90 %. Для сравнения, выход спирта из картофеля составляет около 10 %, из зерна – 30 %, древесины – Впервые промышленный способ производства синтетического этилового спирта был разработан на основе метода сернокислотной гидратации этилена в две стадии в 1910–30 гг.: 1 стадия – этерификация этилена
О - CH2CH3 диалкилсульфат моноалкилсульфат (этилсерная кислота)
2 стадия - гидролиз эфиров
В 1947 г. в США был впервые осуществлен одностадийный метод прямой гидратации этилена на твердом катализаторе, который позволил исключить из процесса агрессивную разбавленную серную кислоту и повысить выход спирта с 90 до 95 %. Этот способ основан на реакции:
СН2 = СН2 + Н2О = СН3СН2ОН + 81 кДж /моль,
которую сопровождают побочные:
диэтиловый полимер эфир
Как видно из уравнения основной реакции, процесс протекает в газовой фазе с уменьшением объема и выделением тепла. Следовательно, по принципу Ле-Шателье равновесие можно сместить вправо путем снижения температуры и повышения давления и концентрации исходных веществ. Однако снижение температуры, как известно, приводит к падению скорости процесса.
Исследования по оптимизации параметров процесса показали, что наилучшие показатели могут быть достигнуты при давлении 5 МПа и температуре 270–275 о С при стехиометрическом соотношении реагентов. Высокую селективность в этих условиях проявляют катализаторы ионного типа, такие как Н 3 РО 4 на диатомите или кремниевовольфрамовая кислота SiO 2*12 WO 3*n H 2 O. Так как процесс протекает в системе газ – твердое тело (катализатор), то его скорость будет определяться условиями диффузии реагентов к поверхности катализатора и адсорбционными свойствами самого катализатора, этилена и спирта. При этом этилен должен быстро адсорбироваться, а спирт – десорбироваться. В этом процессе оптимальной объемной скоростью подачи сырья является 4500–5500 ч -1. При этих условиях конверсия этилена составляет не более 5 % за один проход и поэтому процесс ведут по циркуляционной схеме (рис. 13.1).
вода катали- вода затор вода 6 С2Н4 2 4 1 3 5
вода 7 9 контактный газ пар остаток вода
Рис. 13.1. Технологическая схема производства этанола гидратацией этилена:
|
|||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 261; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.24.70 (0.012 с.) |

 2 3 6 отходящие газы стирол бензол
2 3 6 отходящие газы стирол бензол 4 C 2 H 5 OH; MgCl 2
4 C 2 H 5 OH; MgCl 2 

 OH C2H4
OH C2H4


 С2Н4 + Н2SO4 O2S O2S(OCH2CH3)2
С2Н4 + Н2SO4 O2S O2S(OCH2CH3)2 OH
OH О2S – O – CH2CH3 + H2O CH3CH2OH + H2SO4;
О2S – O – CH2CH3 + H2O CH3CH2OH + H2SO4; O – CH2CH3
O – CH2CH3
 O2S O – CH2CH3 + H2O 2CH3CH2OH.
O2S O – CH2CH3 + H2O 2CH3CH2OH.

 2С2Н5ОН (С2Н5)2О + Н2О и nC2H4 (C2H4)n
2С2Н5ОН (С2Н5)2О + Н2О и nC2H4 (C2H4)n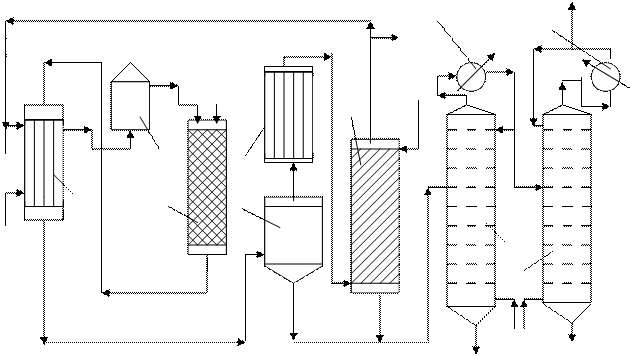 циркуляционный газ этанол 8 8
циркуляционный газ этанол 8 8


