
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Связь различных способов выражения концентрации растворовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Очевидно, что значение концентрации растворенного вещества в данном растворе зависит от способа ее выражения, причем, существует определенная зависимость величин концентраций. Например, если концентрация вещества выражена в моль/л (молярная концентрация), то ей соответствует вполне определенное значение концентрации, выраженное в массовой доле. Вывод уравнений, связывающих различные выражения концентрации одного и того же раствора. 1) Молярность - массовая доля (СМ - ω). Молярная концентрация – это химическое количество вещества, содержащееся в одном литре раствора: СМ = 2) Моляльность – массовая доля (Cm - ω). Моляльная концентрация – это химическое количество вещества, растворенное в одном килограмме растворителя: Cm = Очевидно, что mвещества /mраствора = ω, mрастворителя/ mраствора = 1 – ω, так как mрастворителя = mраствора - mвещества, тогда с учетом того, что молярная масса М определяется в граммах, а моляльная концентрация на килограмм растворителя получаем, умножив на 1000: Cm = ω·1000/M(1 – ω) = 3) Молярность – нормальность (СМ – Сэкв.). Так как Cэк. = Cэк. = Z.CM В итоге связь различных способов выражения концентраций выглядит следующим образом: СМ = ω· ρ·1000/M = CM = fэк.·Сэк.; Z·CM = Cэк., где СМ =
1.5 Причины образования растворов С позиции химической термодинамики самопроизвольное протекание процесса растворения возможно, если изменение энергии Гиббса меньше нуля: ΔG = ΔH - TΔS <0
Главное – рост энтропии при перемешивании частиц. Обычно ΔSраств > 0 (хотя иногда при растворении в концентрированных растворах ΔSраств < 0 из-за упорядочения молекул растворителя). Кроме того, как мы видели, бывает и тепловой эффект растворения, нaпример: ΔНраств > 0 при растворении KSCN в воде (эндотермический процесс) или ΔНраств < 0 при растворении H2SO4 в воде (экзотермический процесс). Это зависит от межмолекулярного взаимодействия. Внутри молекул – прочные ковалентные связи. Но и между молекулами есть притяжение, только более слабое. Если бы его не было, то все молекулярные вещества при всех температурах были бы газами. Выше указывались следующие виды межмолекулярных сил: водорордная связь, ориентационное (диполь-дипольное), индукционное и дисперсионное взаимодействие. В растворах электролитов в полярных растворителях наблюдается ион-дипольное взаимодействие. Притяжение полярных молекул растворителя к ионам гораздо сильнее, чем к другим полярным молекулам, особенно если ион многозарядный. При этом, кроме чисто электростатического притяжения, могут также образовываться ковалентные донорно-акцепторные связи, но их механизм мы пока не рассматриваем. В общем виде (М - ион, L - молекула растворителя): M±p + nL = MLn±p; ΔH < 0. Молекула воды - одна из самых полярных, поэтому c ней ΔH такого процесса особенно велика по абсолютной величине - от 300 до 3000 кДж/моль. Это больше энергии одной ковалентной связи, так как каждый ион присоединяет к себе много молекул воды (n не меньше 4, а обычно - больше). Взаимодействие частиц растворенного вещества с растворителем называется сольватация, а если растворитель - вода, то гидратация. Продукт взаимодействия - сольват (гидрат). Если сольватация особенно сильная, то сольваты сохраняются не только в растворе, но и в кристаллическом состоянии, например, FeSO4·7H2O, MgCl2·6C2H5OH. Тогда, растворив безводную соль в жидкости, мы обратно (при упаривании) получаем не ее, а сольват. Таким образом, тепловой эффект растворения состоит из двух слагаемых: затраты энергии на преодоление притяжения между частицами (молекулами или ионами) в исходных веществах и выделения энергии при взаимодействии частиц разных веществ. Поскольку слагаемые имеют разные знаки, то сумма - ΔH растворения - может быть и положительной, и отрицательной.
Пример. Растворение твердого хлорида натрия в воде можно мысленно разбить на следующие стадии.
1) разрушение кристалла на свободные (газообразные) ионы: NaCl(тв.) = Na+(г) + Cl-(г); ΔH1>0;
2) гидратация этих ионов: Na+(г) + рН2О = Na(Н2О)р+ (р-р)
Cl-(г) + qН2О = Cl(Н2О)q- (р-р) ΔH2 <0
Итоговое уравнение: NaCl(тв.) + (р+q)Н2О = Na(Н2О)р+ (р-р) + Cl(Н2О)q- (р-р) ΔHраств (NaCl) = ΔH1 + ΔH2
Отсюда видно, что тепловой эффект растворения близок к нулю, это малая разность двух больших величин, и его трудно точно вычислить. Экспериментально измерено: ΔHраств (NaCl)» 2-4 кДж/моль (в зависимости от концентрации). Реально, конечно же, перечисленные стадии происходят не последовательно, а параллельно. Энтальпия сублимации (переход в газообразное состояние) слишком велика, чтобы этот процесс шел самопроизвольно. Полярные молекулы воды ориентируются на поверхности ионного кристалла и отрывают от нее ионы. Аналогично они отрывают полярные молекулы, например, из кристалла сахара. Если мы смешиваем две жидкости с водородными связями, например, воду и серную кислоту, воду и спирт, то кристаллических решеток здесь нет, но и здесь преодолевается притяжение между одинаковыми молекулами (ΔH1 > 0) и возникает притяжение между разными (ΔH2 < 0). Что получится в сумме - трудно предугадать заранее, но из опыта мы знаем, что при смешивании ΔH < 0. Таким образом, только в газовых растворах и в растворах неполярных молекул можно пренебречь взаимодействием растворителя с растворенным веществом и считать растворение чисто физическим процессом. В остальных случаях образуются прочные соединения растворителя с растворенным веществом (обычно переменного состава).
|
||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 2243; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.26.47 (0.01 с.) |

 . Пусть Vраствора = 1л, тогда СМ = n =
. Пусть Vраствора = 1л, тогда СМ = n =  , масса вещества, выраженная через массовую долю равна: m = ω.mраствора = ω.ρ.1000, так как ω =
, масса вещества, выраженная через массовую долю равна: m = ω.mраствора = ω.ρ.1000, так как ω =  , а масса одного литра раствора равна: mраствора = ρ.1000, где ρ – плотность раствора в г/мл. Подставляем полученное выражение для массы вещества и получаем: СМ = ω. ρ.1000/M =
, а масса одного литра раствора равна: mраствора = ρ.1000, где ρ – плотность раствора в г/мл. Подставляем полученное выражение для массы вещества и получаем: СМ = ω. ρ.1000/M =  .
. 
 =
=  , разделим числитель и знаменатель на массу раствора, тогда Cm =
, разделим числитель и знаменатель на массу раствора, тогда Cm =  =
=  =
=  .
. .
. , СМ =
, СМ =  , nэк. = z · n или n = nэкв.· fэкв., где fэкв. – фактор эквивалентности, z – число эквивалентности растворенного вещества (fэкв. = 1/z), nэкв. = z · n = z . СМ . Vраствора. Подставляя в первое уравнение полученное из второго уравнения выражение для количества молей-эквивалентов и, сокращая в числителе и знаменателе Vраствора, получаем:
, nэк. = z · n или n = nэкв.· fэкв., где fэкв. – фактор эквивалентности, z – число эквивалентности растворенного вещества (fэкв. = 1/z), nэкв. = z · n = z . СМ . Vраствора. Подставляя в первое уравнение полученное из второго уравнения выражение для количества молей-эквивалентов и, сокращая в числителе и знаменателе Vраствора, получаем: ; Cm = ω·1000/M(1 – ω) =
; Cm = ω·1000/M(1 – ω) = 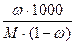 ;
; – моляльная концентрация (моль/кг), Cэк. =
– моляльная концентрация (моль/кг), Cэк. = 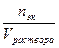 – молярная концентрация эквивалентов (моль.эк./л) (нормальность раствора).
– молярная концентрация эквивалентов (моль.эк./л) (нормальность раствора).


