
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислотные и основные гидроксидыСодержание книги
Поиск на нашем сайте
Гидроксиды - тип сложных веществ, в состав которых входят атомы некоторого элемента Е (кроме фтора и кислорода) и гидроксогруппы ОН; общая формула гидроксидов Е(ОН) n, где n = 1÷6. Форма гидроксидов Е(ОН) n называется орто -формой; при n > 2 гидроксид может находиться также в мета -форме, включающей кроме атомов Е и групп ОН еще атомы кислорода О, например Е(ОН)3 и ЕО(ОН), Е(ОН)4 и Е(ОН)6 и ЕО2(ОН)2. Гидроксиды делят на две противоположные по химическим свойствам группы: кислотные и основные гидроксиды. Кислотные гидроксиды содержат атомы водорода, которые могут замещаться на атомы металла при соблюдении правила стехиометрической валентности. Большинство кислотных гидроксидов находится в мета -форме, причем атомы водорода в формулах кислотных гидроксидов ставят на первое место, например H2SO4, HNO3 и H2CO3, а не SO2(OH)2, NO2(OH) и CO(OH)2. Общая формула кислотных гидроксидов Н х ЕО у, где электроотрицательную составляющую ЕО ух называют кислотным остатком. Если не все атомы водорода замещены на металл, то они остаются в составе кислотного остатка. Названия распространенных кислотных гидроксидов состоят из двух слов: собственного названия с окончанием “ая” и группового слова “кислота”. Ниже приведены формулы и собственные названия распространенных кислотных гидроксидов и их кислотных остатков (прочерк означает, что гидроксид не известен в свободном виде или в кислом водном растворе):
Названия кислотных остатков используют при построении названий солей. Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка. (С точки зрения теории электролитической диссоциации: кислоты - электролиты, которые при диссоциации в качестве катионов образуют только H+). Классификация 1. По составу: бескислородные и кислородсодержащие. 2. По числу атомов водорода, способных замещаться на металл: одно-, двух-, трёхосновные. Бескислородные:
1. Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот): SO3 + H2O = H2SO4 P2O5 + 3H2O = 2H3PO4 2. Взаимодействие водорода с неметаллом и последующим растворением полученного продукта в воде (для бескислородных кислот): H2 + Cl2 = 2HCl H2 + S = H2S 3. Реакциями обмена соли с кислотой Ba(NO3)2 + H2SO4 = BaSO4↓+ 2HNO3 в том числе, вытеснение слабых, летучих или малорастворимых кислот из солей более сильными кислотами: Na2SiO3 + 2HCl = H2SiO3↓+ 2NaCl 2NaCl(тв.) + H2SO4(конц.) = Na2SO4 + 2HCl↑ Химические свойства 1. Действие на индикаторы. лакмус - красный H2SO4 + 2KOH = K2SO4 + 2H2O 2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O 3. Взаимодействие с основными оксидами: CuO + 2HNO3 = Cu(NO3)2 + H2O 4. Взаимодействие с металлами(металлы, стоящие в ряду напряжений до водорода, кислоты-неокислители): Zn + 2HCl = ZnCl2 + H2 2Al + 6HCl = 2AlCl3 + 3H2 Азотная кислота взаимодействует с металлами, стоящими в ряду напряжений как до водорода, так и после (кроме золота и платины), без выделения водорода, при этом происходит восстановление азота от степени окисления +5 до +4 – (-3) в зависимости от степени разбавления кислоты и активности металла. Восстановление тем глубже, чем активнее металл и ниже концентрация кислоты: Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2 + 2H2O 5Mg + 12HNO3(разбавл.) = 5Mg(NO3)2 + N2 + 6H2O 4Mg + 10HNO3(сильно разбавл.) = 4Mg(NO3)2 + NH4NO3 + 3H2O Азотная кислота (особенно при нагревании) способна окислять не только металлы, но и многие неметаллы, кроме кремния, фтора и хлора. При этом концентрированная HNO3 восстанавливается чаще всего до NO2, а разбавленная – до NO: S + 6HNO3(конц.) = H2SO4 + 6NO2 + 2H2O P + 5HNO3(конц.) = H3PO4 + 5NO2 + H2O C + 4HNO3(конц.) = CO2 + 4NO2 + 2H2O 3P + 5HNO3(разбавл.) + 2H2O = 3H3PO4 + 5NO I2 + 10HNO3(конц.) = 2HIO3 + 10NO2 + 4H2O Разбавленная серная кислота взаимодействует только с металлами, стоящими в ряду напряжений металлов до водорода, с выделением водорода. Zn + H2SO4(разбавл.) = ZnSO4 + Н2 Концентрированная серная кислота реагирует как с металлами, находящимися в ряду напряжений как до водорода, так и после (кроме Au, Pt), без выделения водорода. С более активными металлами восстановление серы глубже: 8Na +5H2SO4(конц) = 4Na2SO4 + 4H2O + H2S 3Zn + 4H2SO4(конц) = 3ZnSO4 + S 5. Взаимодействие с солями (реакции обмена), при которых выделяется газ или образуется осадок: H2SO4 + BaCl2 = BaSO4 +2HCl
Основные гидроксиды. Основаные гидроксиды состоят из иона металла и гидроксогрупп (OH-). Например, NaOH, Mg(OH)2, La (OH)3, Ca (OH)2.
Получение 1. Реакции активных металлов (щелочных и щелочноземельных металлов) с водой: 2Na + 2H2O = 2NaOH + H2 Ca + 2H2O = Ca(OH)2 + H2 2. Взаимодействие оксидов активных металлов с водой: BaO + H2O = Ba(OH)2 3. Электролиз водных растворов солей 2NaCl + 2H2O = 2NaOH + H2 + Cl2
1. Действие на индикаторы растворимых основных гидроксидов. лакмус - синий 2. Взаимодействие с кислотными оксидами. 2KOH + CO2 = K2CO3 + H2O KOH + CO2 = KHCO3 3. Взаимодействие с кислотами (реакция нейтрализации) с образованием солей (реакция солеобразования), например: Ca(OH)2 + H2SO4 = CaSO4 + 2H2O Ca(OH)2 + 2H2SO4 = Ca(HSO4)2 + 2H2O 2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O NaOH + HNO3 = NaNO3 + H2O 4. Обменная реакция с солями Ba(OH)2 + K2SO4 = 2KOH + BaSO4 ↓ 3KOH+Fe(NO3)3 = Fe(OH)3 ↓+ 3KNO3 5. Термический распад. Cu(OH)2 –t° = CuO + H2O 3.4 Кислотные и оснόвные оксиды
Оксиды Е х О y продукты полной дегидратации гидроксидов:
Кислотным гидроксидам (H2SO4, H2CO3) отвечают кислотные оксиды (SO3, CO2), а основным гидроксидам (NaOH, Ca(OH)2) основные оксиды (Na2O, CaO), причем степень окисления элемента Е не изменяется при переходе от гидроксида к оксиду. Пример формул и названий оксидов:
Химические свойства Основные оксиды Кислотные оксиды 1. Взаимодействие с водой Образуется основание: Образуется кислота: Na2O + H2O = 2NaOH SO3 + H2O = H2SO4 CaO + H2O = Ca(OH)2 P2O5 + 3H2O = 2H3PO4 При реакции с кислотой При реакции с основанием MgO + H2SO4 = MgSO4 + H2O CO2 + Ba(OH)2 = BaCO3 + H2O CuO + 2HCl = CuCl2 + H2O SO2 + 2NaOH = Na2SO3 + H2O Амфотерные оксиды взаимодействуют с кислотами как основные: ZnO + H2SO4 = ZnSO4 + H2O
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] в водном растворе 3. Взаимодействие основных и кислотных оксидов между собой приводит к солям. Na2O + CO2 = Na2CO3 4. Восстановление до простых веществ: 3CuO + 2NH3 = 3Cu + N2 + 3H2O P2O5 + 5C = 2P + 5CO
Амфотерность гидроксидов и оксидов химическое свойство, заключающееся в образовании ими двух рядов солей, например, для гидроксида и оксида алюминия: (а) 2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O (б) 2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O Al2O3 + 2NaOH = 2NaAlO2 + H2O Так, гидроксид и оксид алюминия в реакциях (а) проявляют свойства основных гидроксидов и оксидов, т.е. реагируют с кислотными гидроксидам и оксидом, образуя соответствующую соль сульфат алюминия Al2(SO4)3, тогда как в реакциях (б) они же проявляют свойства кислотных гидроксидов и оксидов, т.е. реагируют с основными гидроксидом и оксидом, образуя соль диоксоалюминат (III) натрия NaAlO2. В первом случае элемент алюминий проявляет свойство металла и входит в состав электроположительной составляющей (Al3+), во втором свойство неметалла и входит в состав электроотрицательной составляющей формулы соли (AlO2). Если указанные реакции протекают в водном растворе, то состав образующихся солей меняется, но присутствие алюминия в катионе и анионе остаётся: 2Al(OH)3 + 3H2SO4 = [Al(H2O)6]2(SO4)3 Al(OH)3 + NaOH = Na[Al(OH)4] Здесь квадратными скобками выделены комплексные ионы [Al(H2O)6]3+ - катион гексаакваалюминия(III), [Al(OH)4] - тетрагидроксоалюминат(III)-ион. Элементы, проявляющие в соединениях металлические и неметаллические свойства, называют амфотерными, к ним относятся элементы А-групп Периодической системы Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po и др., а также большинство элементов Б-групп Cr, Mn, Fe, Zn, Cd, Au и др. Амфотерные оксиды называют так же, как и основные, например:
Амфотерные гидроксиды (если степень окисления элемента превышает + II) могут находиться в орто или (и) мета форме. Приведем примеры амфотерных гидроксидов:
Амфотерным оксидам не всегда соответствуют амфотерные гидроксиды, поскольку при попытке получения последних образуются гидратированные оксиды, например:
Если амфотерному элементу в соединениях отвечает несколько степеней окисления, то амфотерность соответствующих оксидов и гидроксидов (а следовательно, и амфотерность самого элемента) будет выражена по-разному. Для низких степеней окисления у гидроксидов и оксидов наблюдается преобладание основных свойств, а у самого элемента металлических свойств, поэтому он почти всегда входит в состав катионов. Для высоких степеней окисления, напротив, у гидроксидов и оксидов наблюдается преобладание кислотных свойств, а у самого элемента неметаллических свойств, поэтому он почти всегда входит в состав анионов. Так, у оксида и гидроксида марганца(II) доминируют основные свойства, а сам марганец входит в состав катионов типа [Mn(H2O)6]2+, тогда как у оксида и гидроксида марганца(VII) доминируют кислотные свойства, а сам марганец входит в состав аниона типа MnO4. Амфотерным гидроксидам с большим преобладанием кислотных свойств приписывают формулы и названия по образцу кислотных гидроксидов, например HMnO4 марганцовая кислота. Таким образом, деление элементов на металлы и неметаллы условное; между элементами (Na, K, Ca, Ba и др.) с чисто металлическими и элементами (F, O, N, Cl, S, C и др.) с чисто неметаллическими свойствами существует большая группа элементов с амфотерными свойствами. Соли
Zn(OH)Cl → [Zn(OH)]+ + Cl- → Zn2+ + OH- + Cl- Продукты неполного замещения групп OH соответствующего основания на кислотные остатки. KAl(SO4)2 → K+ + Al3+ + 2SO42- Смешанные. Образованы одним катионом и двумя анионами: CaOCl2 → Ca2+ + Cl- + OCl- Комплексные. Содержат сложные катионы или анионы. [Ag(NH3)2]Br → [Ag(NH3)2]+ + Br - Na[Ag(CN)2] → Na+ + [Ag(CN)2]- Средние соли Название Средние соли называют используя название кислотного остатка в именительном падеже и катиона металла в родительном. Например, соли К3РО4, Са(NO3)2, NaCl называют фосфат калия, нитрат кальция, хлорид натрия соответственно. Получение Большинство способов получения солей основано на взаимодействии веществ с противоположными свойствами: 2Na + Cl2 = 2NaCl 2) металла с кислотой: Zn + 2HCl = ZnCl2 + H2 3) металла с раствором соли менее активного металла Fe + CuSO4 = FeSO4 + Cu 4) основного оксида с кислотным оксидом: MgO + CO2 = MgCO3 5) основного оксида с кислотой CuO + H2SO4 = CuSO4 + H2O 6) основания с кислотным оксидом Ba(OH)2 + CO2 = BaCO3 + H2O 7) основания с кислотой: Ca(OH)2 + 2HCl = CaCl2 + 2H2O 8) соли с кислотой: MgCO3 + 2HCl = MgCl2 + H2O + CO2 BaCl2 + H2SO4 = BaSO4 + 2HCl 9) раствора основания с раствором соли: Ba(OH)2 + Na2SO4 = 2NaOH + BaSO4↓ 10) растворов двух солей с образованием осадка нерастворимой соли: 3CaCl2 + 2Na3PO4 = Ca3(PO4)2↓+ 6NaCl
Ca(HSO4)2 + Ca(OH) = CaSO4↓+ 2H2O (CaOH)2SO4 + H2SO4 = 2CaSO4↓+ 2H2O
CaCO3 = CaO + CO2 2Cu(NO3)2 = 2CuO + 4NO2 + O2 NH4Cl = NH3 + HCl 2. Гидролиз. Al2S3 + 6H2O = 2Al(OH)3 + 3H2S FeCl3 + H2O = Fe(OH)Cl2 + HCl Na2S + H2O = NaHS +NaOH AgNO3 + HCl = AgCl + HNO3 Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3 CaCl2 + Na2SiO3 = CaSiO3 + 2NaCl 4. Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона. 2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2 + 8H2O Кислые соли Название Кислые соли называют аналогичным образом, добавляя к названию кислотного остатка приставку гидро, дигидро, тригидро, и.т.д. Например, соли КН2РО4, NaHSO4, СsHCO3 называют дигидрофосфат калия, гидросульфат натрия, гидрокарбонат цезия соответственно.
1. Взаимодействие кислоты с взятым в недостатке основанием. KOH + H2SO4 = KHSO4 + H2O 2. Взаимодействие основания с избытком кислотного оксида Ca(OH)2 + 2CO2 = Ca(HCO3)2 3. Взаимодействие средней соли с кислотой Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2 Химические свойства. 1. Термическое разложение с образованием средней соли Ca(HCO3)2 = CaCO3 + CO2 + H2O 2. Взаимодействие со щёлочью. Получение средней соли.
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2H2O Основные соли Название Основные соли называют аналогично средним, добавляя к названию катиона приставку гидроксо, дигидроксо и. т.д. Например, соли ZnOHCl, Fe(OH)2Cl, AlOHSO4 называют хлорид гидроксоцинка, хлорид дигидроксожелеза, сульфат гидроксоалюминия соответственно.
1. Гидролиз солей, образованных слабым основанием и сильной кислотой ZnCl2 + H2O = [Zn(OH)]Cl + HCl 2. Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов AlCl3 + 2NaOH = [Al(OH)2]Cl + 2NaCl 3. Взаимодействие солей слабых кислот со средними солями 2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl Химические свойства.
1. Термическое разложение.
[Cu(OH)]2CO3(малахит) = 2CuO + CO2 + H2O 2. Взаимодействие с кислотой: образование средней соли. Sn(OH)Cl + HCl = SnCl2 + H2O
Бинарные соединения
Большую группу неорганических сложных веществ составляют бинарные соединения. К ним относятся, в первую очередь все двухэлементные соединения (кроме основных, кислотных и амфотерных оксидов), например H2O, KBr, H2S, Cs2(S2), N2O, NH3, HN3, CaC2, SiH4. Электроположительная и электроотрицательная составляющие формул этих соединений включают отдельные атомы или связанные группы атомов одного элемента. Многоэлементные вещества, в формулах которых одна из составляющих содержит не связанные между собой атомы нескольких элементов, а также одноэлементные или многоэлементные группы атомов (кроме гидроксидов и солей), рассматривают как бинарные соединения, например CSO, IO2F3, SBrO2F, CrO(O2)2, PSI3, (CaTi)O3, (FeCu)S2, Hg(CN)2, (PF3)2O, VCl2(NH2). Так, CSO можно представить как соединение CS2, в котором один атом серы заменен на атом кислорода. Названия бинарных соединений строятся по обычным номенклатурным правилам, например:
Для некоторых бинарных соединений используют специальные названия, список которых был приведен ранее. Химические свойства бинарных соединений довольно разнообразны, поэтому их часто разделяют на группы по названию анионов, т.е. отдельно рассматривают галогениды, халькогениды, нитриды, карбиды, гидриды и т. д. Среди бинарных соединений встречаются и такие, которые имеют некоторые признаки других типов неорганических веществ. Так, соединения CO, NO, NO2, и (FeIIFe2III)O4, названия которых строятся с применением слова оксид, к типу оксидов (кислотных, основных, амфотерных) отнесены быть не могут. Монооксид углерода СО, монооксид азота NO и диоксид азота NO2 не имеют соответствующих кислотных гидроксидов (хотя эти оксиды образованы неметаллами С и N), не образуют они и солей, в состав анионов которых входили бы атомы СII, NII и NIV. Двойной оксид (FeIIFe2III)O4 оксид дижелеза(III)-железа(II) хотя и содержит в составе электроположительной составляющей атомы амфотерного элемента железа, но в двух разных степенях окисления, вследствие чего при взаимодействии с кислотными гидроксидами образует не одну, а две разные соли. Такие бинарные соединения, как AgF, KBr, Na2S, Ba(HS)2, NaCN, NH4Cl, и Pb(N3)2, построены, подобно солям, из реальных катионов и анионов, поэтому их называют солеобразными бинарными соединениями (или просто солями). Их можно рассматривать как продукты замещения атомов водорода в соединениях НF, НCl, НBr, Н2S, НCN и НN3. Последние в водном растворе обладают кислотной функцией, и поэтому их растворы называют кислотами, например НF(aqua) фтороводородная кислота, Н2S(aqua) сероводородная кислота. Однако они не принадлежат к типу кислотных гидроксидов, а их производные к солям в рамках классификации неорганических веществ.
Гидриды металлов Известны соединения с водородом всех элементов, кроме благородных газов, платиновых металлов (кроме Pd): Ag, Au, Cd, Hg, In, Tl. Комплексные гидриды металлов LiAlH4, NaBH4 широко используются в органическом синтезе в качестве восстанавливающих реагентов. При нагревании с металлами водород (Н2) образует гидриды: 2Li + H2 = 2LiH Ca + H2 = CaH2 Гидриды металлов неустойчивы и легко разлагаются водой: LiH + H2O = LiOH + H2 Они являются сильными основаниями и способны оторвать протон даже от весьма слабых органических кислот: CH3-CO-CH3 + Na+H- = CH3-CO-C-H2Na+ + H2
СТРОЕНИЕ АТОМА
4.1 Исторические этапы развития представлений о строении атома Большую роль в установлении структуры атома сыграло открытие и изучение радиоактивности. Кроме того, на рубеже XIX–XX вв. были открыты такие явления, как фотоэлектрический эффект, катодные лучи, рентгеновские лучи. Эти открытия свидетельствовали о сложной структуре атома. hν = Eн – Eк, где h – постоянная Планка (h=6,62 ×10–34 Дж×с); Ен, Ек – соответственно энергии начального и конечного состояний (Рис.4.1.).
Рис.4.1. Переход электрона с одного энергетического уровня на другой.
λ = h/(m . v), где m – масса частицы, v – ее скорость. Эта гипотеза основывалась на последних достижениях физики того времени (например, было уже известно, что свет имеет двойственную природу, обладая свойствами электромагнитной волны с длиной λ = с/ν и одновременно свойствами потока частиц – фотонов с энергией каждого Е = hν. Гипотеза де Бройля экспериментально подтверждается дифракцией электронов в кристаллах и позволяет объяснить существование стационарных орбит. Электрон может без потери энергии находиться на тех орбитах, в которых укладывается целое число волн де Бройля. В этом случае соблюдается условие существования стоячей волны.
4.2 Волновое уравнение. Квантовомеханическое объяснение строения атома Неопределенность установления положения и скорости электрона столь велика, что необходимо вообще отказаться от анализа траектории его движения. Однако есть возможность вероятностного описания строения атома. где Y – волновая функция; m – масса электрона. Масса покоя электрона me = 9,109.10-31 кг; U – потенциальная энергия; E – полная энергия электрона; x, y, z – координаты электрона в системе с центром в ядре атома. Решением уравнения Шредингера является волновая функция Y и соответствующее ей значение энергии электрона E. Вероятность нахождения электрона в пространстве характеризуется квадратом волновой функции. Квадрат волновой функции в данной точке пространства |Y|2 – это плотность вероятности обнаружения электрона в этой точке пространства. Значит величина |Y|2. dv – вероятность обнаружить электрон в области пространства dv. Вероятность обнаружить электрон в какой-нибудь точке пространства равна единице, т.е.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 581; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.24.70 (0.017 с.) |


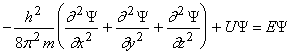

 , причем величина волновой функции вдали от ядра атома близка к нулю и, поэтому электрон находится вблизи ядра. Область пространства, ограниченная поверхностью одинакового значения величины волновой функции электрона, вероятность обнаружения электрона в которой составляет 0,9 (или 90%) называется электронным облаком.
, причем величина волновой функции вдали от ядра атома близка к нулю и, поэтому электрон находится вблизи ядра. Область пространства, ограниченная поверхностью одинакового значения величины волновой функции электрона, вероятность обнаружения электрона в которой составляет 0,9 (или 90%) называется электронным облаком. 


