Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гибридизация орбиталей и структура комплексовСодержание книги
Поиск на нашем сайте
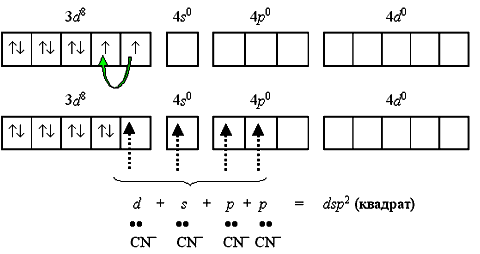
Применяя обычный алгоритм предсказания типа гибридизации атомных орбиталей в рамках метода валентных связей, можно определить геометрию комплексов разного состава. Для этого прежде всего необходимо написать электронную формулу валентного уровня и построить схему распределения электронов по квантовым ячейкам. Например, для нейтрального атома никеля: [Ar] 3 d 8 4 s 2 4 p 0 Переход 4 s -электронов на 3 d -подуровень превращает парамагнитный атом Ni0 в диамагнитную частицу Ni*: [Ar] 3 d 10 4 s 0 4 p 0 Полученные вакантные орбитали подвергаются гибридизации, образуя тетраэдрическую конфигурацию. Так построен тетраэдрический диамагнитный комплекс тетракарбонилникель [Ni(CO)4] (КЧ = 4), который характеризуется значительной устойчивостью. Если комплексообразователем служит никель(II) с электронной конфигурацией [Ar]3 d 84 s 0 4 p 0, то надобность в перемещении электронов с 4 s -подуровня перед гибридизацией отпадает, так как для реализации координационного числа 4 имеется достаточное число вакантных орбиталей: Такое строение имеет неустойчивый парамагнитный комплекс тетрабромоникколат(II)-ион [NiBr4]2-. Однако при объединении двух электронов 3 d -подуровня в пару и превращении одной из квантовых ячеек этого подуровня в вакантную меняется и тип гибридизации, и характеристика получаемого комплекса: Тип гибридизации dsp 2 и плоскоквадратная форма комплекса реализуются при образовании устойчивого диамагнитного комплекса тетрацианоникколат(II)-иона [Ni(CN)4]2- (КЧ = 4): Если синтез цианидного комплекса вести в условиях избытка лиганда, можно реализовать координационное число 5 sp 3 d(х2-у2):
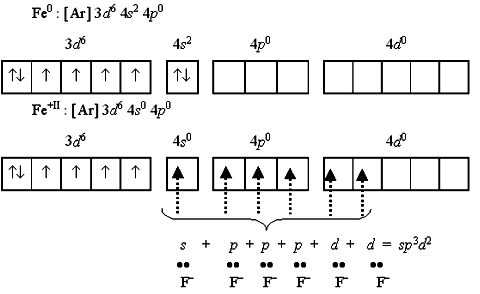
Октаэдрический комплекс никеля(II) [Ni(H2O)6]2+, хотя и парамагнитен, но достаточно устойчив. Его образование обусловлено sp 3 d 2-гибридизацией атомных орбиталей никеля: Если в гибридизации участвуют атомные орбитали внешнего d -подуровня, комплекс, как правило, в значительной степени парамагнитен и называется внешнеорбитальным или высокоспиновым. Строение таких комплексов может отвечать типу гибридизации n sp 3 d 2. Например: [СоF6]3- (4 sp 3 d 2). Так, при рассмотрении комплексов железа(II) обнаруживаются и внешнеорбитальные, и внутриорбитальные комплексы:
В парамагнитном, высокоспиновом, внешнеорбитальном гексафтороферрат(II)-ионе [FeF6]-4 тип гибридизации 4 sp 3 d 2. В диамагнитном, низкоспиновом, внутриорбитальные гексацианоферрат(II)-ионе [Fe(CN)6]-4 - 3 d 24 sp 3. Сама по себе теория валентных связей не дает однозначного ответа на вопрос, какой вид комплекса образуется в каждом конкретном случае, так как этот метод не учитывает влияния природы лиганда. Чаще в конкретном случае зная состав можно предположить несколько типов гибридизации и пространственного строения комплексной частицы. Поэтому метод валентных связей должен обязательно дополняться данными о магнитных свойствах комплекса либо сведениями о влиянии лиганда на характер образующегося комплекса. Так, для вышеупомянутых комплексов [NiBr4]2-, [Ni(CO)4] и [Ni(CN)4]2- выбор dsp 2 и sp 3 типами гибридизации можно сделать на основании данных об их магнитных свойствах. А для диамагнитного комплекса [Ni(CN)5]3- возможны два типа гибридизации и пространственного строения: sp 3 d(х2-у2) (квадратная пирамида) и sp 3 d (z 2) (триганальная бипирамида). Выбор между двумя вариантами можно сделать в результате изучения пространственного строения комплекса методом рентено-структурного анализа. Метод рентгено-структурного анализа основан на изучении диффракции рентгеновского излучения на атомах кристаллов веществ позволяет определить пространственное расположение атомов в кристалле.
|
||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 589; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.19.115 (0.006 с.) |