
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Меняется рН раствора, называется гидролизом.Содержание книги
Поиск на нашем сайте
Гидролиз – буквальный перевод: разложение водой. Слово происходит от греческого hudor- вода и lysis – разложение. Если катионы и анионы соли имеют небольшие заряды и довольно боль- шие радиусы, то их влияние на молекулы воды невелико, и гидролиза практи- чески не происходит. Это относится к таким катионам, как K+, Ca2+, Rb+, Ba2+, и анионам: Cl-, NO3-, SO42-. То есть соли, составленные из этих ионов (сильных ки- слот и сильных оснований), гидролизу подвергаться не будут, и рН этих рас- творов будет равно или близко к семи (рН ≈ 7). Различают еще три возможных варианта взаимодействия воды с солями, если: 1─ соль образована сильным основанием и слабой кислотой; 2 – соль образована сильной кислотой и слабым основанием; 3 – соль образована слабой кислотой и слабым основанием. В первом случае катионы соли обладают малой акцепторной активностью в сравнении с анионами, которые выступают с явно выраженными донорными свойствами по отношению к воде. Примером может служить процесс взаимо- действия нитрита калия KNO2 с водой, который можно представить следующим молекулярным уравнением, которое соответствует реакции обратной реакции нейтрализации: KNO2 + HOН ↔ KOH + HNO2. Или в ионно-молекулярной форме: K+ + NO2- + HOН ↔ K+ + OH- + HNO2. После сокращения получим: NO2- + HOH ↔ OH- + HNO2. Из сокращенного ионного уравнения явно видно, что ионы водорода воды свя- зываются в малодиссоциирующие молекулы азотистой кислоты HNO2, и в рас- творе преобладают ионы гидроксила. Следовательно, раствор этой соли в воде имеет щелочную реакцию (рН > 7). Напомним, что при написании реакций в ионной форме слабые электролиты или малодиссоциирующие вещества изображают в недиссоциированном виде. Если в воде растворяются соли многоосновных кислот (например, К2СО3), то гидролиз протекает ступенчато. В начале анионы соли (в частности, карбонат –анион СО32-) присоединяют по одному иону водорода, образуя слабодиссоции- рующие кислые анионы: первая ступень СО32- + НOН ↔ OH- + HCO3-. Или в молекулярной форме: К2СО3 + НОН ↔ КОН + КНСО3. Затем образовавшаяся кислая соль КНСО3 может далее гидролизоваться, присоединяя к кислому аниону еще один ион водорода, что в молекулярно- ионной форме выразится уравнением второй ступени: вторая ступень НСО3- + НOH ↔ OH- + H2CO3. Или в молекулярной форме: KHCO3 + HOН ↔ KOH + H2CO3. Если гидролиз протекает ступенчато, то идет он в основном по первой ступени. В меньшей мере по второй и ещё в меньшей степени по третьей сту- пени, если таковая имеется. В приведенном примере гидролиза карбоната калия в растворе в основном будут присутствовать ионы НСО3- (наряду с ионами К+ и ОН-), образующиеся по первой ступени гидролиза, и практически будет мало мо- лекул угольной кислоты Н2СО3, как продукта второй ступени. Но если продукты гидролиза каким-нибудь образом удаляются из системы (например, улетучива- ются), то растворенная соль подвергается гидролизу полностью. Так, например, при растворении сульфида калия в воде вследствие образования легколетучего сероводорода H2S по второй ступени и удаления его из раствора, гидролиз соли протекает практически до конца: K2S + 2HOH ↔ 2KOH + H2S↑ или в ионно-молекулярной форме: S2- + 2HOH ↔ 2OH- + H2S↑ Рассмотрим второй случай гидролиза, когда катионы соли взаимодейст- вуют с водой с образованием малодиссоциирующих частиц, а анионы не обра- зуют прочных соединений с ионами водорода. Примером может служить гид- ролиз хлорида меди CuCl2 (соль образована слабым основанием Cu(OH)2 и силь- ной кислотой HCl). Хлорид меди гидролизуется ступенчато, последовательно присоединяя одну гидроксильную группу ОН- по первой ступени и затем вто- рую группу ОН- – по второй. Ионные уравнения соответствующих ступеней следующие:
первая ступень Cu2+ + HOH ↔ [CuOH]+ + H+, вторая ступень [CuOH]+ + HOH ↔ Cu(OH)2 + H+. Молекулярные уравнения этих ступеней: первая ступень CuCl2 + HOН ↔ CuOHCl + HCl, вторая ступень CuOHCl + HOН ↔ Cu(OH)2 + HCl.
Как явно видно из ионных уравнений, в результате взаимодействия ионов соли с ионами воды связываются ионы гидроксила (следовательно, их концен- трация становится меньше), а концентрация ионов водорода соответственно увеличивается. А это означает, что раствор становится кислым (рН < 7). При гидролизе таких солей обычно образуется основная соль и сильная кислота. В случае гидролиза солей, образованных слабыми основаниями и слабы- ми кислотами (третий случай), ионы воды относительно прочно связываются и с катионами, и с анионами соли. В качестве примера рассмотрим гидролиз аце- тата аммония NH4CH3COO (соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4OH): NH4CH3COO + HOН → NH4OH + CH3COOH, или в ионной форме: NH4+ + CH3COO- + HOН → NH4OH + CH3COOH. Реакция среды таких растворов (рН) зависит от соотношения констант диссоциации продуктов гидролиза. Если более сильной кислотой образована соль, то среда будет кислой (рН < 7), если более сильным основанием ― основной (рН > 7). Если константы диссоциации основания и кислоты, образующих соль близки, то растворы солей этого типа имеют или слабокислую, или слабощелочную реакции, т.е. их рН близок к нейтральному значению (рН ≈7). В частности, раствор ацетата аммония имеет рН =7, так как константы диссоциации гидроксида аммония и уксусной кислоты равны. Гидролиз характеризуют степенью гидролиза аг. Это величина, равная отношению числа молекул (или их концентрации Сг), подвергшихся гидролизу, к общему количеству растворенных молекул соли (или их концентрации С): аг = Сг / С. По существу степень гидролиза представляет собой долю молекул, подверг- шихся гидролизу, от общего количества растворенных молекул соли. Повышение температуры раствора соли во всех случаях приводит к уси- лению гидролиза, так как гидролиз ― эндотемический процесс (обратный нейтрализации). Разбавление растворов также смещает равновесие в сторону образования про- дуктов гидролиза. К гидролизу, как к равновесному процессу, можно применить закон дей- ствующих масс. Например, гидролиз ацетата натрия протекает в соответствии с уравнением: NaCH3COO + HOН ↔ NaOH + CH3COOH, или в ионной форме: CH3COO- + H+OH- ↔ OH- + CH3COOH.
Константа равновесия Кр для процесса гидролиза запишется в виде выражения: [CH3COOH] · [OH−] Кр = ——————————, [CH3COO−] · [H2O] или, принимая во внимание, что концентрация воды практически остается по- стоянной величиной,
[CH3COOH] · [OH−] Кр· [H2O] = ——————————. [CH3COO−] Постоянную величину Кр·[H2O] называют константой гидролиза Кг: [CH3COOH] · [OH−] Кг = Кр·[H2O] = —————————. [CH3COO−] Она не зависит от концентрации ионов в растворе, но зависит от температуры и природы веществ раствора. Последнее выражение константы гидролиза можно упростить, если умножить числитель и знаменатель выражения на концентра- цию ионов водорода [H+], тогда получим следующее выражение:
[OH−] · [ H+] ∙ [CH3COOH] Kн2о Кг = —————————————— = —————, [CH3COO- ] · [ H+ ] K дис.кислоты где Kн2о ─ ионное произведение воды, равное [H+]·[OH-]; Кдис. кислоты – константа диссоциации кислоты, равная [CH3COO−] · [ H+] Кдис. кислоты = —————————. [CH3COOH ] По аналогии для гидролиза соли слабого основания и сильной кислоты (напри- мер, NH4Cl) получим: Kн2о Кг = —————————, K дис. основания где Кдис. основания – константа диссоциации основания. Таким образом, зная константы диссоциации слабых электролитов (ки- слоты или основания) и ионное произведение воды, можно рассчитать констан- ты гидролиза соответствующих солей. Степень аг и константа Кг гидролиза связаны между собой для бинарного электролита соотношением (подобным таковому для степени и константы дис- социации):
αГ 2С Кг = ———, 1−αГ где С – концентрация соли, моль/л. Обычно степень гидролиза аг значительно меньше единицы, поэтому приведенное выражение можно упростить:
Кг ≈ аг2 С. Откуда в явном виде степень гидролиза соли равна: аг = Принимая во внимание, что константа гидролиза соли определяется через ионное произведение воды и константы диссоцииации слабых электролитов (основания или кислоты, образующихся при гидролизе), можно степень гидро- лиза представить и в таком виде: аг = Использование вышеприведенных соотношений дает возможность рассчитать и степень гидролиза, и рН раствора соли. Рассмотрим несколько примеров по составлению уравнений реакций гид- ролиза и расчета степени гидролиза и рН растворов. Пример 1. Составьте молекулярные и молекулярно-ионные уравнения гид- ролиза солей: а) нитрата цинка Zn(NO3)2 и б) сульфита калия K2SO3. Решение. а) При растворении в воде кристаллы нитрата цинка диссоции- руют на ионы: Zn(NO3)2 → Zn2+ + 2NO3-.
Образовавшиеся ионы соли будут взаимодействовать с ионами воды. Какие из них могут связать ионы воды (Н+ или ОН-) в малодиссоциирующее соединение, т.е. какие ионы обуславливают гидролиз? Катион Zn2+, как ион заряженный по- ложительно, будет взаимодействовать с отрицательно заряженным ионом гид- роксила ОН- с образованием слабодиссоцирующего катиона [ZnOH]+ слабого основания Zn(OH)2. Анион NO3- с положительно заряженным ионом водорода Н+ образует молекулу сильной кислоты НNO3, которая, следовательно, сразу же обратно распадется на ионы водорода Н+ и NO3- под действием молекул воды. Следовательно, полное молекулярно-ионное уравнение взаимодействия ионов соли с водой можно представить в виде: Zn2+ + 2 NO3- + H+OH- = [ZnOH]+ + H+ + 2 NO3-, или в сокращенном виде: Zn2+ + HOH = [ZnOH]+ + H+. Как видно из уравнения, свободными, несвязанными в растворе остаются ионы водорода Н+, концентрация которых, следовательно, больше, чем гидроксил ионов, а поэтому раствор этой соли имеет кислую реакцию (рН < 7). В молекулярной форме уравнение гидролиза запишется: Zn(NO3)2 + HOН = [ZnOH](NO3) + HNO3. Образовавшаяся основная соль [ZnOH](NO3) подвергается в свою очередь гидролизу с образованием гидроксида цинка Zn(OH)2, но в ничтожно малой сте- пени. А поэтому в растворе практически нет молекул гидроксида цинка Zn(OH)2. б) При растворении кристаллов сульфита калия в воде соль диссоциирует на ионы калия К+ и сульфит иона SO32-: K2SO3 → 2 K+ + SO32-. Катионы К+, взаимодействуя с анионами гидроксила ОН-, могут образо- вать молекулы сильного основания КОН, которые сразу же (практически необ- разовавшись) распадаются на исходные ионы К+ и ОН- под действием молекул воды-растворителя. То есть ионы гидроксила ОН- будут не связанными в мало- диссоциирующее соединение в растворе. Анионы SO32- связывают ионы водорода воды в малодиссоцирующий ани- он [HSO3]- слабой сернистой кислоты Н2SO3 и концентрация их становится меньше. Следовательно, концентрация гидроксил-ионов окажется больше кон- центрации ионов водорода [OH-] > [H+], и реакция среды будет щелочной (рН > 7). Принимая во внимание вышесказанное, молекулярно-ионное уравнение гидролиза запишется так: 2 K+ + SO32- + HOH = 2 K+ + OH- + [HSO3] -.
В молекулярной форме уравнение гидролиза будет выглядеть таким об- разом: K2SO3 + HOH = KOH + KHSO3.
Гидролиз соли К2SO3 практически ограничивается первой ступенью, про- дукты гидролиза ─ кислая соль и сильное основание. Пример 2. Какова константа гидролиза ацетата натрия СН3СООNa, если константа диссоциации уксусной кислоты Кдис.= 1,754 ·10-5. Решение. Константа гидролиза соли сильного основания и слабой кислоты связаны между собой соотношением Кг = Кн2о / Кдис. кислоты, где Кн2о – ионное произведение воды; Кдис. кислоты – константа диссоциации слабой кислоты. Подставляя численные значения констант, находим величину кон- станты гидролиза: Кг = 10-14 / (1,754 ·10-5) = 0,57·10-9. Пример 3. Имеется 0,001 н раствор ацетата калия СН3СООК. Какова степень гидролиза соли и чему равно численное значение рН этого раствора? Решение. Степень гидролиза, концентрация растворенного вещества и константа гидролиза связаны между собой соотношением:
аг = Подставляя численные значения ионного произведения воды Кн2о, концентра- ции соли С и константы диссоциации уксусной кислоты (в результате гидроли-
за образуется слабая уксусная кислота: СН3СООК + Н2О = КОН + СН3СООН), получим: аг = Концентрация гидроксил ионов ОН-, образовавшихся при гидролизе, рав- на концентрации подвергшейся гидролизу соли: [OH-] = aгС = 0,76 ·10-3·0,001 = 0,76·10-6. Концентрация ионов водорода и гидроксила связана между собой ионным про- изведением воды: [H+]·[OH-] = 10-14. Откуда концентрация ионов водорода равна [H+] = 10-14 / [OH-] = 10-14 / (0,75·10-6)= 1,333 ·10-8. Зная концентрацию ионов водорода, можно рассчитать рН раствора: рН = - lg [H+] = - lg 1,333·10-8 = 7,875. Реакция среды – щелочная, что согласуется с уравнением гидролиза этой соли.
Буферные растворы Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NН3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щелочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических исследованиях. Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.). Согласно протонной теории, кислотой называют всякое вещество, молекулярные частицы которого (в том числе и ионы) способны отдавать протон, т.е. быть донором протонов; основанием называют всякое вещество, молекулярные частицы которого (в том числе и ионы) способны присоединять протоны, т.е. быть акцептором протонов. Буферное действие растворов обусловлено наличием кислотно-основного равновесия общего типа:
Воснование + Н+ = ВН+сопряженная кислота
НАкислота = Н+ + А-сопряженное основание
Сопряженные кислотно-основные пары В /ВН+ и А- /НА называют буферными системами. Буферные растворы играют большую роль в жизнедеятельности. К числу исключительных свойств живых организмов относится их способность поддерживать постоянство рН биологических жидкостей, тканей и органов - кислотно-основной гомеостаз. Это постоянство обусловлено наличием нескольких буферных систем, входящих в состав этих тканей. Классификация кислотно-основных буферных систем. Буферные системы могут быть четырех типов: 1) Слабая кислота и ее анион А- /НА: ацетатная буферная система СН3СОО-/СН3СООН в растворе СН3СООNa и СН3СООН, область действия рН 3, 8 - 5, 8. 2) Водород-карбонатная система НСО3-/Н2СО3 в растворе NaНСО3 и Н2СО3, область её действия - рН 5, 4 - 7, 4. 3) Слабое основание и его катион В/ВН+: аммиачная буферная система NH3/NH4+ в растворе NH3 и NH4Cl, область ее действия - рН 8, 2 - 10, 2. 4) Анионы кислой и средней соли или двух кислых солей: карбонатная буферная система СО32- /НСО3- в растворе Na2CO3 и NaHCO3, область ее действия рН 9, 3 - 11, 3. фосфатная буферная система НРО42-/Н2РО4- в растворе Nа2НРО4 и NаН2РО4, область ее действия рН 6, 2 - 8, 2. Эти солевые буферные системы можно отнести к 1-му типу, т. к. одна из солей этих буферных систем выполняет функцию слабой кислоты. Так, в фосфатной буферной системе анион Н2РО4- является слабой кислотой. Ионы и молекулы амфолитов. К ним относят аминокислотные и белковые буферные системы. Если аминокислоты или белки находятся в изоэлектрическом состоянии (ИЭС) (суммарный заряд молекулы равен нулю), то растворы этих соединений не являются буферными. Они начинают проявлять буферное действие, когда к ним добавляют некоторое количество кислоты или щелочи. Тогда часть белка (аминокислоты) переходит из ИЭС в форму “белок-кислота” или соответственно в форму “белок-основание”. Механизм буферного действия можно понять на примере ацетатной буферной системы СН3СОО-/СН3СООН, в основе действия которой лежит кислотно-основное равновесие:
СН3СООН = СН3СОО- + Н+; (рКа = 4,8)
Главный источник ацетат-ионов - сильный электролит СН3СООNa:
СН3СООNa = СН3СОО- + Na+
При добавлении сильной кислоты сопряженное основание СН3СОО- связывает добавочные ионы Н+, превращаясь в слабую уксусную кислоту:
СН3СОО- + Н+ = СН3СООН
(кислотно-основное равновесие смещается влево, по Ле Шателье) Уменьшение концентрации анионов СН3СОО- точно уравновешивается повышение концентрации молекул СН3СООН. В результате происходит небольшое изменение в соотношении концентраций слабой кислоты и ее соли, а следовательно, и незначительно изменяется рН. При добавлении щелочи протоны уксусной кислоты (резервная кислотность) высвобождаются и нейтрализуются добавочные ионы ОН-, связывая их в молекулы воды:
СН3СООН + ОН- = СН3СОО- + Н2О
(кислотно-основное равновесие смещается вправо, по Ле Шателье) В этом случае также происходит небольшое изменение в соотношении концентраций слабой кислоты и ее соли, а следовательно, и незначительное изменение рН. Уменьшение концентрации слабой кислоты СН3СООН точно уравновешивается повышение концентрации анионов СН3СОО-. Таким образом, рассмотренные системы показывают, что буферное действие раствора обусловлено смещением кислотно-основного равновесия за счет связывания добавляемых в раствор ионов Н+ и ОН- в результате реакции этих ионов и компонентов буферной системы с образованием малодиссоциированных продуктов. В основе расчета рН буферных систем лежит закон действующих масс для кислотно-основного равновесия. Для буферной системы 1-го типа, например, ацетатной, концентрацию ионов Н+ в растворе легко вычислит, исходя из константы кислотно-основного равновесия уксусной кислоты:
СН3СООН ↔СН3СОО- + Н+; (рКа = 4,8)
[Н+] ∙ [СН3СОО-] Ка = ———————— (1). [СН3СООН]
Из уравнения (1) следует, что концентрация водород-ионов равна
[Н+] = Ка ∙ [СН3СООН] / [СН3СОО-] (2)
В присутствии второго компонента буферного раствора - сильного электролита СН3СООNa кислотно-основное равновесие уксусной кислоты СН3СООН сдвинуто влево (принцип Ле Шателье). Поэтому концентрация недиссоциированных молекул СН3СООН практически равна концентрации кислоты, а концентрация ионов СН3СОО- ― концентрации соли. В таком случае уравнение (2) принимает следующий вид:
[Н+] = Ка ∙ [кислота]/ [соль] (3)
где с (кислота) и с (соль) - равновесные концентрации кислоты и соли. Логарифмированием обеих частей уравнения (3) получают уравнение Гендерсона-Гассельбаха для буферных систем 1-го типа:
рН = - lgКа – lg([кислота]/[соль]) = рКа + lg [соль] – lg [кислота] (4)
В общем случае уравнение Гендерсона-Гассельбаха для буферных систем 1-го типа:
рН = рКа + lg([сопряженное основание]/[сопряженная кислота])
Аналогичным образом можно показать, что для основной (например, аммиачной) буферной системы рН вычисляется по уравнению:
рН = 14 – рКв + lg[основание] - lg[соль]. Уравнение Гендерсона-Гассельбаха позволяет сформулировать ряд важных выводов:
1. рН буферных растворов зависит от отрицательного действия логарифма константы диссоциации слабой кислоты рКа или основания рКв и от отношения концентраций компонентов КО-пары, но практически не зависит от разбавления раствора водой. Следует отметить, что постоянство рН хорошо выполняется при малых концентрациях буферных растворов. При концентрациях компонентов выше 0, 1 моль/ л необходимо учитывать коэффициенты активности ионов системы.
2. Значение рКа любой кислоты и рКв любого основания можно вычислить по измеренному рН раствора, если известны молярные концентрации компонентов. Кроме того, уравнение Гендерсона-Гассельбаха позволяет рассчитать рН буферного раствора, если известны значения рКа и молярные концентрации компонентов.
3. Уравнение Гендерсона-Гассельбаха можно использовать и для того, чтобы узнать, в каком соотношении нужно взят компоненты буферной смеси, чтобы приготовить раствор с заданным значением рН. Способность буферного раствора сохранять рН по мере прибавления сильной кислоты или приблизительно на постоянном уровне далеко небеспредельна и ограничена величиной так называемой буферной емкости В. За единицу буферной емкости обычно принимают емкость такого буферного раствора, для изменения рН которого на единицу требуется введение сильной кислоты или щелочи в количестве 1 моль эквивалента на 1л раствора. Т. е. это величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении сильных кислот или сильных оснований.
|
||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 305; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.134.77 (0.01 с.) |

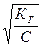 .
.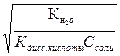 или аг =
или аг = 
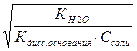 .
.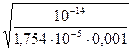 = 0,76 ⋅ 10 −3.
= 0,76 ⋅ 10 −3.


