
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Структурная организация секреторного процессаСодержание книги
Поиск на нашем сайте Секретообразование тесно связано с функционированием секреторных клеток альвеолярного эпителия и их структурных компонентов. Наиболее важные звенья в цепи клеточных процессов, обеспечивающих образование и выделение из клетки секреторно- го продукта, следующие: а) синтез различных типов РНК (рРНК, мРНК, тРНК), обусловленный генетической информацией, содержащейся в ядре; б) участие мРНК и тРНК в синтезе белка на рибосомах (полисомах); в) деятельность структур эндоплазма™ -ческого ретикулума в сегрегации и перемещении секреторного продукта; г) концентрация и «упаковка» секреторного продукта структурами комплекса Гольджи. Понятие «организация секреторного процесса» включает и строгую регламентацию секретообразования. Многообразные процессы синтеза и преформирования первичных и промежуточных форм секреторного продукта строго локализованы и проходят в определенные промежутки времени. Эта пространственно-временная последовательность обязательно укладывается в рамки секреторного цикла. Весьма важной особенностью многих клеток является изменение их морфологических параметров на всех его этапах. Методы электронной микроскопии и авторадиография, а также цитофизиологические наблюдения в ходе прижизненного исследования позволили выявить конкретные этапы секреторного цикла: 1) поступление веществ — предшественников секрета в тело клетки; 2) синтез первичного секрета; 3) внутриклеточный транспорт, дальнейшая обработка и накопление секреторного продукта; 4) удаление из клетки, выведение секрета (экструзия). Таким образом, секреторный цикл — это последовательное прохождение клеткой стадий метаболических и структурных перестроек, обеспечивающих полное превращение секреторного продукта от поступления веществ-предшественников до вывода из тела клетки готового сформированного продукта секреции. Изменения, происходящие в секреторном эпителии при интенсификации секреции, указывают на то, что некоторые процессы приходятся на начало секреторного цикла — активация ядерного аппарата совпадает с интенсификацией транспортных процессов. На первых этапах секреторного цикла, сразу после удаления ранее синтезированного секрета, происходит значительное увеличение объема секреторных клеток и изменение их формы от уплощенной к цилиндрической; при одновременной интенсификации транспортных и синтетических процессов меняется биоэлектрическая активность клетки: Функциональное набухание обусловлено быстрым поступлением в клетку осмотически активных веществ — глюкозы, аминокислот и электролитов. Удлинение эпителиальных клеток связано с сократительной активностью внутриклеточных цитоскелетных структур: разрушение их с помощью колхицина предупреждает изменение формы клеток. На начальных стадиях секреторного цикла в несколько раз усиливается активность таких транспортных ферментов, как, например, щелочная фосфатаза. С увеличением объема цитоплазмы секреторной клетки совпадает повышение уровня содержания РНК. Новообразование РНК и транспорт ее в цитоплазму вызва-
В ходе секреторного цикла на полисомах, расположенных на поверхности каналов эндоплазматического ретикулума, происходит синтез пептидных цепей. В полисоме на одну молекулу мРНК приходится несколько рибосом; образование полисомных комплексов обеспечивает наиболее эффективное использование мРНК. Пройдя через одну и ту же серию кодонов мРНК, рибосомы синтезируют однотипный белок. На рибосомах синтез белка осуществляется за 2...3 мин, в течение следующих 10 мин меченые аминокислоты обнаруживаются в составе пептидной или белковой молекулы в просвете каналов эндоплазматического ретикулума. В клетках молочной железы эндоплазматический ретикулум участвует и в синтезе молочного жира. Затем секреторный продукт поступает в комплекс Гольджи, где полипептидные цепи формируют мицеллы казеина за счет образования фосфатных и кальциевых связей. Структуры комплекса Гольджи осуществляют еще одну функцию секреторной клетки — синтез молочного сахара (лактозы). Лактоза, сформированная за время прохождения компонентов комплекса Гольджи, по цитоплазме вместе с гранулами казеина переходит в полость альвеолы при опорожнении везикул. Очевидно, это наиболее удачный путь выхода молочного сахара из клетки, поскольку лактоза неспособна проникать через клеточную мембрану. Располагающийся в конденсирующих везикулах комплекса Гольджи секреторный продукт, состоящий из казеина и лактозы, а также липидные глобулы для выведения из клетки перемещаются в ее апикальную зону. Это направленное перемещение связано с электрической поляризацией клеток альвеолярного эпителия: внутриклеточные везикулы перемещаются к положительному полюсу клетки. При действии физиологически активных веществ, усиливающих выделение секрета из клеток, развивается гиперполяризация клеточной мембраны, усиливающая степень поляризации клетки. Вместе с этим в процессах выведения секрета за пределы секреторной клетки, несомненно, участвуют сократительные элементы: ци-тоскелета при обработке молочной железы колхицином, веществом, разрушающим микротрубочки, экструзия прекращается. Электронномикроскопическое исследование секреторных клеток позволяет детализировать процесс удаления секрета. Крупная жировая капля (глобула) приближается к апикальной мембране и облекается ею. По мере увеличения контакта с плазматической мембраной капля все больше выступает в просвет альвеолы. Огибая жировую каплю, плазматическая мембрана сужается у основания и перешнуровывается, а затем отрывается и попадает в по- лость альвеолы. Выведение из клетки белка и лактозы происходит иначе: заключенные в мембраны конденсирующие вакуоли подходят к апикальной мембране. Мембрана вакуоли соединяется с плазматической мембраной, затем полость вакуоли полностью раскрывается и ее содержимое опорожняется в просвет альвеолы. Заметим, что плазматическая мембрана после того, как ее часть пошла на покрытие молочного жирового шарика, восстанавливается за счет расправления на апикальной ее поверхности стенки везикулы, приносящей белковые секреторные гранулы. Следует подчеркнуть, что декапитация и, следовательно, апокриновый тип секреции в молочной железе не происходит. Белок выходит из клетки по мер-окриновому типу, а для удаления жира используется леммокрино-вый (лат. lemma — оболочка) принцип экструзии. Альвеола — структурно-функциональная единица молочной железы. Как показали исследования на культивированных изолированных клетках молочной железы, уровень их секреции оказывается значительно ниже, чем в клеточном сообществе. То есть для сохранения секреторной функции железистых органов и, в частности, молочной железы, необходима целостность клеточного комплекса как функциональной единицы. Для большинства экзокринных желез, включая молочную, такой «неделимой» единицей является альвеола или ацинус. При анализе принципов объединения клеток в альвеолярном комплексе наиболее важными являются межклеточное взаимодействие и последовательность развития реакций в отдельных компонентах клеточного ансамбля. Взаимодействие между секреторными клетками обусловлено функционированием межклеточных контактов, расположенных на сопредельных поверхностях клеток. При внутриклеточной инъекции флюоресцентной метки в одну из клеток альвеолы уже через 10...15 мин флуорохром обнаруживается в 2...3 расположенных рядом клетках, что свидетельствует о существовании межклеточного обмена крупными молекулами. При развитии физиологических реакций альвеолы первыми реагируют (около 25 % клеток), и только затем через 10... 15 мин в реакцию вовлекаются остальные клетки. Система высокопроницаемых контактов объединяет клетки в функциональный синцитий при сохранении клеточной обособленности. При повреждении соседних клеток оставшиеся целыми клетки «отключают» высоко-проницаемые контакты и распространение информации по альвеоле прекращается. Барьерные свойства секреторного эпителия формируются за счет наличия специального замыкательного комплекса плотного контакта, расположенного на границе между апикальной и латеральной зонами клеточной мембраны. Через альвеолярный барьер i ie проникают специальные вещества (пероксидаза и флуоресцеин натрия). Все вещества, попадающие в просвет альвеолы, обязательно должны пройти через секреторную клетку.
Взаимодействие между миоэпителиальными и секреторными Сокращение миоэпителиальных клеток развива- > ется при действии окситоцина и ацетилхолина, причем клетки об- \ ладают самостоятельными окситоциновыми и холинорецептора- i ми. Атропин не прекращает сократительной реакции альвеолы, а совместный эффект действия ацетилхолина и окситоцина оказывается сильнее, чем каждого из них в отдельности. Существенное изменение сократительной активности миоэпителия наступает под влиянием катехоламинов, блокирующих сокращения альвеол в ответ на действие окситоцина. Подавление сокращений миоэпи-телиальной клетки связано с реакцией Р-адренорецепторов, предотвращающих последующую сократительную активность. Сокращения миоэпителия развиваются при деполяризации мембраны, в том числе и под действием электрического тока с длительностью импульса не менее 350 мс. Сократительный аппарат миоэпителиальных клеток аналоги- < чен таковому у клеток гладкой мускулатуры и представлен мио-фибриллами, заполняющими тело и отростки клеток. Каждая мио-фибрилла построена из ориентированных в продольном направлении миофиламент толщиной от 50 до 80 нм. Обнаруживается
Рис. 10.2. Схема межклеточных взаимоотношений в альвеолах молочной железы: МЭП— миоэпителиальная клетка; ЯГ—секреторная клетка; ПА — полость альвеолы; К— капилляр; В —везикулы; ЖК— жировая клетка; ФБ — фибробласт; НВ — нервы центральная линия прикрепления — аналог Z-мембраны. Наряду с аналогом Z-мембраны выявлены электронноплотные и элект-роннопрозрачные участки, подобные дискам А и I. Соединенные друг с другом и с Z-мембраной миофиламенты заполняют пространство отростков миоэпителиальных клеток, причем в месте прикрепления к плазматической мембране увеличена электронная плотность хемидесмосома. Сокращения миоэпителия связаны с повышением концентрации кальция внутри клетки. Обнаружено два места депонирования ионизированного кальция — это каналы эндоплазматического ретикулума и примембранные везикулярные структуры. При действии окситоцина и развитии сокращения миоэпителиальной клетки ионизированный кальций обнаруживается в пространстве между миофиламентами. Кровоснабжение альвеол существенно меняется в ходе секреторного цикла, причем расширение микрососудов и раскрытие дополнительных капилляров обеспечивают рабочую гиперемию органа. Регистрация кровенаполнения сосудов, окружающих альвеолу, позволяет обнаружить наличие двухфазной реакции кратковременной вазоконстрикции (сужения сосудов), обусловленной действием окситоцина (структурного аналога вазопрессина) и длительной вазодилятацией (расширением сосудов). Интенсивность секретообразования тесно связана с полноценным кровоснабжением органа: объемный кровоток значительно возрастает при становлении лактации и увеличении молочной продуктивности в лактационный период. Нарушение образования
РЕГУЛЯЦИЯ СЕКРЕЦИИ МОЛОКА В регуляции секреторных процессов сразу же после родов и в период установившейся лактации принимают участие разнообразные, тесно связанные между собой регуляторные механизмы. Данные многочисленных исследований, проведенных на целостном организме, изолированной молочной железе и на клеточном уровне, указывают, что в регуляции деятельности железистого эпителия принимает участие нервная и эндокринная системы. Афферентная импульсация обусловлена наличием богатого рецепторного аппарата; в молочной железе широко представлены механо-, термо- и хеморецепторы. Раздражение рецепторов молочной железы при доении или сосании приводит к вьщелению в кровь окситоцина, пролактина и других лактогенных гормонов. При перерезке афферентных нервов на уровне дорсальных корешков наблюдается прекращение лактации, если детеныши подпускались только к деафферентированной (денервирован-ной) молочной железе, но если же их подпускали к соскам ин-тактных желез, лактация продолжалась на прежнем уровне. Интенсивная электростимуляция центрального участка перерезанного нерва приводит к интенсификации секреторного процесса. Возникшая в рецепторах молочной железы афферентная импульсация поступает в спинной мозг, где формируется короткая рефлекторная дуга, развивается взаимодействие чувствительного и эффекторного нейронов, вследствие чего осуществляется так называемый сегментарный рефлекс на молочную железу. Вместе с этим афферентные импульсы доходят до продолговатого мозга и гипоталамуса по проводящей системе спинного мозга, дорсальному продольному пучку и спиноталамическим путям. Афференты молочной железы широко представлены в гипоталамических структурах, которые ответственны за продукцию рилизинг-факторов (либеринов) и ингибирующих факторов (статинов), определяющих продукцию лактогенных гормонов. От гипоталамуса возбуждение поступает к коре больших полушарий, где и формируется общность нервных центров, осуществляющих контроль за интенсивностью лактационного процесса, и создается особое состояние организма, названное «лактационной доминантой». Уровень пролактина в плазме крови коров быстро возрастает перед дойкой (в течении 1 мин), в конце и после ее окончания, что свидетельствует о рефлекторной регуляции секреции и выходе пролактина в кровь. Колебания уровня секреции пролактина в адено-гипофизе обусловлены противоположно действующими влияниями пролактин-рилизинг-фактора (PRF), образующегося в срединном возвышении, и пролактин-ингибирующего фактора (PIF), вырабатываемого в преоптической области. По своей химической природе PIF является допамином; его продукция снижается при фармакологическом нарушении синтеза катехоламинов под действием резерпина и его аналогов. Тормозящее влияние на продукцию пролактина оказывают некоторые гипоталамические структуры; медиальная базальная область бугра, аркуатное ядро, ядра вентромедиального гипоталамуса. Электролитическое разрушение этих структур обусловливает повышение выделения пролоатина, усиление и продление лактации. Регуляция секреции и выделения других лактогенных гормонов также тесно связана с гипоталамусом. В частности, соматотроп-ный гормон (СТГ) принимает активное участие в регуляции секреторного процесса и введение его в оптимальных дозах не только увеличивает молокоотдачу, но и повышает абсолютное содержание в нем жира, белка и лактозы. Нарушение продукции СТГ при разрушении передней гипоталамической области связано с прекращением выделения СТГ-рилизинг-фактора (GRF). Аналогичная ситуация наблюдается и при повреждении задней части срединного возвышения и паравентрикулярного ядра. Электрическая стимуляция вентромедиального ядра гипоталамуса приводит к повышению содержания в крови СТГ в 2... 12 раз. К лакто-генным гормонам можно отнести и АКТГ: его совместное действие с СТГ и пролактином создает максимальный эффект и молочная продуктивность возрастает на 147 %. Галактопоэтический эффект тиреотропного гормона (ТТГ) проявляется в основном на спаде лактации и связан с увеличением в крови уровня тиреоид-ных гормонов. Тироксин и трийодтиронин вызывают мобилизацию жира из жировых депо, способствуют поглощению из крови жирных кислот и аминокислот, активируют микробные процессы в рубце и за счет увеличения продукции ацетата обеспечивают повышенное образование молочного жира. Влияние инсулина на секреторный процесс тесно связано с активацией переноса Сахаров и аминокислот через клеточные мембраны, что сказывается на скорости и характере секреторных процессов в молочной железе. Инсулин также участвует в организации депонирования углеводов и жиров, что обеспечивает надежное снабжение молочной железы метаболитами в промежутках между,приемами корма. Роль околощитовидных желез в обеспечении кальцием активно секретирующей молочной железы ярко проявляется при их удалении — наступает резкое угнетение лакта-
ции. Гормоны коры надпочечников существенно влияют на процесс лактации. Известны данные о снижении молочной продуктивности у коров при введении им АКТГ, хотя у многих других видов животных они оказывают стимулирующее действие, что связывают с интенсификацией углеводного обмена и за счет транспорта электролитов. Гормоны половых желез оказывают заметное влияние на течение секреторного процесса в молочной железе: небольшие дозы эстрогенов повышают продукцию жира, но значительное их увеличение, сопоставимое с уровнем во время эструса, серьезно тормозит секрецию молока. Таким образом, эндокринная система активно участвует в регуляции лактационного процесса, причем важно подчеркнуть, что лактогенная функция желез внутренней секреции осуществляется в тесном взаимодействии с нервной системой и ее подавленное состояние — эмоциональное напряжение, адаптация к различного рода стрессорам может приводить к снижению гормонопоэза и молочной продуктивности. ВЫВЕДЕНИЕ МОЛОКА Молокоотдача осуществляется не спонтанно, а лишь при наличии определенных специфических воздействий на молочную железу — сосания или доения. Секреция компонентов молока в альвеолярном эпителии проходит циклические фазы секреторного цикла (транспорт предшественников, синтез секторного продукта и его выведение за пределы клетки), завершается в течение 55...70 мин. За время между сосанием или доением в секреторном эпителии может осуществляться несколько секреторных циклов, но при накоплении избыточных количеств молока в альвеолярном эпителии происходит торможение секреторного процесса. Естественным стимулом для начала нового секреторного цикла является удаление ранее синтезированного молока, которое заполняет емкостную систему органа: полости альвеол, протоки, молочную цистерну и цистерну соска. Рефлекс выведения молока сложный акт, включающий изменение тонуса гладкой мускулатуры протоков и цистерны молочной железы, сокращение миоэпителиаль-ных клеток альвеол, изменение тонуса кровеносных сосудов и, наконец, расслабление сфинктеров соска. Принято разделять молоко, находящееся в емкостной системе органа, на цистернальную и альвеолярную порции. Альвеолярная порция секрета заполняет полость альвеол и мелких межальвеолярных протоков и составляет от 25 до 48 % разового удоя. К моменту доения в цистерне содержится около 25 % удоя, но при полноценной преддоильной подготовке (массаж, обмывание вымени) основная масса молока (85...97 %) скапливается в цистерне. Это достаточно условное разделение удоя необходимо для описания фаз рефлекса выведения молока: нервной и нервно-гуморальной. Нервная фаза рефлекса связана с раздражением рецепторов молочной железы при сосании или доении. В результате замыкания рефлекторной дуги происходит расслабление соскового сфинктера и сокращение гладкой мускулатуры протоков и цистерны. В эту фазу выделяется цистернальная порция молока. Первая фаза рефлекса возникает непосредственно вслед за механическим раздражением рецепторов железы (через 2...6 с) и продолжается первые 25...30 с. Нейрогуморальная фаза рефлекса является продолжением первой и связана с освобождением окситоцина из ней-рогипофиза, который с током крови поступает к молочной железе и вызывает сокращение миоэпителиальных клеток альвеол. Раздражение рецепторов сосков обеспечивает мощной поток афферентной импульсации, которая по нервам молочной железы (наружный семенной, подвздошно-подчревный, подвздошно-паховый и промежностный) и дорсальным корешкам передается в спинной мозг. Проводящие пути спинного мозга (латеральные и вентральные столбы) проводят импульсацию в вышележащие отделы нервной системы. Молоковыделительные ответы регистрируются в четверохолмии и центральном сером веществе среднего мозга. На уровне вентромедиального коленчатого тела афферентный путь раздваивается: дорсальный пучок достигает гипофи-зарной ножки, ядер медиального и дорсального гипоталамуса, а вентральный путь включает субталамус, латеральный гипоталамус. В межуточном мозгу молоковыделительные ответы наблюдали при раздражении вентрального таламуса, латеральной, дорсальной и передней области гипоталамуса, дорсо- и вентромедиального, супраоптического и паравентрикулярных ядер. Выделение окситоцина из нейрогипофиза предопределяется синтезом его в крупноклеточных ядрах гипоталамуса (супраопти-ческом и паравентрикулярном) и транспортом по супраоптико-гипофизарному тракту. Перемещающийся по аксонам нейросе-креторных нейронов окситоцин в сопровождении белка-носителя нейрофизина достигает аксовазальных синапсов, обеспечивающих попадание его в кровеносное русло. С током крови окситоцин достигает молочной железы и взаимодействует со специфическими окситоциновыми рецепторами миоэпителиальных клеток. Сокращение миоэпителия обеспечивает переход молока в молочные протоки и далее в цистерну. Латентный период второй фазы рефлекса длится 25...50 с, а процесс выделения молока — несколько минут. Наряду с удалением ранее синтезированного молока в ходе этой фазы рефлекса за счет миоэпителиально-секреторного взаимодействия начинается новый секреторный цикл в железистых клетках альвеолы. Накоплен значительный фактический материал, свидетельствующий о наличии условно-рефлекторного механизма выделения молока. Такие условные раздражители, как приход доярки,
Любые нарушения стереотипа содержания коров снижают молочную продуктивность, что связано с развитием эмоционального возбуждения и стрессорного состояния. Как следствие этого часто наблюдается торможение рефлекса молоковыведения: либо полное (не удается выдоить молоко, особенно из альвеолярного отдела), либо частичное (замедляется вьщеление молока, увеличивается латентный период рефлекса молоковыведения, в вымени остается большее количество остаточного молока). В основном торможение рефлекса выведения молока реализуется через гипоталамо-гипофизарную систему: увеличение выброса в кровоток катехол-г аминов из мозгового вещества надпочечника и усиление тонуса симпатической нервной системы существенно нарушают нейро-секреторную активность супраоптического и паравентрикулярно-го ядер гипоталамуса. Кроме того, присутствие катехоламинов в нейрогипофизе блокирует вьщеление ранее синтезированного окситоцина. Следует учитывать и то, что повышение фона катехоламинов крайне неблагоприятно для секреции других лактогенных гормонов. Например, пролактостатин (PIF) по своей химической природе относится к катехоламинам; допамин — физиологически активный предшественник адреналина. Под влиянием катехоламинов происходит усиление тонуса соскового сфинктера, сужение его канала и спазм устьев протоков, что препятствует выделению молока. Особенно важным проявле- нием влияния катехоламинов является их взаимодействие с (3-ад-ренорецепторами мембраны миоэпителиальных клеток. В результате адренергического воздействия наступает блокада сокращений миоэпителиальных клеток, выведение молока из полости альвеол прекращается и развивается лактостаз. Выключение миоэпителия из взаимодействия клеток в альвеолярном клеточном сообществе приводит к неполноценной стимуляции секреторных клеток и нарушению продукции молока. Большое влияние на выведение молока имеют типологические особенности нервной системы животных. Экспериментально установлены различия в кортикальной регуляции выведения молока в зависимости от характеристики высшей нервной деятельности: силы, подвижности и уравновешенности нервных процессов. Для промышленного молочного животноводства наиболее предпочтительны коровы сильного уравновешенного подвижного типа, для которых характерно быстрое образование условных рефлексов. Наиболее сильное торможение условного рефлекса выведения молока и последующее снижение продуктивности присуще коровам сильного уравновешенного инертного типа. Животные сильного неуравновешенного типа обычно тормозят рефлекс выведения молока в меньшей степени.
|
||
|
Последнее изменение этой страницы: 2016-12-16; просмотров: 563; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.055 с.) |

 ны, в свою очередь, активацией генома клетки. Интенсификация транскрипционной активности хроматина проявляется в повышении содержания деконденсированного хроматина и усилении связывания флюоресцентных индикаторов, указывающих на дерепрессию определенных участков генома.
ны, в свою очередь, активацией генома клетки. Интенсификация транскрипционной активности хроматина проявляется в повышении содержания деконденсированного хроматина и усилении связывания флюоресцентных индикаторов, указывающих на дерепрессию определенных участков генома.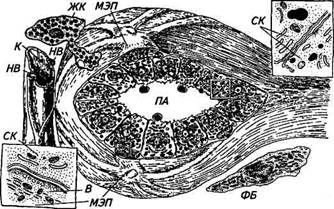

 молока при гипогалактии обычно связано и с отклонениями в гемодинамике. По данным реологического исследования, существенно снижается амплитуда пульсовой волны, сглаживаются ка-такрота и анакрота, что указывает на спазм микрососудов молочной железы. Вместе с этим падение молочной продуктивности сопровождается снижением кожной температуры молочной железы наО,5...1,5°С.
молока при гипогалактии обычно связано и с отклонениями в гемодинамике. По данным реологического исследования, существенно снижается амплитуда пульсовой волны, сглаживаются ка-такрота и анакрота, что указывает на спазм микрососудов молочной железы. Вместе с этим падение молочной продуктивности сопровождается снижением кожной температуры молочной железы наО,5...1,5°С. определенные звуки, запахи, свет, помещение, массаж, обмывание и вытирание вымени, подкормка животных играют роль положительных стимулов и способствуют выработке динамического стереотипа. При установлении устойчивых ассоциативных связей ускоряются рефлекторные реакции, стимулируется полноценное выделение окситоцина и одновременная секреция лактогенных гормонов. Рассматривая проявления сохранения стереотипа для поддержания высокой продуктивности, необходимо учитывать, что в своих многогранных связях с окружающей средой любой организм подвергается бесчисленным воздействиям различных по качеству и интенсивности раздражителей. При значительном по интенсивности или длительности воздействии и наличии специфической реакции на этот раздражитель в организме развивается ряд общих реакций, носящих стереотипный характер. Комплекс неспецифических изменений, возникающих под воздействием внешних раздражителей, стремящихся вывести биологическую систему из равновесия и нарушить гомеостаз, называют общим адаптационным синдромом, или стресс-реакцией (см. главу 11). При затяжном состоянии стресса, вызванного действием неблагоприятных факторов, адаптационные возможности организма снижаются и в результате длительного и интенсивного влияния катехоламинов и глюкокортикоидов могут развиваться многообразные стрессорные повреждения, что, естественно, существенно снижает продуктивность.
определенные звуки, запахи, свет, помещение, массаж, обмывание и вытирание вымени, подкормка животных играют роль положительных стимулов и способствуют выработке динамического стереотипа. При установлении устойчивых ассоциативных связей ускоряются рефлекторные реакции, стимулируется полноценное выделение окситоцина и одновременная секреция лактогенных гормонов. Рассматривая проявления сохранения стереотипа для поддержания высокой продуктивности, необходимо учитывать, что в своих многогранных связях с окружающей средой любой организм подвергается бесчисленным воздействиям различных по качеству и интенсивности раздражителей. При значительном по интенсивности или длительности воздействии и наличии специфической реакции на этот раздражитель в организме развивается ряд общих реакций, носящих стереотипный характер. Комплекс неспецифических изменений, возникающих под воздействием внешних раздражителей, стремящихся вывести биологическую систему из равновесия и нарушить гомеостаз, называют общим адаптационным синдромом, или стресс-реакцией (см. главу 11). При затяжном состоянии стресса, вызванного действием неблагоприятных факторов, адаптационные возможности организма снижаются и в результате длительного и интенсивного влияния катехоламинов и глюкокортикоидов могут развиваться многообразные стрессорные повреждения, что, естественно, существенно снижает продуктивность.


