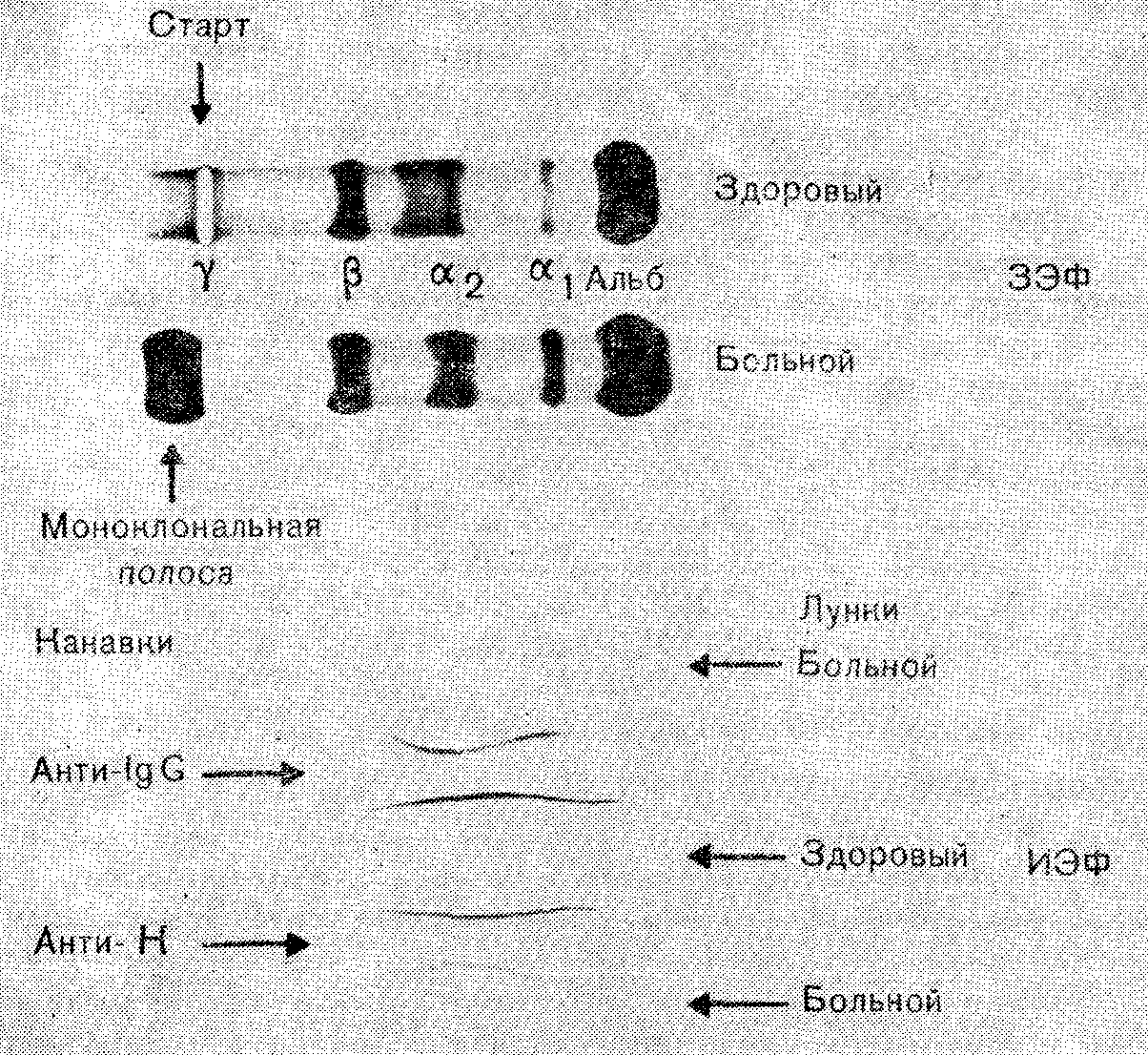Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Костные поражения и рентгенологические измененияСодержание книги
Поиск на нашем сайте
Костные поражения к моменту появления клинических симптомов обнаруживаются очень часто. По данным рентгенологических исследований, костная ткань поражается в 80 % случаев [Kyle, 1975; Bataille et al., 1982]. Изменения костей проявляется в виде генерализованного остеопороза, единичных или множественных очагов остеолиза, патологических переломов, нередко повреждения захватывают окружающие мягкие ткани. Переломы могут быть следствием самой незначительной травмы. Особенно часты патологические компрессионные переломы и сдавления тел позвонков. В большинстве случаев реакция остеобластов отсутствует, с чем связано появление ограниченных перфорационных зон деминерализации без маргинального склероза. Чаще всего поражаются (и поэтому должны быть предметом самого тщательного исследования) кости черепа, таза, а также ребра и позвонки. Иногда бывает трудно отличить изменения костей черепа от венозных синусов. Считается, что отростки позвонков при миеломе, в отличие от других метастатических процессов в костях, повреждаются редко. Поражение нижней челюсти может быть причиной ее перелома во время еды. В ряде работ сравнивали относительную ценность для диагностики рентгенологических методов и сцинтиграфии костей скелета (с использованием 99mТс-пирофосфата или 99mТс-метилендифосфата) [Kyle, 1975; Bataille et al., 1982; Luidwig et al,, 1982]. В большинстве случаев более информативными были рентгенологические методы, при этом в 44 % случаев результаты обоих методов совпадали, в 38 % положительные данные были получены только при рентгенографии и в 18%—только при сцинтиграфии [Bataille et al., 1982]. При достижении ремиссии сцинтиграфические изменения подвергались обратному развитию у 90 % больных, тогда как обратное развитие рентгенологических изменений в результате лечения происходило редко. Таким образом, при постановке диагноза большую ценность имеет рентгенологическое обследование, однако и сцинтиграфия должна найти свое место как средство наблюдения за обратным развитием костных поражений.
Поражения почек: «миеломная почка»
Нарушение функций почек — опасное осложнение миеломной болезни. Оно обнаруживается у половины всех больных к моменту постановки диагноза и стоит на втором после инфекций месте среди причин смерти [DeFronzo et al., 1978; Kyle, 1975]. По данным исследования, проведенного Советом медицинских исследований, функция почек является важнейшим единичным фактором, определяющим прогноз при этом заболевании; показано, что смертность среди больных с уровнем мочевины крови более 12 ммоль/л была в 5 раз выше, чем среди больных с нормальной величиной этого показателя в момент постановки диагноза [Galton et al., 1973]. В основе нарушений функций почек при миеломе может лежать множество различных механизмов, приводящих к острой или хронической почечной недостаточности, нефротическому синдрому (обычно в сочетании с амилоидозом) или изредка — к синдрому Фанкони. Особое значение в патогенезе поражений почек придается легко устранимым нарушениям, таким как гиперкальциемия, гиперурикемия и повышенная вязкость крови [Cohen, Rundles, 1975]. Увеличение в сыворотке уровня кальция или мочевой кислоты, несомненно, может быть связано с острой почечной недостаточностью, а рвота и полиурия, сопутствующие гиперкальциемии, усиливают потерю воды, обусловленную непосредственным нарушением ее канальцевой реабсорбции. Из-за дегидратации и связанной с ней гипертоничности крови введение таким больным контрастного вещества для внутривенной урографии противопоказано [Cohen, Rundles, 1975].
Причина прогрессирующей хронической почечной недостаточности, столь часто наблюдаемой при миеломной болезни, остается спорной. Сообщалось о четкой связи между нарушениями функций почек и экскрецией с мочой легких цепей парапротеина [DeFronzo et al., 1978], однако это наблюдение подтверждается не всеми исследователями [Kyle, Elveback, 1976]. Из 35 обследованных пациентов у всех 9 без протеинурии Бенс-Джонса клиренс креатинина (Ккр) был выше 50 мл/мин. Более чем у половины больных с бенс-джонсовской протеинурией Ккр оказался ниже 50 мл/мин. Выраженность экскреции легких цепей коррелировала со степенью почечной недостаточности [DeFronzo et al., 1978]. У большинства больных с суточной экскрецией белка Бенс-Джонса выше 1 г наблюдалась тяжелая почечная недостаточность (среднее значение Ккр составляло 8 мл/мин). Аналогичная взаимосвязь была обнаружена в ходе Первого исследования, проведенного Советом медицинских исследований [Galton et al., 1973].
Предположение о блокаде канальцев в результате отложений парапротеина Бенс-Джонса в настоящее время выглядит сомнительным, поскольку у некоторых больных с очень высокими уровнями экскреции легких цепей функции почек остаются нормальными. Кроме того, гистологические исследования почечных биоптатов показали, что в случае наличия цилиндров последние состоят из альбумина, иммуноглобулина и смеси легких цепей х и X и что выраженные нарушения функций почек могут встречаться и при отсутствии канальцевых цилиндров [Kyle, Bayrd, 1976]. Выраженная атрофия канальцев — патоморфологический признак, в наибольшей степени коррелирующий с клиническими проявлениями «миеломной почки». Легкие цепи метаболизируются в клетках канальцев, оказывая на них прямое токсическое действие [DeFronzo et al., 1978]. Показатель рН мочи может сдвигаться в щелочную сторону, может быть также нарушена концентрационная способность почек. Изредка при миеломной болезни возникает синдром Фанкони [Maldonado et al., 1975]. Во всех этих случаях у больного обнаруживалась протеинурия Бенс-Джонса, а диагнозу миеломной болезни в течение ряда лет иногда предшествовала дисфункция проксимальных канальцев. В одном из обследований [Kyle, 1975] в 7 % случаев обнаружен амилоидоз почек, который вполне мог быть причиной нефротического синдрома или почечной недостаточности. Инфекция мочевыводящих путей редко является первичной причиной почечной недостаточности, но утяжеляет уже существующее поражение почки.
Неврологические осложнения
Поражения нервной системы при миеломной болезни могут быть результатом непосредственного распространения процесса на спинной мозг или нервные корешки либо вторичным следствием гиперкальциемии или повышенной вязкости крови. Иногда наблюдается полиневропатия (связанная или не связанная с амилоидозом). До 30% случаев протекают с явлениями компрессии спинного мозга (КСМ) или поражения конского хвоста, причем частота КСМ, по данным различных наблюдений, составляет 6—16 % [Brenner et al., 1982; Silverstein, Doniger, 1973; Cohn, Rundles, 1975]. Сдавления нервных корешков (радикулопатия) или спинного мозга обычно являются следствием распространения поражения с тел позвонков на экстрадуральные пространства. Вместе с тем причиной компрессии могут также быть переломы позвонков или очаг экстрамедуллярной плазмоцитомы. Два важнейших принципа ведения больных с КСМ состоят в распознавании предвестников этого осложнения и неотложной терапии возникшего пареза. В 80 % случаев параплегиям предшествуют боли в спине, и более чем в половине случаев наблюдаются корешковые боли [Brenner et al., 1982; Dahlstrom et al, 1979]. Любые явления мышечной слабости, потери чувствительности, нарушения мочеиспускания должны рассматриваться как предвестники надвигающегося пареза и служить сигналом для проведения неотложного обследования с целью определения уровня компрессии спинного мозга. По данным многих наблюдений, наиболее часто поражения локализуются в грудном отделе, однако причина такой избирательности неясна [Dahlstrom et al., 1979; Benson et al., 1979; Brenner et al., 1982]. Локализацию поражения вполне можно установить на основании данных обзорной рентгенографии и томографии. Однако перед проведением ламинэктомии полученные результаты обычно следует подтвердить с помощью контрольной миелографии. Мнение о необходимости хирургического устранения компрессии с последующим проведением радиотерапии разделяет большинство специалистов. Если ламинэктомию выполняют в течение 24 ч после возникновения явлений компрессии, полное восстановление функций достигается у 50 %, а частичное — у 30 % оперированных [Brenner et al., 1982]. Однако и при более позднем хирургическом вмешательстве удается добиться определенного восстановления функций, поэтому и в таких случаях показана активная тактика.
Связь между КСМ и другими характеристиками миеломной болезни (например, подклассом продуцируемого иммуноглобулина) отсутствует, а общая продолжительность жизни больных с полным восстановлением функций после КСМ такая же, как у тех больных, у которых это осложнение не развивалось. Радиотерапия без хирургического вмешательства может быть показана только в случаях далеко зашедшего заболевания или при наличии других противопоказаний к операции. Периферические невропатии при миеломной болезни встречаются нечасто. Присоединившийся амилоидоз может в результате инфильтрации удерживателя мышц-сгибателей вызвать развитие синдрома запястного канала. Кроме того, встречается периферическая сенсомоторная невропатия типа «чулки-перчатки». Невропатия может возникать и в отсутствие амилоидных отложений; она возникает также при солитарных или множественных очагах плазмоцитомы [Delauche et al., 1981]. Отмечалась связь невропатии с остеосклеротическими поражениями и полицитемией, кожной пигментацией и утолщением концевых фаланг пальцев. В таких случаях в спинномозговой жидкости нарастало содержание белка. В результате поражения опухолью костей черепа может возникать паралич черепно-мозговых нервов. Поражения костей орбиты вызывают нарушения со стороны зрительного и глазодвигательного нервов и последующую офтальмоплегию. Внутричерепные плазмоцитомы обычно вторичны по отношению к поражениям костей черепа, однако сообщалось и о редких опухолях, не связанных с поражением костей.
Синдром повышенной вязкости
Повышенный уровень сывороточных иммуноглобулинов, обусловленный продукцией моноклонального белка, приводит к увеличению вязкости крови, которая при достижении определенной величины становится причиной разнообразных клинических проявлений. Пентамерная структура IgM является причиной того, что синдром повышенной вязкости (СПВ) наиболее часто наблюдается при макроглобулинемии (см. ниже); именно при макроглобулинемии СПВ был впервые описан Вальденстремом. Этот синдром наблюдается примерно у 10 % больных миеломной болезнью, особенно при парапротеинемиях IgA (25 %) или IgG3 [Preston et al., 1978], что обусловлено склонностью IgA к полимеризации, a IgG3—к образованию молекулярных агрегатов.
Уровень вязкости (относительно воды), при котором появляются признаки СПВ, непостоянен и зависит от таких индивидуальных факторов, как наличие первичного заболевания микрососудов, общий объем эритроцитов (ООЭ) и состояние сердца. Так, при уровнях вязкости ниже 4 признаки СПВ возникают редко, от 5 до 8 — наблюдаются в большинстве случаев, а выше 8 — встречаются практически всегда [Bloch, Maki, 1973]. Наиболее частые проявления СПВ-—носовые кровотечения и кровоточивость десен. Может наблюдаться потеря зрения, а ретинопатия относится к числу практически постоянных признаков. Для ретинопатии характерны пламенеющие кровоизлияния, расширенные извитые вены в виде «связки сосисок», могут развиваться отек сосочка зрительного нерва и тромбоз вены сетчатки. Спектр неврологических симптомов широк — от сонливости, головной боли или головокружения до потери сознания и даже комы. Кроме того, СПВ отягощает почечную недостаточность, а если парапротеин обладает свойствами криоглобулина, он может способствовать развитию синдрома Рейно. У таких больных объем плазмы увеличен в соответствии со степенью ее вязкости [Russell, Powles, 1978].
Гиперкальциемия
Повышение содержания кальция в сыворотке крови наблюдается у 10—20 % больных миеломной болезнью [Kyle, 1975]. Это обусловлено усиленной резорбцией костей остеокластами и наиболее выражено у больных с тяжелым остеолизом [Durie et al., 1981]. Установлено, что остеолитические поражения костей при миеломной болезни связаны с повышенной активностью остеокластов, которая индуцируется фактором, секретируемым плазматическими клетками — остеокластактивирующим фактором (ОАФ) [Mundy et al., 1974]. Это патологическое состояние отличается от других костных метастатических поражений, для которых характерно участие в патологическом процессе паратиреоидного гормона или простагландинов, а также увеличение уровня щелочной фосфатазы, происходящей из активированных остеобластов. При миеломной болезни гиперкальциемии не сопутствует повышение уровня этого фермента; исключение составляют периоды заживления костных переломов. Уровни ОАФ, как это ни странно, не коррелируют с выраженностью гиперкальциемии, однако соответствуют тяжести остеолитических поражений [Durie et al., 1981]. Для развития симптомов заболевания имеет значение уровень ионов кальция. Поскольку 55 % кальция связывается с альбумином, а содержание последнего может быть снижено, то это необходимо учитывать при определении уровня кальция. В очень редких случаях наблюдалось связывание кальция парапротеином. У таких больных имела место бессимптомная гиперкальциемия при нормальных условиях ионизированного кальция. К самым ранним симптомам гиперкальциемии относятся потеря аппетита, тошнота, рвота и запоры. Позже развивается спутанность сознания, сонливость и даже кома. Полиурия и полидипсия обусловливают дегидратацию, а комбинация таких явлений, как отложение кальция в почках, повышенная вязкость крови и обезвоживание, может приводить к острой почечной недостаточности.
Нарушение гемостаза
Кровоточивость встречается у 15 % пациентов с миеломной болезнью. Частота этого осложнения еще выше при IgA-миеломе [Lackner, 1973]. Определенную роль может играть обусловленная недостаточностью костного мозга тромбоцитопения, однако в начале заболевания она выражена не настолько, чтобы быть причиной кровотечений. В возникновении капиллярных кровотечений определенную роль могут играть повышенная вязкость крови и связанная с ней гиперволемия, но обычно при миеломе эти факторы имеют меньшее значение, чем при макроглобулинемии. Гораздо важнее разнообразные влияния парапротеина на функции тромбоцитов и механизмы свертывания крови. Время кровотечения часто удлинено, что свидетельствует о нарушении функций тромбоцитов. Выявлены нарушения агрегации тромбоцитов in vitro в ответ на АДФ, снижение выделения фактора IJI, а также изменения адгезивных свойств, причем все эти отклонения могут быть воспроизведены на нормальных тромбоцитах при воздействии на них белков миеломы [Lackner, 1973]. Эти факты дают основание считать, что дефекты тромбоцитов обусловлены воздействием на их поверхность парапротеина. Описано большое число дефектов каскада свертывания, причем чаще других наблюдается удлинение тромбинового и рептилазного времени. Парапротеин ведет себя как ингибитор полимеризации мономеров фибрина. Описаны также ингибиторы фактора VIII и неспецифические ингибиторы образования тромбопластина. Удлинение времени образования сгустка вследствие снижения уровня факторов II, V, VII и VIII приписывают связыванию этих факторов in vivo с парапротеином. Не корригируемый вливанием свежей плазмы дефицит фактора X, который наблюдается у больных миеломной болезнью, осложненной амилоидозом, скорее всего также обусловлен связыванием этого фактора in vivo с иммуноглобулином. Важно помнить, что действительно опасные кровотечения в большей степени коррелируют с изменениями времени кровотечения, агрегации или адгезии тромбоцитов, чем с упомянутыми нарушениями факторов свертывания.
Инфекции Всилу ряда причин у больных миеломной болезнью может быть снижена способность противостоять инфекции. У таких больных не только подавлен синтез нормальных иммуноглобулинов, но и увеличен катаболизм IgG, и зачастую снижен ответ на антигенный стимул (например, пневмококковую вакцину). Нарушен также клеточный иммунитет, кроме того, в опытах in vitro продемонстрировано снижение синтеза иммуноглобулинов миеломными лимфоцитами [Paglieroni, MacKenzie, 1977]. Установлено, что мононуклеарные клетки больных миеломой подавляют ответ нормальных клеток на антиген, однако природа супрессорных клеток не установлена. Источником веществ, непосредственно ингибирующих синтез антител плазматическими клетками, могут быть макрофаги [Ullrich, Zolla-Pazner, 1982]. Недавно проведенный анализ субпопуляций лимфоцитов у больных миеломной болезнью с использованием панелей моноклональных антител выявил относительное преобладание супрессорных Т-лимфоцитов (ОКТ8+) над хелперными (ОКТ4+) клетками [Mills, Cawley, 1983]. Таким образом, при миеломе могут действовать по крайней мере два механизма иммунологической супрессии. Примерно у половины пациентов на той или иной стадии болезни возникает тяжелое инфекционное осложнение, которое очень часто становится одной из причин летального исхода [Cohen, Rundles, 1975]. Наиболее распространены инфекции дыхательной системы и мочевыводящих путей. Возбудителями этих инфекций часто являются полисахаридсодержащий капсулообразующий пневмококк, Н. influenzae и менингококк, а также грамотрицательные кишечные бактерии. Нередко наблюдается инфекция, вызванная St. aureus [Norden, 1980]. При миеломной болезни, так же как и при других В-клеточных злокачественных новообразованиях, часто встречаются инфекции, обусловленные вирусами герпеса.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Анализ крови
При миеломной болезни очень часто обнаруживаются признаки нормохромной нормоцитарной анемии, изредка встречается картина макроцитоза, который характерен для больных, получавших курс лечения. Анемия может усугубляться гемодилюцией, обусловленной увеличением объема плазмы. О наличии парапротеина свидетельствует высокая СОЭ, слипание эритроцитов в виде монетных столбиков и голубоватый фон окрашенного мазка крови. Могут встречаться лейкопения и тромбоцитопения, лейкоэритробластические изменения не характерны. Иногда встречается небольшое число циркулирующих плазматических клеток, и гораздо реже у больных развивается истинный периферический плазмоцитоз (свыше 2-109/л).
Костный мозг
Степень инфильтрации костного мозга плазматическими клетками при миеломной болезни весьма вариабельна. Очень часто в пунктате обнаруживают практически полное замещение плазмоцитами нормальной кроветворной ткани. В других случаях увеличение количества плазмоцитов менее выражено, хотя обычно на их долю приходится свыше 10 % ядросодержащих клеток. Часто поражение носит гнездный характер, из-за чего в единичном пунктате изменения могут не выявляться. Для обнаружения неравномерной инфильтрации костного мозга полезно провести повторную аспирационную или предпочтительнее трепанационную биопсию в других участках скелета. Идентификация плазмоклеточной инфильтрации может иметь особое значение для отличия миеломной болезни от доброкачественной парапротеинемии в отсутствие других клинических признаков заболевания. Реактивное увеличение числа плазматических клеток в костном мозге может наблюдаться при злокачественных опухолях, коллагенозах, болезнях печени и хронических инфекциях. При разграничении этих состояний и миеломной болезни основной упор делается на морфологический атипизм, но, к сожалению, в морфологии плазмоцитов при миеломе отсутствует какой-либо единичный признак, имеющий диагностическое значение. Нарушение ядерно-цитоплазматического отношения, крупное ядрышко, полиплоидия, цитоплазматические включения (тельца Русселя), «пламенеющие» клетки с обильной эозинофильной цитоплазмой — все эти признаки часто встречаются при миеломе, но могут наблюдаться и при реактивных состояниях. Для цитологической дифференциации реактивного состояния и миеломной болезни, по-видимому, более других подходит иммунопероксидазный метод (см. выше). Обнаружение одного типа тяжелой или легкой цепи в цитоплазме плазматических клеток подтверждает клональную (следовательно, злокачественную) природу этих клеток, даже если их количество падает ниже диагностического уровня (т. е. ниже 30 %).
Парапротеин
За крайне редким исключением (менее 1 % случаев) парапротеин обнаруживается в сыворотке и (или) в моче всех больных миеломной болезнью. Одновременно выявляется снижение уровней нормальных иммуноглобулинов. У 80 % больных определяется сывороточный моноклональный белок (М-белок), причем у 60% он является IgG и у 20 % — IgA. В 2/3 случаев М-белок имеет легкие цепи типа k, в остальных — типа l. Изредка (у 1 % больных) выявлялся IgD М-белок, но из-за его низкого содержания в сыворотке таким больным ставят ошибочный диагноз миеломы Бенс-Джонса. У 50—70 % больных IgG- и IgA-миеломой свободные легкие цепи экскретируются с мочой. Примерно у 20 % больных парапротеин в сыворотке не определяется, несмотря на присутствие свободных легких цепей в моче. Зачастую подозрение на миеломную болезнь возникает вследствие обнаружения повышенного уровня сывороточного глобулина, однако для подтверждения диагноза и идентификации М-белка необходимо провести количественное определение уровня Ig, зональный электрофорез и иммуноэлектрофорез сыворотки и мочи.
Зональный электрофорез
Этот метод обычно позволяет идентифицировать моноклональный иммуноглобулин в виде плотной полосы, расположенной в g- или пре-b-зоне (рис. 22). Отсутствие обычной диффузной g-полосы указывает на сопутствующий иммунологический паралич. Иногда наблюдается двойная полоса, обусловленная образованием комплекса молекул М-белка между собой (полимеры IgA) или с IgG (ревматоидный фактор). Изредка такая полоса связана с истинной биклональной гаммапатией. В такой ситуации для идентификации дискретных полос полезно использовать метод иммунологической фиксации.
22. Результаты зонального электрофореза (ЗЭФ) и иммуноэлектрофореза (ИЭФ) у больного с множественной миеломой типа IgGx. Парапротеин выявляется в виде плотной катодной полосы (вверху), а также как утолщение дуг преципитации с антителами к IgG и k-цепям (внизу).
|
|||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 261; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.241.222 (0.014 с.) |