Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Показания к проведению исследования костного мозга и его значениеСодержание книги
Поиск на нашем сайте
Показания к исследованию костного мозга можно разделить на две основные группы. При подозрении на первичное нарушение костного мозга наиболее важные данные — распределение клеточных типов и морфология отдельных клеток. Для этих целей полезнее всего изучить достаточный по размеру участок окрашенного мазка из пунктата костного мозга, дополнительно можно провести гистологическое исследование среза, приготовленного из трепаната. Напротив, при подозрении на системное заболевание— опухоль, инфекцию или васкулит — костный мозг можно исследовать с целью установления диагноза или уточнения степени поражения. В качестве примеров можно привести определение стадии развития лимфомы, выделение в культуре возбудителя при туберкулезе и идентификацию васкулита. Для этих целей наиболее подходит трепанобиопсия, иногда различных участков скелета. Исследование костного мозга следует начинать с просмотра препарата под малым увеличением для получения ответа на три вопроса. Первое, удовлетворителен ли препарат в качественном и количественном отношениях? Необходимо, чтобы капля была растянута по стеклу и клетки лежали в один слой, что дает возможность изучить морфологию отдельных клеток. Второе, нет ли зон клеточной гомогенности? В норме костный мозг — гетерогенная смесь различных типов клеток разных стадий созревания. Наличие полосы или очага клеток одного типа может соответствовать лимфоидному узелку (норма) или указывать на лейкоз, лимфому, миелому или метастаз солидной опухоли. Третье, есть ли в пунктате мегакариоциты? Если другие типы клеток гораздо легче идентифицировать при большом увеличении, то мегакариоцит встречается редко, но легко распознается по большим размерам, благодаря чему просмотр препарата при малом увеличении более всего подходит для приблизительного подсчета мегакариоцитов. Просмотр препарата при большом увеличении преследует три цели. Первое, установить соотношение эритроидных и миелоидных клеток. Эта оценка часто субъективна, «нормальное» миелоидно-эритроидное соотношение варьируется в широких пределах — от 2:1 до 4:1. Дифференциальный подсчет от 500 до 1000 костномозговых клеток позволяет провести более точную количественную оценку. Второе, определить, нормально ли созревают эритроидные и миелоидные клетки. Для выявления мегалобластических или других диспластических изменений изучают созревание ядра и цитоплазмы. Идентифицируют также и задержку созревания клеток эритроидного и(или) миелоидного рядов. Третье, выяснить, не присутствуют ли другие клетки в необычном количестве. В нормальном костном мозге встречаются бласты, плазмоциты, тучные клетки, лимфоциты и эозинофилы. Однако если любой тип этих клеток составляет более 5%, то это указывает на отклонение от нормы. Любая опухолевая клетка аномальна. В заключение определяют запас железа путем окраски железной лазурью. Этот краситель более всего подходит и для выявления сидеробластов. В большинстве случаев исследование костного мозга проводят для выявления или оценки распространенности злокачественных опухолей гематологического или негематологического происхождения. К числу других наиболее частых показаний относятся:
Тромбоцитопения Уменьшение числа мегакариоцитов в костном мозге свидетельствует, что причиной тромбоцитопении является снижение выработки тромбоцитов; увеличение числа мегакариоцитов дает основание предполагать разрушение тромбоцитов в периферической крови. Упомянутые отклонения отчетливо проявляются только при выраженной патологии. Различить эти два типа нарушений в некоторых случаях, не прибегая к исследованию костного мозга, удается благодаря использованию достаточно информативного показателя СОТ. Мегалобластная и железодефицитная анемии Картина костного мозга при обеих болезнях патогномонична: мегалобластическая ядерно-цитоплазматическая диссоциация или отсутствие положительной реакции при окраске на железо, а также общая или эритроидная гиперплазия. По мере увеличения надежности методов определения в крови уровней трансферрина, железа, витамина B12 и фолиевой кислоты, а также клеточных показателей во многих случаях окончательный диагноз можно будет ставить без исследования костного мозга. Вопрос о необходимости выполнения этой относительно безопасной, но неприятной для больного и дорогостоящей процедуры решается в каждом случае индивидуально. Аплазия одной или нескольких клеточных линий Исследование костного мозга является скорее качественным, чем количественным. При наличии цитопении в периферической крови увеличение числа клеток этой же линии в костном мозге говорит о периферической деструкции или неэффективном кроветворении. Напротив, уменьшение числа клеток данной линии свидетельствует о недостаточности костного мозга.
Син Р. Линч, Дэвид А. Липшиц (Sean R. Lynch, David A. Lipschitz)
ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ
ВВЕДЕНИЕ
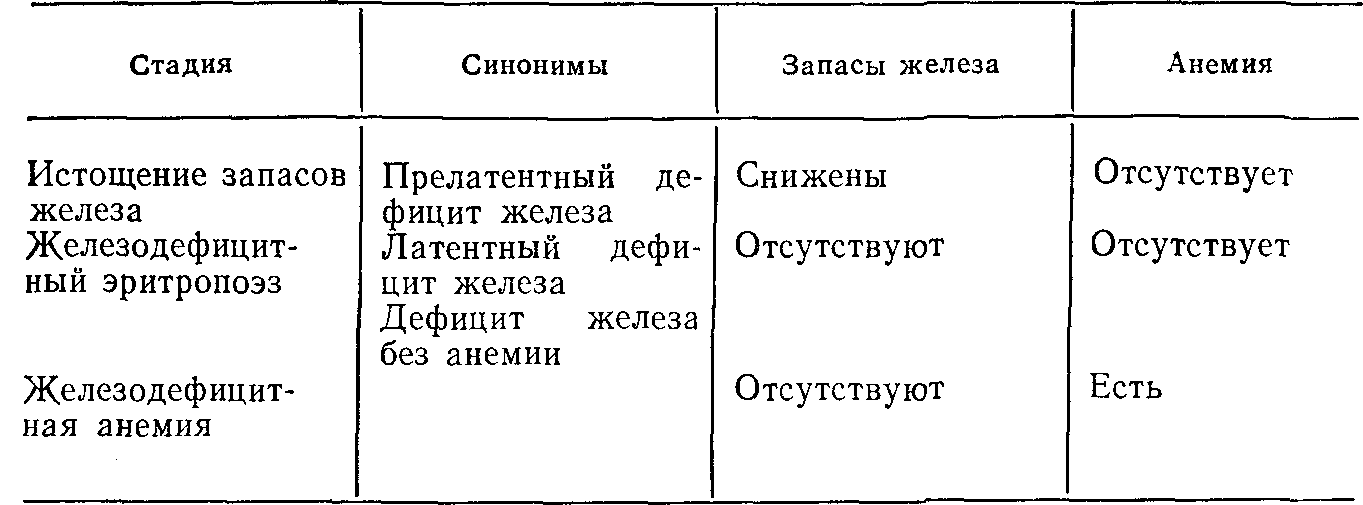
В организме человека почти все железо связано с белками. Существуют три важнейшие группы железосодержащих металлопротеидов: белки, имеющие в своем составе группу гема и обладающие способностью транспортировать и накапливать кислород; ферменты, участвующие в окислительно-восстановительных реакциях, и специфические белки, переносящие и запасающие железо [Wrigglesworth, Baum, 1980]. Примерно три четверти содержащегося в организме железа функционально активно. В состав гемоглобина циркулирующих эритроцитов входит 62% всего железа организма, 8% содержится в миоглобине, а остальное — в тканевых ферментах. Большую часть оставшихся 25% составляют запасы, из которых железо может быть быстро доставлено в места его функционального использования [Bothwell et al., 1979]. Дефицит железа возникает при снижении его общего содержания в организме, причем это снижение может проявляться как в виде уменьшения запасов железа без функциональных нарушений, так и полным истощением запасов с развитием тяжелой анемии (табл. 6).
МЕТАБОЛИЗМ ЖЕЛЕЗА
Большинство исследований транспорта железа в организме выполнено у молодых индивидуумов. Кинетика железа была также изучена у одного мужчины и шести женщин в возрасте от 61 до 80 лет [Marx, Dinant, 1982]. Полученные результаты сравнивали с соответствующими показателями у семи мужчин и трех женщин 19—50 лет. Круговорот железа плазмы был несколько выше у лиц старшего возраста (125±47 мкмоль/л крови/24 ч) по сравнению с молодыми лицами (112±27 мкмоль/л крови/24 ч), тогда как эритроцитарная утилизация у пожилых была ниже (82% против 85%). Таким образом, круговорот неэритроидного железа (железа, предназначенного для других тканей, помимо костного мозга) у пожилых индивидуумов по сравнению с молодыми был значительно увеличен (соответственно 29 и 17 мкмоль/л крови/24 ч).
ВСАСЫВАНИЕ ЖЕЛЕЗА
Постоянный уровень железа в организме поддерживается путем уравновешивания скорости его всасывания со скоростью неизбежных потерь. Из множества известных факторов, способных в экспериментальных условиях изменять всасывание железа, только три представляются существенными в физиологических условиях. К ним относятся: количество поступившего с пищей железа, его биодоступность и, наконец, состояние запасов железа в организме данного индивидуума [Lynch, Morck, 1983]. Содержание железа в пище жителей стран Запада составляет в среднем 6 мг/4,2 МДж [Wretlind, 1970]. Недавно проведенные в США диетологические исследования показали, что у пожилых потребление железа находится на адекватном уровне. Такой уровень сохраняется даже при снижении калорийности потребляемой пищи, поскольку параллельно возрастает пищевая плотность железа — с 6 до 8 мг/4,2 МДж {Lynch et al., 1982]. Вместе с тем надо отметить, что пищевой дефицит может возникать у лиц, относящихся к группам риска, к числу которых следует причислить пациентов домов престарелых [Jansen, Harrill, 1974], инвалидов и одиноких [Caird et al., 1975; Steen et al., 1977], а также лиц пожилого возраста, разнообразие пищи которых ограничено из-за их бедности или стойкого отвращения к определенным пищевым продуктам [Boykin, 1976]. Полноценное потребление зависит от биодоступности пищевого железа не меньше, чем от его абсолютного содержания в пище [Bothwell et al., 1979]. Железо, входящее в состав гема, всасывается в виде интактного порфиринового кольца и обладает высокой биодоступностью практически во всех мясных продуктах. Однако даже в западных странах на долю железа гема приходится лишь незначительная часть его общего поступления в организм с пищей. Пищевое железо во всех остальных формах (негемовое железо) растворяется и прежде чем всосаться становится компонентом общего пищевого пула желудочно-кишечного тракта. Ассимиляция из этого пула во многом зависит от состава пищи. Важнейшими пищевыми факторами, способствующими полноценному всасыванию железа, являются, по-видимому, мясо и аскорбиновая кислота [Monsen et al., 1978]. Поэтому у стариков биодоступность пищевого железа может уменьшаться из-за ограниченного разнообразия пищи. Данные второго обследования влияния питания на здоровье (Health and Nutrition Survey), проведенного в США, свидетельствуют, что с возрастом снижается роль потребления пищевого железа, приходящаяся на мясные продукты [Lynch et al., 1982]. Такая тенденция может вести к снижению биодоступности железа по двум причинам: из-за уменьшения в пище количества железа, входящего в состав гема, и вследствие сниженной биодоступности не-гемового железа. Могут нарушаться также и физиологические механизмы ассимиляции железа. Сообщалось о снижении всасывания [Bonnet et al., 1960; Freiman et al., 1963; Jacobs, Owen, 1969]. К сожалению, в ранних исследованиях недостаточно контролировалось состояние запасов железа в организме, что затрудняет интерпретацию полученных результатов. Jacobs, Owen (1969) измеряли всасывание железа из стандартизованного пищевого продук-тас у здоровых людей — 8 мужчин и 28 женщин. Авторы считали, что организм этих лиц насыщен железом, поскольку у них был нормальный уровень гемоглобина, содержание железа в сыворотке превышало 11,6 мкмоль/л (в среднем 20,9 мкмоль/л) и коэффициент насыщения сыворотки железом был выше 18% (в среднем 32%). Возраст обследованных варьировал от 21 года до 78 лет. Установлено, что с возрастом снижается всасывание неорганического железа, но не железа, входящего в состав гема. Поскольку хлористоводородная кислота способствует всасыванию неорганического железа, не влияя на всасывание гемового, авторы предположили, что обнаруженное ими явление может быть следствием чаще встречающихся у пожилых лиц атрофии слизистой оболочки желудка и гипохлоргидрии. Позднее Marx (1979) показал, что в условиях насыщения железом его соединения с сульфатом аммония всасываются одинаково хорошо в организме как молодых, так и старых людей и что у лиц обеих возрастных групп в ответ на дефицит железа развиваются соответствующие этому дефициту реакции. Поскольку хлористоводородная кислота существенно не влияет на всасывание как гемового железа, так и растворимых солей двухвалентного железа [Jacobs et al., 1964], результаты двух упомянутых исследований дают основание считать, что при старении не нарушаются поглощение и транспорт названных выше форм железа в слизистой оболочке, и что гипохлоргидрия ограничивает всасывание менее растворимых форм пищевого железа. У молодых людей, организм которых насыщен железом, через 2 нед примерно 80% всосавшегося железа обнаруживается в циркулирующих эритроцитах. Недавно установлено, что у пожилых лиц включение такого железа в эритроциты снижено [Marx, 1979; Marx, Dinant, 1982]; причиной этого может быть увеличенная задержка железа при его прохождении через печень.
ЭКСКРЕЦИЯ ЖЕЛЕЗА
Способность организма увеличивать всасывание железа ограничена его потреблением с пищей. Поэтому неудивительно, что дефицит железа возникает чаще всего при увеличении потребности в нем в результате ускоренного роста (раннее детство) или интенсивной потери (менструация, беременность и лактация). У пожилых неизбежные физиологические потери минимальны. Они возникают вследствие слущивания клеток кожи, желудочно-кишечного тракта и мочевыводящих путей, а также выделения небольших количеств железа с потом, желчью и мочой. С помощью радионуклидных методов Finch (1959) установил, что уровень суточной экскреции железа составляет 0,61 (±0,08) мг у 57—84-летних мужчин и 0,64 (±0,05) мг у 59— 77-летних женщин. У женщин во время менструации потери гораздо больше—1,22 (±0,11) мг в сутки. Используя тот же метод при обследовании трех групп молодых мужчин, Green и соавт. (1968) получили величины от 0,90 до 1,02 мг в сутки.
ЗАПАСЫ ЖЕЛЕЗА
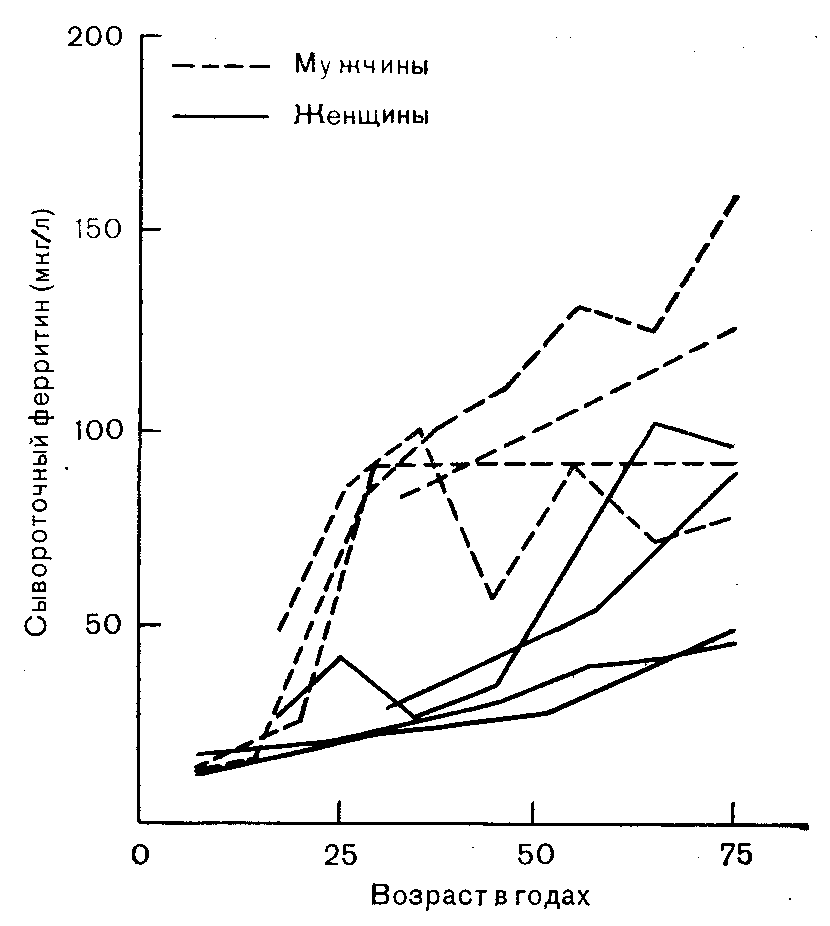
Рис. 5. Влияние возраста на концентрацию сывороточного ферритина. Данные четырех различных исследований [Cook et al., 1976; Valberg et al., 1976; Leyland et al., 1976; Casale et al, 1981]. Воспроизведено с разрешения American Journal of Clinical Nutrition.
Другим важным местом локализации запасов железа является костный мозг. Содержание в этом органе железа, определяемого методами окрашивания, с возрастом также увеличивается [Benzie, 1963]. Однако наиболее убедительные данные были получены непрямым методом при измерении такого показателя, как концентрация сывороточного ферритина, который тесно коррелирует с величинами запасов железа в организме: 1 мкг/л ферритина плазмы соответствует приблизительно 10 мг железа запасов [Cook, 1982]. Концентрация ферритина с возрастом увеличивается (рис. 5). У женщин эта тенденция наиболее выражена после 50 лет.
|
||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 422; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.012 с.) |