

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Предраковые заболевания и рак шейки матки.
Похожие статьи вашей тематики
Предраковые заболевания и рак шейки матки.
Рак шейки матки полностью предотвратимое заболевание, если оно выявляется на стадии предрака или начальной формы рака.
(Из резолюции Всемирного конгресса по патологии шейки матки. Сидней 1996 год.)
Частота встречаемости рака шейки матки
В мире ежегодно регистрируется около 470 000 новых случаев цервикальной карциномы (7,8 на 100 000 населения), 80% из них приходится на развивающиеся страны. Смертность от рака шейки матки составляет около 200 000 женщин в год (3,3 на 100 000).
В России ежегодно выявляется около 12500 новых случаев этого заболевания (8,7 на 100 000 населения), и около 7000 женщин в год погибают от цервикальной карциномы (5 на 100 000).
В Ярославской области в год регистрируется 57 женщин с вновь выявленной цервикальной карциномой (4,1 на 100 000 населения), умирают 45 человек (3,2 на 100 000 населения).
Рак шейки матки:
- является вторым по частоте раком у женщин, следом за раком молочной железы
- является третьим по частоте заболеванием раком в гинекологии
- характерен бимодальным распределением пациентов по возрасту с пиками заболеваемости в 35-39 лет и в 60-64 года. Средний возраст выявления заболевания – 52 года.
Факторы риска рака шейки матки
Инфицирование вирусом папилломы человека (ВПЧ). ДНК ВПЧ определяется в 75 – 100% случаев рака шейки, в 77 – 94% случаев цервикальной интраэпителиальной неоплазии (дисплазии) различной степени и в 30 – 70% при нормальной цитологической картине. Наибольший риск развития рака шейки матки связан с типами 16, 18, 31, а также 33, 35, 45 ВПЧ. В то же время количество инфицированных ВПЧ значительно больше в сравнении с частотой случаев предраковых заболеваний и рака шейки матки. Ежегодно в мире регистрируются десятки и сотни миллионов инфицированных ВПЧ, и у большинства вирус элиминируется самостоятельно без какого-либо лечения. Только у незначительной части женщин появляется цервикальная интраэпителиальная неоплазия II и III степени.
Раннее начало половой жизни (до 16 лет). Считается, что в молодом возрасте эпителий влагалищной части шейки матки обладает большей восприимчивостью к канцерогенным факторам, прежде всего за счет повышенного количества гликогена. Возможно, имеет значение более длительное воздействие канцерогенных факторов на шейку матки. Однако указанный фактор риска признается не всеми исследователями.
Большое количество половых партнеров. Частота инвазивного рака шейки матки прямо пропорциональна количеству половых партнеров в течение жизни пациента.
Мужской фактор. Высокая встречаемость ВПЧ у мужчин отмечена в тех странах, где выявлено наибольшее количество инвазивного рака шейки матки. Отмечено, что у пациентов с раком шейки матки мужья чаще болели секстрансмиссивными инфекциями, были склонны к рискованному половому поведению, имели контакты с проститутками.
Большое количество беременностей. С увеличением количества беременностей возрастает и риск развития цервикальной карциномы: у женщин, имевших 4 и более беременности риск развития рака шейки матки в среднем в 2 раза выше, а при наличии 4 и более родов в 3 раза выше, чем у женщин, не имевших беременности.
Низкий социально – экономический статус. Около 80% всей онкологической патологии шейки матки встречается в развивающихся странах, что связано как с нехваткой средств для проведения скрининга, так и с низким культурным уровнем населения в этих государствах. Кроме того, у женщин низкого социального статуса в цервикальной слизи чаще определяются ВПЧ онкогенных штаммов.
Курение, в том числе пассивное. У курящих женщин, а также у тех, которые не курят, но находятся в окружении табачного дыма в течение не менее чем 3 часа в сутки, в цервикальной слизи определяются никотин, континин и табак-специфичные N -нитрозамины, которые вызывают повреждение ДНК шеечного эпителия и нарушают локальный клеточный иммунный ответ. Доказано, что у таких женщин частота развития рака шейки матки выше, по сравнению с общей популяцией в 3 – 8 раз.
Инфицирование ВИЧ. Инвазивный рак шейки матки входит в перечень состояний, характерных для синдрома приобретенного иммунодефицита (СПИДа). У ВИЧ инфицированных частота встречаемости патологии шейки матки выше, чем без ВИЧ инфекции. ВИЧ является также кофактором ВПЧ в развитии патологии шейки матки, хотя механизм их взаимодействия до конца не ясен.
Прием иммуносупрессантов. Иммуносупрессанты (глюкокортикоиды, цитостатики) подавляют клеточный иммунный ответ и способствуют возникновению и прогрессированию цервикального рака.
Контрацепция. Использование барьерных методов, особенно в сочетании со спермицидами, снижает риск заболевания раком шейки матки. Влияние на частоту заболевания приема комбинированных оральных контрацептивов (КОК) не доказано.
Раса. Выходцы из Африки и Латинской Америки заболевают в 2 раза чаще в сравнении с европейцами. Представители народов Азии заболевают с одинаковой с европейцами частотой или реже.
Следует отметить: связь заболевания цервикальной неоплазией и инфицирования Chlamydia trachomatis, Herpesvirus 2 типа, Cytomegalovirus не доказана.
Предшественники цервикального рака
В мире существует общепризнанная классификация предшественников рака шейки матки, которая основана на глубине поражения многослойного плоского неороговевающего эпителия:
- Цервикальная интраэпителиальная неоплазия 1 степени (CIN I) – дисплазия легкой степени
- Цервикальная интраэпителиальная неоплазия 2 степени (CIN II) – дисплазия средней степени
- Цервикальная интраэпителиальная неоплазия 3 степени (CIN III) – дисплазия тяжелой степени или carcinoma in situ.
Гистология. Цервикальная интраэпителиальная неоплазия характеризуется ядерным плеоморфизмом, гиперхроматизмом, увеличением соотношения ядро-цитоплазма, митозами, дискератозом. При наличии CIN I изменения отмечаются на участках эпителия, примыкающих к базальной мембране на глубине около 1/3, при CIN II – на глубине 2/3, при CIN III изменения встречаются во всем эпителии, толщина которого в среднем составляет 2,4 мм.
Следует знать, что:
CIN I связана с инфицированием шейки матки неонкогенными штаммами ВПЧ:
- регрессирует без какого-либо лечения в 60% случаев,
- существует длительное время в 25% случаев,
- прогрессирует в CIN II или CIN III в течение 3-4 лет у 15% женщин.
CIN II
- регрессирует без какого-либо лечения в 33% случаев,
- существует длительное время в 49% случаев,
- переходит в CIN III в 18% случаев.
CIN III прогрессирует в инвазивный рак шейки матки у 70% женщин в течение 7 – 10 лет.
Методы выявления предшественников цервикального рака
Ввиду отсутствия какой-либо клинической картины у предшественников цервикального рака актуальным является вопрос о раннем выявлении этой патологии. В этой связи необходимо проведение скрининга, позволяющего заподозрить указанные состояния. Требования, предъявляемые к скрининговой процедуре:
- Доступность
- Небольшая стоимость
- Информативность (чувствительность не менее 40 – 45%)
- Выявление заболевания на стадии цервикальной интраэпителиальной неоплазии или преинвазивного рака
РАР – мазок
Впервые предложен Papanicolau в 1940 году для диагностики рака шейки матки. С середины 60-х годов метод используется как скрининговый по выявлению предраковых состояний и преинвазивного рака шейки матки. Чувствительность (способность выявлять патологию) и специфичность (способность выявлять норму) по данным различных авторов составляют 52% и 95% соответственно. В таблице 1 приведены данные чувствительности и специфичности РАР – мазка в зависимости от глубины поражения плоскоклеточного неороговевающего эпителия.
Таблица 1. Чувствительность и специфичность РАР – мазка при выявлении предшественников цервикального рака
| Предшественники цервикального рака
| Чувствительность, %
| Специфичность, %
| | CIN I
| 17,3
| 99,2
| | CIN II
|
|
| | CIN III
| 62,5
| 99,3
| Метод выявления цервикальных неоплазий методом РАР – мазка не является точным:
- частота ложно-отрицательных результатов цитологического скрининга составляет 1 – 80% (в среднем 20 – 45%);
- частота ложно-положительных результатов – 5 – 15%;
- расхождение во мнении различных специалистов при трактовке результата – 3 – 8%.
Для уменьшения количества ошибок и неточностей при оценке результата цитологического исследования необходимо соблюдать ряд требований по забору материала:
- Материал с влагалищной части шейки матки берется шпателем Эйра соответствующего размера, а из цервикального канала эндоцервикальной щеткой; в материале обязательно должны присутствовать клетки из зоны трансформации;
- Взятие материала необходимо производить на 10 – 18 день цикла (от 1 – го дня последней менструации);
- Не спринцеваться в течение 48 часов перед тестом;
- Не использовать тампоны, вагинальные кремы за 48 часов перед тестом;
- Воздерживаться от половых контактов в течение 48 часов перед тестом.
Для интерпретации РАР – мазков в настоящее время пользуются рекомендациями Американского общества по кольпоскопии и патологии шейки матки, которые были утверждены в 1988 году, пересмотрены и дополнены в 2001 году (таблица 2).
Таблица 2. Классификация РАР – мазка (BETHESDA SYSTEM 2001 год)
| BETHESDA
| Классы мазков по Папаниколау
| | Нормальный мазок
| 1 класс
| | Неспецифичные атипичные плоскоклеточные изменения (не связаны с ВПЧ)
| 2 класс
| | Атипичные плоскоклеточные интраэпителиальные изменения низкой степени (связаны с инфицированием ВПЧ)
Гистологически соответствуют CIN I
| 3 класс
| | Атипичные плоскоклеточные интраэпителиальные изменения высокой степени
Гистологически соответствуют CIN II, CIN III, ca in situ.
| 4 класс, 5 класс
| | Атипичные железистые клетки (эндоцервицит, эндоцервикальная adenocarcinoma in situ, эндометриальная adenocarcinoma)
|
| В США скрининг на рак шейки матки проводится всем женщинам, ведущим половую жизнь, начиная с 18 летнего возраста и заканчивая 65 годами. Частота скрининга должна быть один раз в год. При наличии 3 последовательных отрицательных результатов частота может составлять 1 раз в 3 года.
В Финляндии – стране с наименьшей заболеваемостью раком шейки матки – скрининг начинается с 25 лет и проводится до 65 летнего возраста с частотой 1 раз в 5 лет.
В Великобритании обследованию подлежат все женщины с 24 до 64 лет с частотой 1 раз в 3 – 5 лет.
В России согласно приказу № 50 «О совершенствовании акушерско-гинекологической помощи в амбулаторно-поликлинических учреждениях» от 2003 года цитологическому обследованию на цервикальную карциному подлежат все женщины, ведущие половую жизнь, начиная с 18 летнего возраста. Частота скрининга составляет 1 раз в год.
Важно помнить:
- около 70% женщин с впервые выявленным раком шейки матки не подвергались исследованию в виде РАР – мазков в течение 3 предшествующих лет
- один отрицательный результат РАР-мазка снижает риск рака шейки матки на 45%, а девять отрицательных результатов РАР-мазка в течение жизни снижают риск на 99%
- у женщин в возрасте 35-64 года скрининг с интервалом в 10, 5 и 3 года снижает частоту инвазивного рака шейки матки соответственно на 64%, 84% и 91%
Кольпоскопия
Впервые предложена Hinselmann в 1920 году. Простая кольпоскопия – осмотр влагалищной части шейки матки под 8 – 40 кратным увеличением, расширенная кольпоскопия – осмотр шейки матки после ее обработки 3% раствором Люголя (проба Шиллера) или 3% уксусной кислотой.
Проба Шиллера основана на взаимодействии гликогена, находящегося в клетках эпителия влагалищной части шейки матки, с молекулами иода, входящими в состав раствора Люголя. В нормальном состоянии шейка матки окрашивается в темно-коричневый цвет. При наличии патологии эпителия в нем, как правило, снижается концентрация гликокена и появляются более светлые, иод-негативные участки.
Обработка влагалищной части шейки матки 3% уксусной кислотой приводит к удалению слизи, обезвоживанию клеток, кратковременному отеку эпителия, сокращению сосудов под эпителием, анемизации тканей, что кольпоскопически проявляется изменением цвета. Чем больше содержится в клетке белка, тем она становится белее. Нормальный богатый гликогеном эпителий остаётся розовым. Четкие контуры белого (ацетобелого) эпителия, ярко выраженная интенсивность цвета и способность длительно сохранять бело-серый цвет, особый ход сосудов и отсутствие их сокращения свидетельствуют о возможной атипии.
Задачи кольпоскопии:
- адекватный осмотр зоны трансформации – места соприкосновения многослойного плоского неороговевающего эпителия влагалищной части шейки матки и однослойного цилиндрического эпителия цервикального канала, которая является источником 90% онкологической патологии шейки матки
- уточнить топографию процесса
- выбрать место для проведения прицельной биопсии.
Показания для кольпоскопии:
- Результат РАР–мазка – плоскоклеточные интраэпителиальные поражения (ПИП) легкой степени, ПИП тяжелой степени;
- Повторный результат РАР–мазка – неспецифичные атипичные плоскоклеточные изменения (НАПИ);
- Наличие видимых изменений на шейке матки;
- Наличие патологии цервикального канала.
Применение кольпоскопии как процедуры скрининга не рекомендуется:
- Чувствительность расширенной кольпоскопии составляет в среднем 34 – 43%
- Специфичность не более 68%
- Положительная предсказательная ценность – 4 – 13%
- Высокая стоимость оборудования и обучения специалиста
- Дискомфорт пациента (болевые ощущения по 10-ти кратной шкале боли в среднем составляют 3 – 4,6 балла).
Рисунок 1. Онкогенез, индуцированный ВПЧ
Е6 связывает р53 и вызывает его деградацию. Е7 связывает Rb, в результате чего транскрипционный фактор E 2 F -1 становится свободным и индуцирует клеточную активацию и рост (Janicek M. F., Averette H. E. Cervical Cancer: Prevention, Diagnosis, and Therapeutics // CA Cancer J Clin 2001; 51:92-114).
Определения ВПЧ в цервикальной слизи:
- блоттинг
- гибридизация in situ
- жидкофазная гибридизация (гибридный захват). Чувствительность 59 – 86% в отношении определения CIN у женщин с цитологической картиной неспецифичных атипичных плоскоклеточных изменений и ПИП легкой степени.
- полимеразная цепная реакция (ПЦР). В определении CIN чувствительность достигает 98 – 100%, специфичность - не более 10%. Положительная прогностическая ценность в отношении CIN II, CIN III, carcinoma in situ также составляет не более 10%.
Учтите: повторные РАР – мазки обладают лишь 60% чувствительностью в определении какой – либо степени CIN.
Рисунок 2. Тактика ведения пациентов с неспецифическими атипичными плоско-клеточными изменениями в РАР-мазке
Неспецифические атипичные плоскоклеточные изменения (НАПИ ):
- являются следствием воспалительных изменений во влагалище и/или в шейке матки. Поэтому при наличии такой цитологической картины (рисунок 2) требуется адекватное лечение инфекционного процесса с применением антибактериальных средств. Через 6 месяцев необходимо провести контрольное цитологическое исследование в сочетании с тестом на ВПЧ. Это связано с тем, что в 15 – 20% случаев под «маской» НАПИ скрываются более серьезные изменения, в том числе связанные с инфицированием ВПЧ.
- если при повторном обследовании НАПИ повторяются или определяются более тяжелые цитологические аномалии, то такую женщину необходимо подвергнуть кольпоскопическому обследованию, а при наличии видимых изменений провести прицельную биопсию.
- при нормальной картине РАР – мазка, но положительном тесте на ВПЧ необходимо проводить цитологические исследования каждые 6 месяцев в течение 2 лет для выявления возможных последствий инфицирования ВПЧ в виде ПИП легкой или тяжелой степени. Это связано с тем, что у 15% женщин, имеющих отрицательный результат РАР – мазка и положительный результат теста на ВПЧ, в течение 2 – 3 лет появляются изменения при цитологическом исследовании.
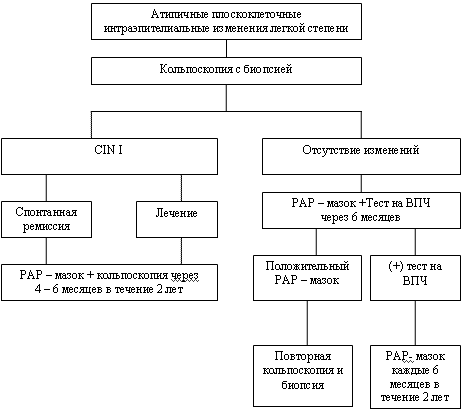
Рисунок 3. Тактика ведения пациентов с атипичными плоскоклеточными интраэпителиальными изменениями в РАР-мазке легкой степени
При цитологической картине плоскоклеточных интраэпителиальных поражениях (ПИП) легкой степени (рисунок 3):
- необходимо проведение кольпоскопического исследования и, при наличии видимых изменений, проведения прицельной биопсии.
- в случае гистологического ответа – CIN I степени (легкая дисплазия), возможно диспансерное наблюдение за женщиной в течение 2 лет, поскольку в 60% случаев CIN I регрессирует без лечения.
- если пациентка не заслуживает доверия врача, или имеются выраженные макроскопические изменения на шейке матки при отсутствии изменений в мазке из цервикального канала допустимо проведение аблации (диатермокоагуляции).
- при отсутствии изменений по кольпоскопии пациентке показано повторное цитологическое исследование с тестом на ВПЧ через 6 месяцев. Дальнейшая тактика ведения сходна с той, которая была описана при НАПИ.
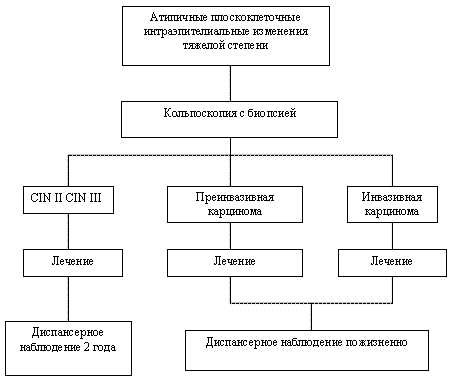
Рисунок 4. Тактика ведения пациентов с атипичными плоскоклеточными интраэпителиальными изменениями в РАР-мазке тяжелой степени
При цитологической картине ПИП тяжелой степени (рисунок 4):
- кольпоскопия и прицельная биопсия с обязательным захватом зоны трансформации.
- при выявлении CIN II (дисплазия средней тяжести) или CIN III (тяжелая дисплазия) и отсутствии изменений в цервикальном канале допустимо применение органосохраняющей операции – аблации зоны поражения влагалищной части шейки матки.
- если зона поражения распространяется на цервикальный канал, операцией выбора является конизация шейки матки. В дальнейшем такая женщина должна состоять на диспансерном учете у гинеколога в течение 2 лет, где в обязательном порядке через 4 – 6 месяцев после операции необходимо провести кольпоскопию и каждые 6 месяцев – цитологическое исследование. При рецидиве заболевания показано более широкое оперативное вмешательство.
- в случае диагностики преинвазивной или инвазивной карциномы необходимо определить стадию заболевания с применением всех доступных диагностических процедур и передать пациентку для лечения и наблюдения онкогинекологу.
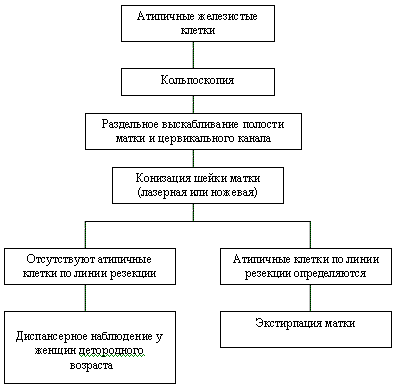
Рисунок 5. Тактика ведения пациентов при наличии в РАР-мазке атипичных железистых клеток
При выявлении атипичных железистых клеток (рисунок 5):
- необходимо произвести кольпоскопию для исключения патологии влагалищной части шейки матки.
- далее показано выскабливание канала шейки, а при наличии жалоб и выскабливание полости матки, так как источником таких изменений может быть и эндометрий.
- в случае наличия аденокарциномы цервикального канала и желания женщины сохранить детородную функцию производят конизацию шейки матки с использованием лазера, скальпеля или тонкой (диаметром не более 0,3 мм) электрической петли. Конус должен иметь максимально возможную высоту. Дополнительно необходимо произвести выскабливание верхней части шеечного канала, которая не попала в срез.
- при наличии атипичных клеток по линии резекции и/или в соскобе показано более радикальное хирургическое лечение – экстирпация матки.
- при отсутствии атипичных клеток по линии резекции и отрицательном результате соскоба из верхней части цервикального канала конизация считается радикальной операцией. Такая женщина подлежит цитологическому исследованию, кольпоскопии и эндоцервикальному кюретажу каждые 4 месяца в течение 1 года, а в дальнейшем – каждые 6 месяцев.
- после реализации генеративной функции такой женщине может быть произведена экстирпация матки ввиду того, что в 12,5% случаев отсутствия атипичных клеток по линии резекции в удаленном препарате в дальнейшем определяется персистенция аденокарциномы.
Таблица 3. Эффективность применения органосберегающих методик лечения предраковых процессов шейки матки
|
| Криодеструкция
| Лазерная вапоризация
| | CIN I
| 94,4%
| 93,5%
| | CIN II
| 94,4%
| 92,9%
| | CIN III
| 90,1%
| 93,4%
| При отсутствии условий для выполнения аблации влагалищной части шейки матки может быть применена конизация – удаление конуса, основание которого обращено к влагалищной части, а верхушка направлена в цервикальный канал. Хороший конус имеет диаметр основания 2 – 2,5 см, а высоту не менее 1,5 – 2 см.
Показания для конизации шейки матки:
- Отсутствие визуализации при кольпоскопии зоны трансформации
- Распространение процесса на эндоцервикс
- Патология эндоцервикса при кюретаже
- Нет соответствия между цитологическими, кольпоскопическими и гистологическими признаками
- После аблации шейки матки данные биопсии вновь показывают CIN
- Преинвазивная или микроинвазивная карцинома
Конизация шейки матки может быть выполнена с применением:
- Электричества (диатермоконизация)
- Хирургического ножа
- Лазера
Электроконизация является наиболее дешевым, хорошо переносимым методом удаления части шейки матки.
Ножевая конизация имеет достоинство в виде хорошей визуализации линии резекции в удаленном препарате. Недостатками являются более высокая по сравнению с электроконизацией кровопотеря во время проведения операции, и более высокий риск аборта во II триместре беременности, преждевременных родов и рождения детей с малой массой тела.
Лазерная конизация является наиболее дорогостоящим методом, но в тоже время отличается небольшим количеством осложнений и хорошим косметическим эффектом.
Таблица 4. Сравнительный анализ методик лечения патологии шейки матки
| | Лазерная конизация
| Ножевая конизация
| Электроконизация
| | Эффективность
| 95,6%
| 94,1%
| 96,1%
| | Кровотечение
| 5,5%
| 13,7%
| 1,8%
| | Стеноз шейки матки
| Нет данных
| Нет данных
| 1%
| | Хорошая переносимость
| 32%
| Нет данных
| 92%
| | Средняя длительность процедуры
| 15-20 минут
| Нет данных
| 50-60 секунд
| Сведения, касающиеся частоты рецидива цервикальной интраэпителиальной неоплазии в зависимости от наличия или отсутствия изменений по линии резекции приведены в таблице 5.
Таблица 5. Частота рецидива цервикальной интраэпителиальной неоплазии после конизации шейки матки
| | Отсутствие изменений по краю резекции
| Наличие изменений по краю резекции
| | Электроконизация
| 4,9%
| 31,9%
| | Ножевая конизация
| 4%
| 16%
| Таким образом, даже при отсутствии изменений по линии резекции, эффективность лечения CIN конизацией составляет 95,1 - 96%, что является сопоставимым с результатом лечения CIN III лазерной вапоризацией (эффективность 93,4%).
Не рекомендуемые виды лечения:
- Аблация шейки вместо конизации при CIN - I или II у пациентов с патологическими данными кольпоскопии. Исключения:
- Беременные
- Женщины с иммуносупрессией
- Подростки
- Применение подофиллина или содержащих его препаратов
- Гистерэктомия, как первичное лечение любой степени CIN
Беременность
- Цитологическое исследование шейки матки должно быть частью рутинного антенатального обследования
- Материал для цитологического исследования из шеечного канала берётся только палочкой с наконечником из ваты, выскабливание канала не рекомендуется
- Примерно 86% всей патологии шейки матки, встречающейся при беременности, относится к ПИП лёгкой степени, 14% - к ПИП тяжёлой степени
- Не существует доказательств, что CIN у беременных быстрее прогрессирует в рак в сравнении с небеременными пациентами
- У беременных с CIN - II и CIN - III в 60-70% случаев впоследствии происходит самостоятельное излечение, и не отмечено случаев рака шейки матки в послеродовом периоде
- Конизация шейки связана с осложнениями (кровотечение, преждевременные роды), часто бесполезна для диагностики и сопровождается высоким уровнем (до 47%) рецидива заболевания. Поэтому, конизация с диагностической целью проводится во II триместре только в случаях, где нельзя исключить инвазивную карциному шейки матки.
Рак шейки матки
Всемирная Организация Здравоохранения выделяет 3 гистологических вида эпителиальных опухолей шейки матки:
- Плоскоклеточный рак
- Аденокарцинома
- Другие эпителиальные опухоли, где определяются как элементы плоскоклеточного рака, так и аденокарциномы
На долю плоскоклеточного рака приходится около 75% всех цервикальных карцином, аденокарцинома эндоцервикса за последние 20 лет имеет устойчивую тенденцию к росту и ее частота составляет около 20% от всех раков шейки матки, другие эпителиальные опухоли встречаются в 5% случаев.
Стадии рака шейки матки (FIGO 1995 г)
Стадия 0 – интраэпителиальная (преинвазивная) карцинома (Carcinoma in situ)
Стадия I – карцинома ограничена шейкой матки
- I А – карцинома идентифицируется только микроскопически (при этом глубина инвазии не превышает 5 мм, а ширина не более 7 мм)
- I А1 – глубина инвазии не превышает 3 мм, а ширина не более 7 мм.
- I А2 – глубина не более 5 мм, ширина не более 7 мм.
(наличие опухолевых эмболов в венозных и/или лимфатических сосудах не влияет на стадию процесса, но оказывает влияние на лечебную тактику). - I В – инвазия опухоли больше, чем при стадии I А, но опухоль ограничена шейкой матки.
- I В1 – размер опухоли не более 4 см;
- I В2 – размер опухоли более 4 см.
Стадия II – опухоль распространяется за пределы шейки матки, но остается в пределах малого таза. Опухоль может распространяться на влагалище, не захватывая его нижнюю треть.
- II А – нет вовлечения в процесс параметрия
- II В – в процесс вовлечен параметрий.
Стадия III – Карцинома распространяется на нижнюю треть влагалища или на стенку таза.
- III A -Опухоль инфильтрирует нижнюю треть влагалища и/или имеются метастазы в придатках матки;
- III B -Рак инфильтрирует параметрий на одной или обеих сторонах до стенки таза, и/или имеются метастазы в региональных лимфоузлах (наружных и внутренних подвздошных, запирательных), и/или определяется гидронефроз всвязи со стенозом мочеточника.
Стадия IV – Опухоль распространяется за пределы таза или прорастает слизистую оболочку мочевого пузыря или прямой кишки.
- IV A - Рак прорастает мочевой пузырь и/или прямую кишку.
- IV B - Определяются отдаленные метастазы.
Методики, применяемые для установления стадии рака шейки матки:
- Ультразвуковое исследование шейки матки и подвздошных и парааортальных лимфоузлов
- Тазовая и парааортальная лимфоангиография
- Компьютерная томография и магнитно-ядерная томография тазовых и парааортальных лимфоузлов
- Рентгенография грудной клетки и трубчатых костей (пояснично-кресцовый отдел позвоночника)
- Цистоскопия
- Ректороманоскопия или колоноскопия
- Экскреторная урография
Следует помнить:
- все вышеперечисленные методики определения метастазов в лимфоузлы имеют значительное количество ложно-отрицательных результатов.
- окончательно стадия заболевания определяется только после хирургического вмешательства.
Лечение рака шейки матки
Преинвазивная карцинома
- Наиболее оптимальный способ ведения преинвазивной цервикальной карциномы – ножевая или лазерная конизация шейки матки. Применение данного метода лечения оправдано не только в репродуктивном возрасте, но и когда потребность в реализации генеративной функции утрачена. При отсутствии атипичных клеток по линии резекции и опухолевых эмболов в венозных и лимфатических сосудах эффективность данного метода лечения составляет 95 – 97%
- Далее за пациенткой необходимо проводить диспансерное наблюдение с кольпоскопией через 3 месяца и исследованием РАР – мазков 1 раз в 3 месяца в течение 2 лет. В дальнейшем при отрицательных результатах – ежегодный скрининг
- Если пациентка не заслуживает доверия врача, операцией выбора является тотальная абдоминальная гистерэктомия I типа. Удаление яичников зависит от возраста пациентки и их состояния во время операции
Стадия I А
- При инвазии в строму шейки матки менее 3 мм и диаметре опухолевого пятна менее 7 мм (микроинвазивная карцинома, стадия IA 1) в репродуктивном возрасте операцией выбора является конизация шейки матки (ножевая или лазерная)
- При инвазии более 3, но менее 5 мм и диаметре опухолевого пятна менее 7 мм (стадия IA 2) вопрос об объеме лечения открыт. Тактика ведения зависит от возраста, реализации генеративной функции, а также от наличия опухолевых эмболов в венозных и лимфатических сосудах:
- В молодом возрасте, при отсутствии опухолевых эмболов допустимо применение органосохраняющей операции – конизации шейки матки
- При нежелании больной реализовать в последующем генеративную функцию, а также при наличии опухолевых эмболов в венозных и/или лимфатических сосудах операцией выбора является тотальная абдоминальная гистерэктомия I и II типов. Удаление яичников зависит от возраста пациентки и их состояния во время операции.
Стадия I В
- Оптимальный способ лечения - комбинация лучевой терапии и гистерэктомии
- Гистерэктомия дополняется иссечением параметральной клетчатки и тазовых лимфоузлов – гистерэктомия III типа (операции Вертгейма, Мейгса)
- Вопрос о яичниках решается индивидуально, при сохранении их стараются фиксировать за пределами малого таза, чтобы снизить воздействие лучевой терапии
- При наличии экстрагенитальной патологии – сочетанная лучевая терапия
- В современной мировой литературе описаны органосохраняющие методики лечения I В1 стадии цервикальной карциномы. Применимы они у женщин детородного возраста, планирующих иметь, но не имеющих детей, и заключаются в широкой ножевой конизации шейки матки и иссечении тазовых лимфоузлов. Существует наблюдение, в котором молодая женщина, пролеченная таким способом, смогла забеременеть и родить ребенка
Стадии IIA и IIB
- Комбинация лучевой терапии и хирургического лечения
- Для стадии IIA хирургическое лечение применимо молодым женщинам без тяжелой экстрагенитальной патологии (радикальная гистерэктомия III типа), остальным показана лучевая терапия
- В стадии IIB производится лапаротомия для оценки состояния парааортальных лимфоузлов; основной метод лечения сочетанная лучевая терапия
- Парааортальные лимфоузлы поражаются в 15% случаев стадии II, в тоже время на сегодня до конца не ясно, влияет ли проведение лучевой терапии в области этих узлов на выживаемость больных РШМ
Стадии III А и III В
- Лечение производится только методом лучевой терапии
- Рекомендуется лапаротомия перед началом лучевой терапии для оценки состояния лимфоузлов
- Метастазы в парааортальные лимфоузлы встречаются в 35 – 50% случаев
Стадия IV
- Дистанционная лучевая терапия – основной метод лечения
- В случае нахождения опухоли в пределах малого таза производится экзэнтерация – удаление внутренних гениталий, мочевого пузыря и/или прямой кишки
- Симптоматическое лечение
Таблица 6. Сравнительный анализ хирургического и лучевого методов лечения рака шейки матки IB / IIA стадий
|
| Хирургический метод
| Лучевой метод
| | 5-ти летняя выживаемость
| 85%
| 85%
| | Осложнения
| Урологические свищи – 1-2%
| Стриктуры и свищи кишечника и мочевых путей – 1,4-5,3%
| | Влагалище
| Укорачивается
| Фиброз и стеноз
| | Яичники
| Могут быть сохранены
| Разрушаются
| | Осложнения от лечения
| Атония мочевого пузыря – 3%
| Радиационный фиброз кишечника и мочевого пузыря – 6-8%
| | Контингент пациенток
| Пациентки моложе 65 лет, весом менее 85 кг, при отсутствии экстрагенитальной патологии
| Все пациентки
| | Летальность
| 1%
| 1%
эмболия легочной артерии при внутриполостной терапии
| Наиболее распространенные осложнения хирургического вмешательства:
Во время операции
- Кровотечение
- Эмболия легочной артерии
Ранние послеоперационные
- Раневая инфекция
- Расхождение швов
Поздние послеоперационные
- Пузырные свищи
- Мочеточниковые свищи
- Лимфоцисты
- Атония мочевого пузыря
- Пиелонефрит
Послеоперационная заболеваемость по некоторым данным может достигать 15%, но при улучшении техники операции снижается до 5%.
Наиболее распространенные осложнения от лучевой терапии:
- Анорексия
- Тошнота
- Потеря веса
- Диарея
- Дизурия
- Цистит.
В связи с применением современной техники облучения, позволяющей направить максимальную энергию в пораженную область, частоту этих осложнений удалось снизить с 8,2% до 1,5%.
Наблюдение после лечения:
- Рецидив возникает в 50% случаев в течение 1 года, а в 80% - в течение 2 лет
- В течение 2 лет каждые 3 месяца и в следующие 3 года каждые 6 месяцев необходимо проводить обследование, включающее бимануальное исследование и оценку лимфоузлов, в том числе и надключичных
- При каждом плановом осмотре необходимо провести цитологическое исследование шейки/влагалища, так как у 70% женщин с рецидивами в области малого таза оно даёт положительный результат
- Ежегодно с целью диагностики метастазов в легкие следует проводить рентгенологическое исследование грудной клетки
- Компьютерная томография брюшной полости и таза с применением внутривенного контраста показана при наличии пальпируемых масс в области малого таза и подозрении на блокаду мочеточников
- Для подтверждения рецидива заболевания возможна пункционная биопсия под контролем зрения
Рецидив заболевания
Обнаружение опухоли более чем через 6 месяцев от начала лечения.
- Центральный (в малом тазу)
- Нецентральный (вне малого таза)
При выявлении рецидива необходимо произвести:
- Пересмотр стадии заболевания
- Разностороннюю биопсию лимфоузлов
- Возможно проведение лапаротомии при центральном рецидиве
При центральном рецидиве производится тазовая экзэнтерация.
При нецентральном рецидиве основным методом лечения является химиотерапия. Наиболее популярна методика монохимиотерапии цисплатином в дозировке от 50 мг/м 2 до 100 мг/м 2. С
|









