
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ближайшие к ядру электронные оболочки атомовСодержание книги
Поиск на нашем сайте При рассмотрении простейших электронных оболочек атомов “бросается в глаза” точное соответствие результатов расчетов, получаемых из обычных резонансных условий (1), имеющимся экспериментальным данным. Как известно, это в первую очередь относится к расчету атома водорода [2]. В электронной оболочке водорода единственный электрон испытывает на себе силу притяжения ядра, в противовес которой действует центробежная сила. Это равенство сил определяет величину кинетической энергии электрона:
Из выражений (1) и (3) находим возможные значения радиуса орбиты
При n =1 радиус принимает наименьшее значение, равное “радиусу Бора”. В полном соответствии с теоремой о вириале, кинетическая энергия (3) оказывается равной половине абсолютной величины отрицательной потенциальной энергии электрона. Поэтому полная энергия электрона является также отрицательной величиной, численно равной кинетической энергии
С учетом (4) полная энергия электрона принимает дискретные значения:
Этот результат в свое время помог разобраться со спектром водорода. При этом наименьшая энергия (6) при n =1 оказалась точно равна известной величине потенциала ионизации атома водорода 13,6 эВ. Такие простые и точные расчеты возможны и в ряде других случаев. В частности, полное соответствие расчетного значения потенциала ионизации для последнего электрона с экспериментальными данными имеет место у всех атомов, имеющих в общем случае заряд ядра ze
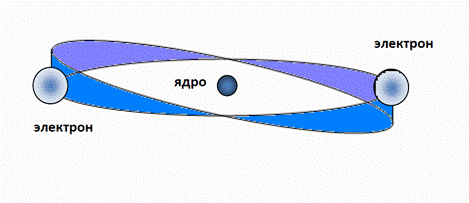
Например, экспериментальное значение потенциала ионизации последнего (десятого) электрона атома неона равно 1360,2 эВ [3]. В отличие от атома водорода, где электрон располагается в одном из максимумов резонанса, в атоме гелия электронная оболочка также имеет один период n =1, но содержит два электрона, которые занимают обе пучности резонанса, располагаясь с разных сторон от ядра (рис. 1). Заметим, что свойства гелия как инертного газа определяются как раз этим обстоятельством – в электронной оболочке гелия нет свободного места для присоединения других электронов (обе пучности резонанса заняты электронами).
Рис. 1. Схематическое изображение атома гелия. Радиус электронной оболочки гелия почти в два раза меньше, чем у атома водорода, так как электроны испытывают на себе большую притягивающую силу со стороны ядра гелия, заряд которого равен двум зарядам электрона. Проведем расчет, исходя из баланса сил, действующих на электроны оболочки - электростатической (центростремительной) и центробежной
Учитывая условие резонанса (n =1)
и приравнивая друг другу разнонаправленные силы (8), получаем:
Электроны располагаются симметрично относительно ядра и поэтому имеют одинаковую энергию. Однако в процессе ионизации, когда из атома в результате внешнего воздействия удаляется один из электронов, второй электрон одновременно с этим приближается к ядру и отдает часть своей энергии вылетающему из атома электрону. За счет этого потенциал ионизации первого электрона несколько уменьшается. Но когда происходит второй акт ионизации (удаление из атома второго электрона), то затраты энергии возрастают на ту же величину “добавки”, которая была сообщена первому электрону. Поэтому, чтобы не заниматься таким “перераспределением” энергии, сравнение расчетов с экспериментальными данными удобно производить, используя суммарные величины потенциалов ионизации электронов. Анализируя атом водорода, мы убедились, что потенциал ионизации численно соответствует кинетической энергии электрона. Принимая это в расчет, из (9) и (10) получаем кинетическую энергию каждого из электронов атома гелия (условную величину потенциала ионизации):
Следовательно, удвоенная расчетная величина (11) должна быть равна сумме двух реальных потенциалов ионизации атома (при последовательном удалении сначала первого электрона, а затем второго электрона). Расчетная сумма двух потенциалов ионизации, таким образом, равна 83,3 эВ, а сумма экспериментальных значений равна 24,58+54,4≈79 эВ. Можно сказать, что полученная точность для такого элементарного расчета является более чем удовлетворительной, но не “идеальной”, как это было в случаях с единственным электроном в оболочке. Но, может быть, это случайный результат? У нас есть возможность это проверить, так как самая близкая к ядру электронная оболочка у всех остальных атомов, также как и электронная оболочка гелия, состоит из двух электронов (n =1). Аналогично расчетам электронной оболочки гелия, но положив в общем случае заряд ядра равным z е, получаем формулы для радиуса электронной оболочки и для суммы потенциалов ионизации двух электронов оболочки:
Расчеты и экспериментальные данные [3] сведены в таблице 1. Таблица 1 Параметры ближайшей к ядру электронной оболочки (из двух электронов)
Из таблицы 1 следует (графа расчет/факт), что при увеличении заряда ядра относительное отличие между результатами расчетов потенциалов ионизации и соответствующими экспериментальными данными уменьшается (с 5,44% до 1,18%). То есть, расчетные величины становятся ближе к фактическим. Обращает на себя внимание то, что оболочки из двух электронов располагаются очень близко к ядру (уже у десятого элемента периодической таблицы Д.И.Менделеева - атома неона радиус оболочки составляет 0,054Ǻ).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-19; просмотров: 165; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |

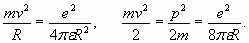 (3)
(3)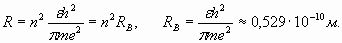 (4)
(4)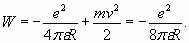 (5)
(5)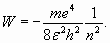 (6)
(6)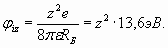 (7)
(7)
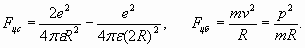 (8)
(8)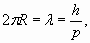 (9)
(9)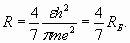 (10)
(10)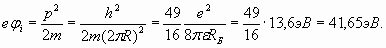 (11)
(11)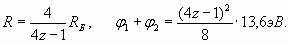 (12)
(12)


