Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
От классических моделей атома К квантовой модели.Содержание книги
Поиск на нашем сайте
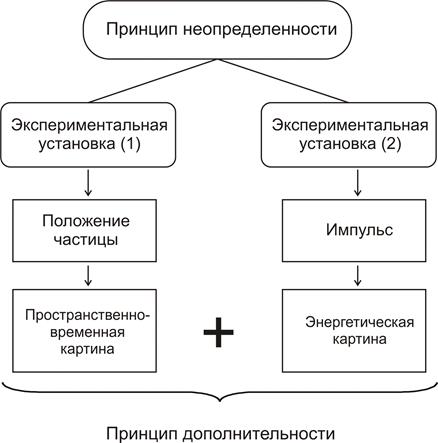
Открытиемикромира. В 1897 г. был обнаружен электрон, масса которого оказалась намного меньше массы атома. Открытие радиоактивности показало, что атомы могут распадаться с выделением излучения и энергии. Под давлением этих фактов рухнула древняя идея о неделимости атома. Но если атом непрост, то какова его структура? Размышляя над этой проблемой, ученые стали предлагать различные модели. Атом как «булка с изюмом». Первая модель атома была построена английскими физиками В. Томсоном и Дж. Томсоном к 1903 г. Здесь положительный заряд равномерно заполнял всю сферу атома. Внутри ее пребывало множество электронов с отрицательным зарядом, которые покоились или двигались вокруг центра. При устойчивом состоянии атома электроны располагались концентрическими слоями. Несмотря на наивность такой модели, представление о слоистом расположении электронов оказалось перспективным. Планетарная модель атома. Японский физик Нагаока в 1904 г. пришел к выводу, что атом по своему строению напоминает Солнечную систему, где вокруг положительного ядра вращается кольцо, состоящее из большого числа электронов. Но признание такого движения делает атом неустойчивым, что противоречит очевидным фактам. Вот почему эта модель сначала не привлекла должного внимания физиков. В 1909-1910 гг. в лаборатории английского физика Э. Резерфор да (1871-1937) провели опыты по рассеянию α-частиц (положительно заряженные атомы гелия) тонким слоем вещества. Обнаружились факты больших отклонений и даже отбрасываний назад α-частиц от неких центров с положительным электрическим зарядом. Все это говорило о наличии положительного ядра атома. Резерфорд разработал новый вариант планетарной модели. В центре атома расположено ядро с размерами порядка 10-13 см. Вокруг него вращаются электроны, число которых таково, что общий заряд атома равен нулю. И это число равно порядковому номеру элемента в периодической системе Менделеева. Против планетарной модели были выдвинуты возражения. Согласно электродинамике вращающиеся электроны должны непрерывно излучать электромагнитные волны, терять энергию и падать на ядро, что ведет атом к неустойчивости. Однако этого в природе не наблюдается. Кроме того, модель не могла объяснить вид эмпирически установленных атомных спектров. Квантовая модель атома. В 1913 г. датский физик Н. Бор внес в планетарную модель принципиально новые идеи, выходящие за пределы классической физики. Они получили название постулатов Бора. Каждый электрон может совершать устойчивое движение по определенной орбите, не испуская и не поглощая электромагнитного излучения. Если электрон переходит с одной орбиты на другую, то он испускает или поглощает определенную порцию энергии, величина которой кратна кванту hv. Такой переход не является постепенным и представляет собой квантовый скачок. При поглощении атомом излучения электрон переходит с внутренней, более близкой к ядру, орбиты на внешнюю, более далекую от ядра. При обратном переходе атом излучает фотоны с квантами энергии. Факты подтверждают квантовую модель. Теория Бора удовлетворительно объяснила спектр водорода. Ее подтвердили опыты Франка и Герца по ионизации паров ртути ударами электронов. Если энергия последних была меньше некоторого критического значения, удары оказывались упругими. Когда энергия электронов достигала критического значения, удары становились неупругими, энергия полностью передавалась атомам ртути, они возбуждались и начинали излучать. Квантовая закономерность – стационарные состояния атома и квантовые скачки при переходах между ними – проявлялась здесь весьма явно. Квантовая модель объясняет периодическую таблицу Менделе ева. Квантовая теория Бора помогла представить строение сложных атомов. Любой атом представляет собой систему, образованную в результате последовательного присоединения электронов к ядру. Ядро имеет положительный заряд, равный Ze, где Z - порядковый номер элемента в таблице Менделеева, е - заряд электрона. При Z= 1 имеется атом водорода, а если Z=2, налицо атом гелия. Два электрона заполняют первую оболочку (К), следующие восемь электронов образуют Z-оболочку. М-оболочка также содержит восемь электронов. Затем следуют оболочки из 18-ти и 32-х электронов. Таким образом, то, что гениально угадал Менделеев, Бор объяснил теоретически, с помощью квантовых принципов. И все же теория Бора не объясняла того, откуда следуют определенные количества электронов в оболочках (2, 8, 16, 32). Этот пробел заполнил швейцарский физик В. Паули (1900-1958). Принцип Паули, спин и квантовые числа. Исследуя факты раздвоения спектров щелочных металлов, Паули в 1925 г. выдвинул гипотезу о том, что электрон на орбите может находиться в двух состояниях. Некоторые физики предложили связать их со спином (англ. spin - вращаться) как вращением электрона вокруг своей оси. Позднее выяснилось, что такого чисто механического движения не существует, спин же характеризует две ориентации момента импульса и магнитного поля. Гипотеза Паули о двузначности электрона обрела ясный смысл, что подтвердили опыты Штерна и Герлаха. С этого времени спин стали выражать двумя квантовыми числами, а полное состояние электрона в атоме - четырьмя квантовыми числами. И здесь Паули предложил принцип, согласно ему в атоме не может быть двух или более электронов, для которых значения всех четырех квантовых чисел одинаковы. Отсюда становилась понятной периодичность заполнения электронных оболочек. Если главное квантовое число (n), соответствующее порядковому номеру элемента периодической таблицы, равно единице, то возможны только два состояния электрона в атоме и оболочку К заполняют два электрона. Для n = 2 число различных состояний равно восьми и оболочку Z заполняют восемь электронов и т. д. Периодическая система Менделеева получила полное теоретическое объяснение. Принцип неопределенности. Квантовая механика строилась в двух формах и двумя разными методами. Де Бройль и Шредингер за основу взяли идею волнового процесса, которая во многом соответствовала представлениям классической физики. Другим путем пошел немецкий физик В. Гейзенберг (1901-1975). Теорию атома Бора он оценил как полуклассическую и решил ее развить в строго неклассическом или чисто квантовом (дискретном) направлении. Такие элементы модели как: траектория движения электрона, электрон в виде точечноподобной частицы и т.п. должны играть сугубо вспомогательную роль. За основу следует взять соотношения между величинами, которые непосредственно измеряются в опытах – частота излучения спектров, их интенсивность и т. п. «Ненаблюдаемые» же свойства в виде траектории движения электрона, скорости его движения и т.п. должны быть исключены из теории. Немецкие физики М. Борн (1882-1970) и П. Иордан показали, что идеям Гейзенберга соответствует математический аппарат в виде матричной алгебры. Как прямоугольная таблица со своими правилами матрица позволяет наилучшим образом выразить дискретный характер соотношений между величинами. Основным элементом матричного формализма стала пара таких сопряженных величин как пространственная координата микрообъекта и его импульс. В 1927 г. в ряде мысленных экспериментов Гейзенберг оценил эту парную связку с точки зрения возможного измерения и получил соотношение неопределенностей: Δх·Δр=h, где Δх – неопределенность измерения координаты, Δр – неопределенность измерения импульса, h – постоянная Планка. Не надо гнаться сразу за двумя зайцами. Принцип неопределенности утверждает, что невозможно одновременно получить точную информацию о положении объекта и его импульсе. Или другими словами, произведение неопределенностей в оценке положения и импульса должно быть не больше постоянной Планка. Соотношение неопределенностей Гейзенберг объяснял тем, что микрообъекты обладают корпускулярными и волновыми свойствами, и этот дуализм не позволяет провести одновременные точные измерения. Кроме того, измерение микрообъекта с помощью других микрообъектов существенно изменяет свойства первого. Так, при изучении электрона частью экспериментальной установки выступают другие электроны или фотоны, и они оказывают сильное воздействие на исследуемый электрон. Роль ученого в микромире игнорировать нельзя. Эту мысль поддержал Бор. В микромире ученый не может наблюдать явления, не создавая при этом возмущения. Отсюда невозможно точное знание поведения микрообъектов, здесь следует довольствоваться вероятностными предсказаниями. Принцип неопределенности вынуждает пересмотреть классическую версию объективности, согласно которой объект исследования не зависит от экспериментального измерения (наблюдения). Состояние исследуемых микрочастиц существенно определяется тем, каким способом ученый наблюдает их. Этот способ включает не только приборы, но и теорию. «То, что мы наблюдаем, – это не сама природа, а природа, которая выступает в том виде, в каком она выявляется благодаря нашему способу постановки вопросов» (Гейзенберг). Таким образом, экспериментатор-наблюдатель в некотором смысле создает изучаемую реальность и этот вклад выражает принцип неопределенности. Принцип дополнительности. Соотношение неопределенностей Бор осмыслил в рамках более широкого принципа дополнительности. Он исходил из уже признанного корпускулярно-волнового дуализма. Здесь возможна ситуация взаимоисключения, так как микрообъект не может в одно и то же время быть и частицей, ограниченной в малом объеме, и волной, распространяющейся в большом объеме. Избежать противоречивого представления позволяет принцип неопределенности, который указывает границы применения волновой и корпускулярной картин. О частицах лучше говорить там, где налицо стационарные состояния. Там же, где речь идет об излучении атома, целесообразно пользоваться понятиями волновой механики типа «стоячая волна вокруг ядра». Они дают достаточно полную информацию об изменяющемся распределении зарядов в атоме. Волновая и корпускулярная картины дополняют друг друга и в переходах ученого между ними путеводителем выступает принцип неопределенности. Сначала измерять одного «зайца», затем другого. Принцип дополнительности указывает на необходимость двух разных экспериментальных установок. Если мы измеряем положение частицы с большой точностью, то в это же время мы не можем получить точные сведения о ее импульсе. Стало быть, нужны два отдельных измерения, чтобы потом сложить их в общую картину. Пространственно-временное описание дает информацию о положении микрообъекта, причинное же описание, связанное с другой приборной установкой, приводит к точному знанию импульса. Дополняя друг друга, два данных измерения дают необходимую полноту.
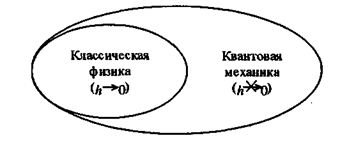
Копенгагенская интерпретация или классическое понимание квантовой физики? Волновая механика и матричная механика оказались математически эквивалентными формализмами. Но вот их содержательное понимание оформилось в два полярных направления. Одно из них ориентировалось на мировоззренческую картину классической физики. Эйнштейн, де Бройль, Шредингер, Лоренц, М. Лауэ (Германия) и Д. Бом (США) выступили за то, чтобы сохранить в физике: а) идею объекта, полностью не зависящего от ученого; б) представление о непрерывных траекториях и волнах; в) лапласовский детерминизм с его гарантией точного знания следствий. Де Бройль и Шредингер полагали, что волновая механика естественно вписывается в классическую физику. Эйнштейн и другие доказывали ущербность и незавершенность квантовой теории. Другое направление получило название «копенгагенской школы», так как лидером здесь был Бор, проживавший в столице Дании – Копенгагене. Бор и его сторонники утверждали, что квантовая механика является завершенной и настоящей теорией. Здесь выявилось подлинное значение ученого как активного участника познания. Его влияние на исследуемый микрообъект через приборы и методы нельзя игнорировать, что и зафиксировали принципы неопределенности и дополнительности. Объект микромира нельзя отделить от исследователя, как это делалось в классической физике. И в то же время здесь нет и речи о каком-либо субъективном идеализме, ибо все естествоиспытатели признают, что «природа была до человека, но человек был до естествознания» (К. фон Вейцзеккер). По мнению Гейзенберга, квантовая теория учитывает особую специфичность микромира, ибо «в экспериментах с атомными процессами мы имеем дело с вещами и фактами, которые столь же реальны, сколь реальны любые явления повседневной жизни. Но атомы или элементарные частицы реальны не в такой степени. Они образуют скорее мир тенденции или возможности, чем мир вещей и фактов». Вероятностная парадигма. Копенгагенская школа доказала неклассический характер квантовой механики. Ключевым элементом в ней выступает волновая функция, которую Шредингер считал размазанным зарядом электрона. Но в 1926г. Борн предложил вероятностное толкование этой функции. По его мнению, волновая функция не представляет собой никакого физического объекта или явления и имеет лишь статистический смысл, заключающийся в том, что она выражает плотность вероятности пребывания микрообъекта в данном месте пространства. Такая трактовка получила широкое признание и стала почти общепринятой. Итак, квантовая механика в сути своей оказалась неклассической. Индетерминизм. Копенгагенская школа признала статистичность сущностью квантовой теории. Бор и Гейзенберг говорили об индетерминизме микропроцессов в том смысле, что классическая причинность в них не действует. Лапласовский детерминизм утвердил динамические законы, где состояние отдельного тела (вещи, частицы) из настоящего времени строго и однозначно определяет его будущие состояния. Таких идеализированных законов в микромире не оказалось. Даже один отдельный микрообъект пребывает в таких состояниях, которые выражаются волновой функцией со статистическим смыслом. Этот вероятностный характер вытекает из корпускулярно-волнового дуализма и соотношения неопределенностей. Функция ψ определяет вероятность того, как проявит себя микрообъект при взаимодействии с приборной установкой. Детерминизм или тоска по классической физике. Против индетерминизма выступили «классицисты». Все они демонстрировали прочность старых мировоззренческих убеждений. По мнению Планка, познание закономерности природы невозможно без принципа причинности. Если множество микрообъектов подчиняется статистическим законам, то поведение одной или двух частиц должно происходить по динамическим причинным законам. До них современная квантовая механика еще не дошла. В таком же духе высказывается Эйнштейн, полагая, что природа, как и Бог, не играет в кости, если в наличии имеется малое количество частиц. Бом предложил существование «скрытых параметров», обнаружение которых вернет будущей физике детерминизм. Все попытки построения такой теории оказались безрезультатными. Победа индетерминизма или вероятностно-статистического подхода. В ходе бурных дискуссий о природе квантовой механики победила копенгагенская школа. Бор и его сторонники убедили физическое сообщество в том, что неклассичность квантовой теории, сконцентрированная в статистическом индетерминизме, обусловлена корпускулярно-волновым дуализмом, соотношением неопределенности и взаимодействием исследуемых объектов с приборами. Принцип соответствиякак е динство новых гипотез со старыми теориями. Бор указал на связь квантовой механики с классической физикой. Первая теория является более общей и фундаментальной, ибо учитывает тонкие явления, соразмерные постоянной Планка. Для макроявлений величина h становится несущественной (равной нулю) и квантовая механика переходит в классическую физику как в свою предельную и частную форму. Принцип соответствия определил своеобразное разделение: если квантовая теория описывает поведение микрообъекта, то классическая физика представляет модель экспериментальной макроустановки. Здесь проявляется принцип дополнительности.
|
||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 91; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.171.121 (0.015 с.) |