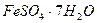Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Анализ железа ( II) сульфата.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В медицинской практике применяют железа (II) сульфат FeSO4.
Качественные реакции на катион железа (II): 1. Реакция образования синего осадка турнбулевой сини при действии раствором гексацианоферрата (III) калия. 2. Реакция с сульфид-ионами; образуется черный осадок сульфида. 3. Реакция с диметилглиоксимом в аммиачном растворе; образуется устойчивое комплексное соединение красного цвета, растворимое в воде. Сульфат-ион обнаруживают по реакции с раствором хлорида бария.
Для количественного определения используют перманганатометрию, цериметрию. Для определения общего содержания железа в лекарственных средствах или установления его примеси может быть использована атомно-абсорбционная спектрофотометрия, отличающаяся высокой эффективностью и чувствительностью. Железа (II) сульфат хранят в хорошо укупоренных банках в сухом месте, чтобы не допустить потери кристаллизационной воды. Он может также окисляться во влажном воздухе с образованием основной соли Fe2(OH)4SO4. При 64 °С железа (II) сульфат плавится в своей кристаллизационной воде. Применение лекарственных препаратов железа обусловлено важной ролью, которую играет этот элемент в процессах кроветворения. Поэтому их используют в комплексной терапии гипохромных (железодефицитных) анемий. Назначают железа (II) сульфат внутрь по 0,05 – 0,3 г. Лекарственным препаратом железа в сочетании с сахарами является феррум лек (Ferrum Lek). Он содержит соответственно 0,1 г железо (III)-иона в виде комплекса с мальтозой в 2 мл ампулированного раствора (для внутримышечных инъекций) или 0,1 г железа сахарата в 5 мл ампулированного раствора (для внутривенного введения). Применяют для лечения гипохромных анемий.
Лабораторная работа: Фармацевтический анализ препаратов MgSO4, ZnO. Цели лабораторного занятия: 1. Научиться проводить фармацевтический анализ неорганических препаратов магния и цинка. 2. На основании предложенной нормативной документации произвести полный фармацевтический анализ препаратов магния сульфата, цинка оксида. 3. На основании комплекса всех проведенных исследований сделать вывод о соответствии лекарственных средств НД. Фармакопейная статья Магния сульфат Magnesii sulfas Magnesium sulfuricum Sal amarum Горькая соль MgSO4∙7H2O M. в. 246,48 Описание. Бесцветные призматические кристаллы, выветривающиеся на воздухе, горько-соленого вкуса. Растворимость. Растворим в 1 ч. воды, 0,3 ч. кипящей воды, практически нерастворим в 95% спирте. Подлинность. Препарат дает характерные реакции на магний и на сульфаты. Прозрачность и цветность раствора. 2 г препарата растворяют в 20 мл воды. После пятиминутного кипячения раствор должен быть прозрачным и бесцветным. Щелочность или кислотность. К 5 мл этого раствора прибавляют 5 мл воды и 2 капли раствора фенолфталеина; раствор должен быть бесцветным. Розовое окрашивание должно появиться от прибавления не более 0,1 мл 0,01 Н раствора едкого натра. Хлориды. 5 мл того же раствора, разведенные водой до 10 мл, должны выдерживать испытание на хлориды (не более 0,004% в препарате). Тяжелые металлы. 10 мл того же раствора должны выдерживать испытание на тяжелые металлы (не более 0,0005% в препарате). Железо. 1,5 г препарата растворяют в 10 мл воды. Раствор должен выдерживать испытание на железо (не более 0,002% в препарате). Марганец. 1,25 г препарата растворяют в 5 мл воды, добавляют 0,5 мл концентрированной серной кислоты, 5 капель 0,1 н. раствора нитрата серебра и нагревают до кипения. Затем прибавляют 5 мл 20% раствора персульфата аммония и снова нагревают до кипения. Параллельно ставят контрольный опыт с 5 мл воды и теми же реактивами. Охлаждают оба раствора и переносят в две одинаковые пробирки. В пробирку с контрольным раствором добавляют из микробюретки 0,01 н раствор перманганата калия до тех пор, пока окраска не сравняется с окраской испытуемого раствора. Сравнение окрасок производят на листе белой бумаги по оси пробирок. 1 мл 0,01 Н раствора перманганата калия соответствует 0,00011 г марганца, которого в препарате должно быть не более 0,004%. Примечание. Препарат, применяемый для инъекций, не должен содержать марганца. Потеря в весе при прокаливании. Около 1 г препарата (точная навеска) сушат при 100 – 105° в течение 2 – 2,5 часов, затем осторожно прокаливают при температуре слабо красного каления до постоянного веса. Потеря в весе должна быть не менее 48% и не более 52%. Мышьяк. 0,25 г препарата должны выдерживать испытание на мышьяк, (не более 0,0002% в препарате). Количественное определение. Около 0,15 г препарата (точная навеска) растворяют в 50 мл воды, прибавляют 5 мл аммиачного буферного раствора и титруют при энергичном перемешивании 0,05 М раствором трилона Б до синего окрашивания (индикатор – кислотный хром черный специальный). Параллельно проводят контрольный опыт. 1 мл 0,05 М раствора трилона Б соответствует 0,01232 г MgSO4∙7Н2О, которого в препарате должно быть не менее 99,0% и не более 102,0%. Хранение. В хорошо укупоренной таре. Фармакопейная статья Цинка оксид Zinci oxydum
Zincum oxydatum ZnO M. в. 81,37 Описание. Белый или белый с желтоватым оттенком аморфный порошок без запаха. Поглощает углекислоту воздуха. Растворимость. Практически нерастворим в воде и спирте, растворим в растворах щелочей, разведенных минеральных кислотах, а также вуксусной кислоте. Подлинность. 0,05 г препарата растворяют в 2 мл разведенной хлористоводородной кислоты и добавляют 8 мл воды. Полученный раствор дает характерные реакции на цинк. При прокаливании препарат окрашивается в желтый цвет, а при охлаждении – снова белеет. Щелочность. 1г препарата смешивают с 10 мл горячей воды, добавляют 2 капли раствора фенолфталеина. При появлении розового окрашивания на обесцвечивание раствора должно расходоваться не более 0,3 мл 0,1 н. раствора хлористоводородной кислоты. Карбонаты и нерастворимые примеси. К 0,5 г препарата прибавляют 5 мл разведенной хлористоводородной кислоты; не должны выделяться пузырьки газа. Полученный раствор должен быть прозрачным и бесцветным. Железо, медь и алюминий. К полученному выше раствору прибавляют 10 мл раствора аммиака; раствор должен быть бесцветным и прозрачным. Свинец. 2 г препарата растворяют в 25 мл разведенной уксусной кислоты (если нужно, фильтруют), прибавляют 5 капель раствора хромата калия; раствор должен оставаться прозрачным. Потеря в весе при прокаливании. Около 1 г препарата (точная навеска) прокаливают до постоянного веса. Потеря в весе не должна превышать 1 %. Мышьяк. 0,25 г препарата должны выдерживать испытание на мышьяк (не более 0,0002% в препарате). Количественное определение. Около 0,7 г препарата (точная навеска) помещают в мерную колбу емкостью 100 мл, растворяют в 50 мл разведенной хлористоводородной кислоты и доводят объем раствора водой до метки. 10 мл полученного раствора переносят в колбу емкостью 250 мл, нейтрализуют раствором аммиака в присутствии 1 капли раствора метилового красного, прибавляют 5 мл аммиачного буферного раствора, 90 мл воды и титруют 0,05 М раствором трилона Б до синего окрашивания (индикатор – кислотный хром черный специальный). 1 мл 0,05 мол раствора трилона Б соответствует 0,004069 г ZnO, которой в препарате должно быть не менее 99,0%. Хранение. В хорошо укупоренной таре.
Вопросы для самоподготовки: 1. Охарактеризуйте свойства (внешний вид, растворимость) лекарственных веществ группы магния (магния окись, магния сульфат). Напишите общие и частные реакции, характеризующие подлинность данных препаратов. 2. Перечислите условия проведения комплексонометрического метода количественного определения для препаратов группы магния. Укажите причину возможных отклонений в количественном содержании препаратов группы магния в связи с их изменением из-за неправильного хранения. 3. Обоснуйте, почему для цинка оксида ГФ регламентирует показатель потери массы при прокаливании. 4. Объясните, почему водные растворы цинка сульфата, меди сульфата, железа сульфата имеют кислую реакцию среды? Напишите уравнения реакций. 5. Приведите общие реагенты, которые можно применить для определения подлинности лекарственных веществ изучаемой группы. Приведите уравнения реакций. 6. Напишите уравнения специфических реакций, с помощью которых можно определить подлинность соединений цинка, серебра, меди, железа. 7. Какой общий реагент используют для доказательства наличия ионов цинка и при определении соединений цинка в ЛС как примеси? Какой ион мешает определению примеси соединений цинка в ЛС, как его устраняют? Напишите уравнения реакций. 8. Дайте обоснование применения кислоты сульфосалициловой в качестве реактива для определения примеси соединений железа в ЛС. Почему данный реактив не применяют для определения подлинности железа (II) сульфата? 9. Почему водные растворы колларгола и протаргола не дают реакции на ион серебра? Какими реакциями можно доказать наличие атомов серебра и белка в этих препаратах? Напишите уравнения реакций. 10. Назовите методы количественного определения меди сульфата и железа (II) сульфата по НД. Дайте им обоснование и напишите соответствующие уравнения реакций. 11. Дайте обоснование предварительного проведения минерализации при количественном определении протаргола и колларгола. Укажите условия проведения минерализации. Напишите уравнения реакций количественного определения.
|
||||||||||
|
Последнее изменение этой страницы: 2021-04-20; просмотров: 672; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.176.238 (0.007 с.) |