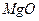Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Занятие № 9: Фармацевтический анализ препаратов соединений
Магния, цинка, меди, серебра, железа.
Препараты магния. Анализ препаратов магния.
Магния оксид и магния сульфат различаются по физическим свойствам. Магния оксид (MgO) практически нерастворим в воде (свободной от примеси углекислого газа) и в этаноле, но растворим в разведённых кислотах. Магния сульфат (MgSO4) легко растворим в воде, практически нерастворим в этаноле. Перед испытаниями на подлинность магния оксид предварительно растворяют в разведенных кислотах.
Качественные реакции на ион магния: 1. Реакция с динатрия гидрофосфатом и раствором аммиака. Образуется нерастворимый в воде, но растворимый в уксусной кислоте белый кристаллический осадок фосфата магния-аммония. Осадок выпадает при добавлении к раствору соли магния. К реакционной смеси необходимо прибавлять раствор хлорида аммония (до рН 9) во избежание образования в щелочной среде аморфного осадка гидроксида магния Mg(OH)2. 2. Осаждение Mg2+ из растворов в хлористоводородной кислоте избытком гидроксида натрия. Образующийся гидроксид магния представляет собой белый студенистый осадок, нерастворимый в избытке раствора гидроксида натрия. 3. Реакция с хинализарином (1,2,5,8-тетраоксиантрахинон) в щелочной среде. Образуется малорастворимое соединение синегоцвета. 4. Реакция с 8-оксихинолином (при рН 9 – 12). В результате реакции образуется флуоресцирующий зелёным светом оксихинолинат магния. 5. Реактивами на ион магния являются дифенилкарбазид, титановый жёлтый, магнезоны I и II. Последние используют для количественного фотометрического определения магния. В магния сульфате устанавливают наличие сульфат-иона: при взаимодействии с бария хлоридом выпадает белый осадок.
Соединения магния количественно определяют прямым комплексонометрическим методом титрования. Соединения магния хранят в хорошо укупоренной таре, так как магния оксид взаимодействует с углекислым газом и влагой, содержащимися в воздухе, образуя примесь карбоната и гидроксида магния. Магния сульфат в плохо укупоренной таре постепенно теряет кристаллизационную воду.
Магния оксид применяют при повышенной кислотности желудочного сока. Магния сульфат проявляет слабительный эффект при приеме внутрь больших доз (10 – 30 г). При парентеральном введении 20 – 25%-ных растворов магния сульфат оказывает успокаивающее действие, поэтому его назначают в качестве седативного, противосудорожного, спазмолитического средства. Соединения цинка. Анализ препаратов цинка.
Цинка оксид (ZnO) практически нерастворим в воде, но растворим в растворах кислот, щелочей и аммиака. Цинка сульфат (ZnSO4) очень легко растворим в воде с образованием растворов, имеющих кислую реакцию. Оба вещества практически нерастворимы в этаноле. Цинка оксид при прокаливании желтеет, при охлаждении принимает прежнюю окраску. Это специфическое свойство, обусловленное односторонней деформацией кристаллов ZnO, позволяет отличать его от других оксидов и солей. Соединения цинка проявляют амфотерные свойства. При растворении в разведенных минеральных кислотах цинка оксид образует соли, а в избытке растворов гидроксидов щелочных металлов растворимые в воде гидроксокомплекс. Гидроксид цинка растворим также в избытке раствора аммиака с образованием комплексной соли. Перед испытанием на подлинность цинка оксид превращают в соль, растворяя в разведенной серной кислоте.
Качественные реакции на ион цинка: 1. Реакция с сульфидами. Образуется белый осадок сульфида цинка, нерастворимый в уксусной кислоте и легко растворимый в разведенной хлористоводородной кислоте. Эта реакция позволяет отличать цинк от других тяжелых металлов, образующих сульфиды черного цвета. 2. Реакция с раствором калия гексацианоферрата (II). В результате образуется белый гелеобразный осадок. Осадок нерастворим в разведенных кислотах, растворим в растворах щелочей.
3. Реакция с аммония тетрароданомеркуратом (II) в слабокислой среде; образуется белый кристаллический осадок. 4. Реакция с дитизоном даёт дитизонат цинка, окрашенный в щелочной среде в красный цвет. 5. Специфичная реакция, основанная на прокаливании с нитратом кобальта. Образуется так называемая «зелень Ринмана» – ярко-зелёный плав. В цинка сульфате устанавливают наличие сульфат-иона: при взаимодействии с бария хлоридом выпадает белый осадок.
Количественное определение обоих лекарственных веществ проводят комплексонометрическим методом по иону цинка. Соединения цинка хранят в хорошо укупоренной таре. При хранении следует иметь в виду, что цинка оксид поглощает углекислый газ из воздуха. Цинка сульфат на воздухе теряет кристаллизационную воду. Растворы цинка сульфата при хранении мутнеют вследствие образования основной соли: 3Zn(OH)2∙ZnSO4∙4H2O. Цинка оксид применяют наружно в качестве вяжущего, подсушивающего и дезинфицирующего средства при кожных заболеваниях. Растворы цинка сульфата (0,1 – 0,25%) применяют в качестве вяжущего и антисептического средства в офтальмологии, оториноларингологической и урологической практике Соединения меди Анализ меди (II) сульфата. Из соединений меди (II) применяют меди сульфат, который представляет собой кристаллогидрат (CuSO4∙5 Н2О), и отличается характерной синей окраской.
При выветривании или прокаливании меди сульфат постепенно теряет кристаллизационную воду, что приводит к уменьшению интенсивности окраски кристаллов. При 105 °С отщепляется две молекулы воды, при 150 °С он обезвоживается до моногидрата. Полная потеря кристаллизационной воды (при 250 °С) сопровождается обесцвечиванием. Меди (II) сульфат легко растворим в воде с образованием растворов нейтральной реакции, практически нерастворим в этаноле.
Качественные реакции на ион меди (II): 1. Для установления подлинности используют свойство иона меди легко восстанавливаться. В качестве восстановителя берут железную пластинку или гвоздь, которые при соприкосновении с раствором меди (II) сульфата покрываются красным налетом металлической меди. 2. Окрашивание бесцветного пламени горелки в зеленый цвет в присутствии хлористоводородной кислоты. 3. С раствором аммиака образуются комплексные соединения. 4. Реакция с калия гексацианоферратом (II) при рН 7; образуется осадок красно-бурого цвета, растворимый в аммиаке с образованием аммиакатов меди. 5. Реакция с сульфидом натрия; образуется черный осадок сульфида меди (II), нерастворимый в хлористоводородной кислоте. 6. Реакция с натрия диэтилдитиокарбаминатом; образуется соединение красного цвета. 7. Реакция с дитизоном; образуется комплекс красно-фиолетового цвета. Окрашенные продукты извлекаются хлороформом. Меди сульфат дает характерную реакцию на сульфат-ион с бария хлоридом.
Количественное определение основано на восстановлении катиона меди (II) до меди (I) при использовании иодиметрии, также содержание меди (II) сульфата может быть установлено комплексонометрическим методом. Хранят по списку Б в хорошо укупоренной таре, не допуская потери кристаллизационной воды, что может привести к передозировкам при приготовлении лекарственных форм. Меди (II) сульфат применяют в качестве наружного антисептического, вяжущего или прижигающего средства в виде 0,25%-ных растворов в глазной и урологической практике. Соединения серебра. В медицинской практике применяют серебра нитрат и коллоидные препараты серебра: колларгол и протаргол.
Анализ серебра нитрата.
Серебра нитрат легко растворим в воде с образованием растворов практически нейтральной реакции. Трудно растворим в этаноле.
Качественные реакции на ион серебра: 1. Восстановление из аммиачного раствора серебра нитрата при нагревании с раствором формальдегида. Эта реакция лежит в основе образования «серебряного зеркала» – тонкой блестящей пленки серебра на стенках пробирки. 2. Реакция с раствором хлористоводородной кислоты или хлорида натрия. Осаждающийся хлорид серебра нерастворим в азотной кислоте, но растворяется в растворе аммиака с образованием комплексного соединения. 3. Реакция осаждения с иодид-ионом. Образуется желтого цвета осадок иодида серебра, нерастворимый в растворах аммиака и азотной кислоты. 4. Реакция осаждения с хроматом калия; образуется оранжево-красный осадок хромата серебра. Нитрат-ион обнаруживают по реакции с дифениламином.
Количественно серебра нитрат определяют тиоцианатометрическим (роданометрическим) методом. Серебра нитрат хранят по списку А в хорошо укупоренных банках с притертой пробкой, в защищенном от света месте, чтобы не допустить восстановления серебра нитрата до металлического серебра. Применяют серебра нитрат в качестве антисептического средства наружно в виде 1-2%-ных водных растворов для лечения глазных и кожных заболеваний. (Необходимо очень тщательно контролировать концентрацию).
|
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-20; просмотров: 515; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.217.134 (0.016 с.) |