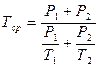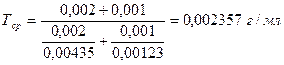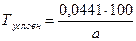Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы выражения концентрации растворов.Содержание книги
Поиск на нашем сайте
Молярная концентрация – это количество вещества, содержащееся в 1 л раствора.
n – количество вещества, моль; m – масса вещества, г; M – молярная масса вещества, г/моль; V – объем раствора, л.
Нормальная или эквивалентная концентрация – это количество молей эквивалентов, содержащихся в 1 л раствора.
m – масса вещества, г; M f – молярная масса эквивалента, г/моль; V – объем раствора, л.
Процентная концентрация – это масса вещества, растворенная в 100 г раствора.
Титрование – это процесс постепенного добавления титранта к анализируемому раствору до точки эквивалентности. Точка эквивалентности – это момент завершения титрования. Точка эквивалентности фиксируется с помощью индикаторов либо потенциометрически. Эквивалент – это реальная или условная частица, эквивалентная 1 протону в кислотно-основной реакции или 1 электрону в окислительно-восстановительной. Фактор эквивалентности – f – это число, показывающее какая доля реальной или условной частицы эквивалентна 1 протону в кислотно-основной реакции или 1 электроны в окислительно-восстановительной.
Титрованный раствор (титрант, рабочий раствор) – это раствор с точно известной концентрацией. Готовят их либо растворением точной навески вещества, либо из фиксаналов. Для приготовленных титрованных растворов вычисляют поправочный коэффициент (К) к молярности, представляющий собой отношение реально полученной концентрации титрованного раствора к теоретически заданной.
Коэффициент К должен находиться в пределах от 0,98 до 1,02. При отклонении величины К от указанных пределов растворы необходимо соответственно укрепить или разбавить, на основании следующих расчетов. В случае разбавления раствора из величины К вычитают единицу и полученную разность умножают на 1000. Результат умножения соответствует количеству воды в мл, которое следует прибавить к каждому литру разбавляемого раствора.
В случае укрепления из единицы вычитают К и разность умножают на количество г исходного вещества, взятого для приготовления 1 л раствора.
Полученное количество добавляют на каждый литр укрепляемого раствора. После этого раствор тщательно перемешивают. При определении поправочного коэффициента к титру производят не менее трех титрований. Если результаты титрования отличаются друг от друга не более чем на 0,05 мл, берут среднее арифметическое из полученных данных. Если же расхождения между отдельными титрованиями превышают указанную величину, титрование необходимо повторить до получения требуемого результата. Чтобы ошибка при титровании не превышала ±0,1%, на титрование нужно расходовать не менее 20 – 30 мл раствора. Отсчет производят по нижнему мениску, если жидкость бесцветная; если жидкость окрашена (например, раствор йода, раствор калия перманганата), отсчет производят по верхнему мениску. В описании каждого титрованного раствора указывается теоретическое содержание химически чистого вещества в 1 мл раствора. Титрованные растворы хранят при комнатной температуре, защищая их при необходимости от воздействия углекислоты и влаги воздуха и от прямых солнечных лучей. При определении поправочного коэффициента необходимо пользоваться мерными колбами и пипетками, предварительно проверенными на правильность их калибровки.
Титр – это масса вещества в граммах, содержащаяся в 1 мл раствора.
Т – титр раствора, г/мл; m – масса растворенного вещества, г; V – объем раствора, л;
M – молярная масса растворенного вещества, г/моль;
Mf – молярная масса эквивалента, г/моль.
Титр по определяемому веществу – это масса вещества в граммах, взаимодействующая с 1 мл титранта.
m – масса анализируемого вещества, г; V – объем титрованного раствора, л;
M – молярная масса анализируемого вещества, г/моль;
Mf – молярная масса эквивалента анализируемого вещества, г/моль.
Расчет титра среднего. Если два вещества, входящие в состав лекарственной смеси, титруются одним и тем же титрованным раствором, а метод для раздельного определения одного из них отсутствует, то рассчитывают суммарное содержание компонентов по титру среднему ориентировочному, который можно рассчитывать по следующим формулам. Если определяемые суммарно ингредиенты находятся в одинаковых количествах и их титры очень мало отличаются друг от друга, тогда титр средний рассчитывают по формуле:
Чаще же используют следующую формулу для расчета титра среднего ориентировочного:
где
Если молекулярные массы двух веществ, определяемых суммарно, различны и в лекарственной смеси вещества прописаны в различных количественных соотношениях, то титр средний ориентировочный рассчитывают по формуле:
Например, в глазных каплях состава: Тиамина бромида 0,002 Кислоты никотиновой 0,001 Раствора натрия хлорида 0,9 % 10,0
Суммарное содержание тиамина бромида и кислоты никотиновой определяют по титру среднему ориентировочному.
Расчет условных титров. Некоторые лекарственные вещества представляют собой эквимолекулярные комплексные соединения, состоящие из двух веществ (кофеин-бензоат натрия, эуфиллин, темисал и др.). Такие препараты в лекарственных смесях можно определять по входящим в них компонентам, содержание которых, согласно требованиями ГФ ХI и другой НД, должно быть в строго определенных пределах. Например, кофеин-бензоат натрия при экспресс-анализе чаще анализируют по бензоату натрия, которого в препарате должно быть 58 - 62 %. Если использовать титр 0,01441 г/мл (при работе с 0,1 моль/л раствором хлористоводородной кислоты), получают содержание натрия бензоата в лекарственной форме. Для пересчета на кофеин-бензоат натрия, результат нужно поделить на фактическое содержание натрия бензоата (в %) в кофеин-бензоате натрия и умножить на 100. Следовательно, определение проводят по условному титру, рассчитанному на одно из веществ, входящих в состав препарата. Условный титр кофеина-бензоата натрия определяют по формуле:
где а - содержание натрия бензоата в данной партии кофеин-бензоата натрия, %. Исходя из содержания натрия бензоата (от 58 до 62 %), условный титр находится в пределах 0,02484 – 0,02324 г/мл.
|
||||
|
Последнее изменение этой страницы: 2021-04-20; просмотров: 162; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.93.183 (0.007 с.) |

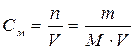 ,
,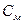 – молярная концентрация, моль/л;
– молярная концентрация, моль/л;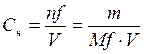 ,
,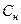 – нормальная или эквивалентная концентрация, моль/л;
– нормальная или эквивалентная концентрация, моль/л;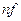 – количество вещества эквивалента, моль;
– количество вещества эквивалента, моль;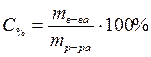 ,
,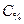 – процентная концентрация, %;
– процентная концентрация, %;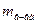 – масса растворенного вещества, г;
– масса растворенного вещества, г;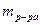 – масса раствора, г.
– масса раствора, г.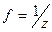 , где z зависит от типа химического взаимодействия.
, где z зависит от типа химического взаимодействия.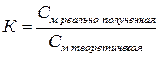
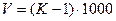
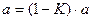
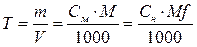 ,
,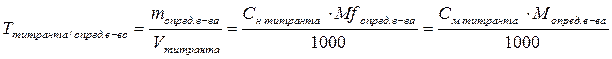
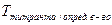 – титр титрованного раствора по определяемому веществу, г/мл;
– титр титрованного раствора по определяемому веществу, г/мл;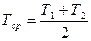
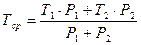
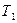 - титр первого компонента;
- титр первого компонента;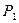 - прописанная масса первого компонента, г;
- прописанная масса первого компонента, г;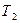 - титр второго компонента;
- титр второго компонента;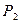 - прописанная масса второго компонента, г;
- прописанная масса второго компонента, г;