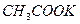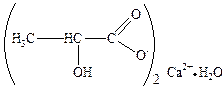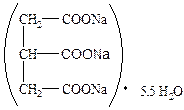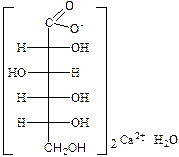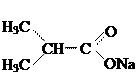Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Анализ препаратов карбоновых кислот и их солей.Содержание книги
Поиск на нашем сайте
Сравнительные данные о физических свойствах солей карбоновых кислот указывают на то, что они представляют собой белые кристаллические вещества, гигроскопичные (калия ацетат) или выветривающиеся на воздухе (кальция лактат, натрия цитрат) ввиду наличия кристаллизационной воды. Соли уксусной и лимонной кислот имеют солоноватый вкус, а калия ацетат – слабый запах уксусной кислоты. Соли щелочных металлов (калия ацетат, натрия вальпроат и натрия цитрат) легко растворимы в воде. Кальциевые соли медленно растворимы в воде, но в кипящей воде их растворимость значительно улучшается (кроме цитрата кальция). В этаноле растворим калия ацетат, легко растворим натрия вальпроат. Остальные соли в этаноле практически нерастворимы. Для испытания подлинности ФС рекомендуют использовать ИК-спектры лекарственных веществ, которые должны полностью совпадать с полосами поглощения прилагаемых к ФС рисунков спектров.
Качественные реакции на ацетат-ион: 1. Реакция образования сложного эфира при взаимодействии с этиловым спиртом и концентрированной серной кислотой. Этилацетат имеет характерный фруктовый запах. 2. Реакция с железа (III) хлоридом; образуются соединения, окрашенные в интенсивно-красный или буро-красный цвет. Качественные реакции на глюконат-ион: 1. Реакция с железа (III) хлоридом; образуется светло-зеленое окрашивание. 2. Реакция со свежеперегнанным фенилгидразином и ледяной уксусной кислотой; образуется фенилгидразид глюконовой кислоты, температура плавления которого около 200°С. 3. Реакция «серебряного зеркала» с серебра нитратом при нагревании в нейтральном растворе; образуется осадок чистого серебра. Качественные реакции на вальпроат-ион: 1. Реакция с раствором кобальта нитрата; образуется пурпурный осадок вальпроата кобальта, растворимый в тетрахлорметане.
Качественные реакции на лактат-ион: 1. Разложение перманганатом калия в кислой среде. Образуется ацетальдегид, имеющий характерный запах. Образовавшийся ацетальдегид можно также обнаружить в парах по почернению полоски фильтровальной бумаги, смоченной реактивом Несслера, или по образованию синего пятна на полоске бумаги, смоченной смесью раствора нитропруссида натрия и пиперидина. 2. Окисление йодом в щелочной среде; образуется йодоформ, имеющий характерный запах и цвет.
Качественные реакции на цитрат-ион: 1. Реакция образования цитрата кальция, растворимость которого уменьшается при нагревании. Поэтому после добавления хлорида кальция раствор остается прозрачным, а при последующем кипячении выпадает белый осадок. Выпавший осадок растворим в хлористоводородной кислоте. 2. Реакция с раствором ванилина в концентрированной серной кислоте; в результате возникает зеленое окрашивание. 3. Реакция с уксусным ангидридом и пиридином или несколькими кристаллами никотиновой кислоты; появляется карминово-красное окрашивание. 4. Сплавление с мочевиной или резорцином; образуются флуоресцирующие продукты. 5. Реакция с бромной водой в присутствии разведенной азотной кислоты; образуется белый кристаллический осадок пентабромацетона. С помощью соответствующих аналитических реакций устанавливают в растворах солей карбоновых кислот наличие ионов калия, натрия и кальция. Учитывая, что способы получения солей карбоновых кислот основаны на взаимодействии карбоновых кислот с карбонатами, при испытании на чистоту устанавливают пределы кислотности или щелочности. Для выполнения испытаний используют определение рН растворов, титрование со специально подобранными индикаторами. Количественно соли карбоновых кислот можно определить методом кислотно-основного титрования в водной и неводной средах, методом ионообменной хроматографии в сочетании с алкалиметрией, аргентометрией, куприметрией, комплексонометрией. Соли карбоновых кислот следует хранить в сухом месте в хорошо укупоренной таре, учитывая их гигроскопичность (калия ацетат) или возможность потери кристаллизационной воды (кальция лактат, кальция глюконат, натрия цитрат). Натрия вальпроат хранят в сухом, прохладном, защищенном от света месте при температуре до 25°С в хорошо укупоренной таре (расплывается на воздухе). Соли карбоновых кислот применяют в медицине для различных целей. Калия ацетат используют в качестве источников ионов калия (при гипокалиемии) и диуретического средства. Кислота вальпроевая и её натриевая соль составляют новую группу противоэпилептических средств широкого спектра действия. Натрия цитрат применяют для консервации (предупреждения свертывания) крови в виде 4 – 5%-ного раствора. Кальция лактат и кальция глюконат используют как источники ионов кальция и в качестве антиаллергического средства.
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-20; просмотров: 110; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.171.83 (0.007 с.) |