Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тепловой эффект химической реакции.Содержание книги
Поиск на нашем сайте
Расчетная формула.
Тепловой эффект химической реакции определяется по формуле (603). Перепишем ее следующим образом: r/Т = s Qmmm = Q/m дж/(кг×град). (608) Применительно к одной килограмм-молекуле вещества получаем r m/Т = s Qmmm m = Q m дж/(кг-моль×град), (609) где Q m - термический заряд, соответствующий одной килограмм-молекуле вещества. 2. Результаты экспериментов.
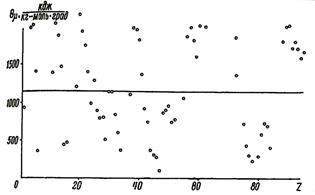
На рис. 27 приведены конкретные данные для очень характерной реакции окисления различных элементов. Термический заряд, увлеченный массой реагирующих элементов, отнесен к одному атому кислорода в формуле окисла. Температура Т = 298 °К.
Рис. 27. Зависимость удельного термического заряда, увлеченного химической массой при окислении элементов, от их атомного номера.
Из приведенных данных видно, что закон тождественности свойств (постоянство коэффициента s Qmmm m) для рассматриваемой реакции соблюдается плохо. Еще хуже он соблюдается в условиях действия закона Фарадея.
Закон Трутона.
Содержание закона.
Рассмотрим теперь фазовые превращения – испарение и конденсацию, плавление и затвердевание. В 1884 г. Трутон эмпирически установил правило, согласно которому для одной килограмм-молекулы всех веществ отношение теплоты r m к температуре И испарения (парообразования) есть величина постоянная. Нетрудно увидеть, что правило (точнее закон) Трутона есть следствие закона отношения потоков и тождественности свойств общей теории. Согласно закону отношения потоков, увлеченная массой теплота испарения определяется формулой (609), которую можно дополнить отношением емкостей. Имеем r m/Т = s Qmmm m = Q m = b Q m m / b mm m = К Q mР m /К mmР m дж/(кг-моль×град). (610) Согласно закону тождественности, мольные емкости К Q mР m и К mmР m для различных веществ имеют примерно одинаковые значения. Отсюда следует постоянство отношения r m/Т для различных веществ, что составляет содержание закона Трутона.
2. Анализ результатов.
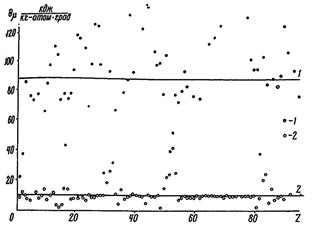
Формула (610), полученная на основе законов общей теории, очень хорошо определяет смысл и границы применимости закона Трутона. Из этой формулы видно, что отношение r m/Т представляет собой физический коэффициент s Qmmm m. Этот вывод есть следствие строгого закона отношения потоков. Вместе с тем вывод об одинаковости коэффициента s Qmmm m для различных веществ есть следствие приближенного закона тождественности. Отсюда ясно, что закон Трутона есть приближенный закон. Его точность определяется точностью соблюдения закона тождественности. На практике емкости К Q mР m и К mmР m изменяются от вещества к веществу довольно заметно. Поэтому довольно заметно изменяется и отношение r m/Т. О характере разброса значений Q m можно судить по данным, приведенным на рис. 28 (кривая 1), где среднее значение Q m показано горизонтальной прямой. В пределах более узких групп веществ закон Трутона удовлетворяется лучше.
Рис. 28. Зависимость термического заряда, увлеченного фазовой массой при испарении (1) и плавлении (2) элементов, от их атомного номера.
Заметим, что термический заряд Q m, увлеченный фазовой массой при испарении, невозможно отличить (или отделить) от термического заряда диссипации. Поэтому закон Трутона применим только к равновесным (обратимым) условиям испарения. При неравновесном испарении, даже если все напоры равны нулю, кроме d mфз, величина r m изменяется в зависимости от степени необратимости процесса. Эффект необратимости обнаруживает себя в том, что r m при конденсации должно быть больше, чем при испарении (равновесное r m заключено между этими двумя значениями). Плавление твердых тел (и затвердевание жидкостей) подчиняется тем же законам общей теории, что и испарение (или конденсация). С количественной стороны процесс плавления описывается формулой (610). Закон отношения потоков является строгим законом, поэтому он справедлив для любых веществ. Но если к нему добавить закон тождественности свойств, т.е. потребовать, чтобы увлеченный термический заряд Q m был одинаковым у всех веществ, то картина получится еще более пестрой, чем в случае испарения (рис. 28, кривая 2). Очевидно, для процессов плавления постоянство Q m обеспечивается в рамках еще более узких групп веществ. Приведенные соображения проливают свет на загадочные свойства закона Трутона. Он в принципе правильно описывает явление, но отличается большой неточностью. Происхождение этой неточности всегда было неясно и вызывало много недоуменных вопросов.
|
||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 182; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.011 с.) |