
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные законы термодинамики Онзагера.
Теория Онзагера имеет в своей основе весь аппарат классической термодинамики, включая первое и второе начала, а также два дополнительных принципа – линейности и взаимности [29]. Принцип линейности возник на основе обобщения известного линейного уравнения (335), описывающего распространение теплоты в анизотропном кристалле, на любые разнородные явления. Идея взаимности почерпнута из соотношений взаимности (336). Впервые предположение о существовании соотношений (336) высказал Стокс в 1851 г. В 1893 г. Соре и в 1903 г. Фойгт экспериментально подтвердили справедливость этих соотношений. Оба принципа объединены в теореме взаимности, для доказательства которой Онзагер воспользовался методами статистической механики – принципом микроскопической обратимости, т.е. положением о наличии у всех уравнений движения микрочастиц симметрии по отношению ко времени, а также теорией флуктуаций и гипотезой о характере затухания флуктуаций. Суть теоремы взаимности Онзагера состоит в следующем. Если потоки J и силы Y в линейных уравнениях переноса Онзагера Ji = где i = 1, 2,..., n, выбираются из уравнения Т s = JY вт/м3 (725) для скорости возникновения теплоты диссипации, то соблюдаются соотношения взаимности Онзагера Lir = Lri. (726) Этот результат представляется настолько важным, что Д. Миллер в 1956 г. предложил назвать теорему Онзагера четвертым началом термодинамики [28]. Таким образом, Онзагер впервые в широком плане ввел в макроскопическую теорию идеи переноса, а также положение о взаимном и симметричном влиянии потоков. На фоне идей равновесия и покоя классической термодинамики это явилось достижением исключительной важности. Оно революционизировало теорию и стимулировало появление бесчисленного множества исследований в рассматриваемой области. За свою работу Онзагер в 1968 г. был удостоен Нобелевской премии. Эта награда подчеркивает важность для науки того факта, что теория, наконец, повернулась лицом к реальным необратимым процессам; она несомненно привлечет внимание исследователей к идеям термодинамики, отличающимся фундаментальностью и неисчерпаемыми возможностями [30].
2. Выбор потоков и сил по Онзагеру.
Необходимо подчеркнуть, что потоки J, силы Y и коэффициенты L у Онзагера не имеют того смысла, что в общей теории. Согласно теории Онзагера, потоки и силы выбираются из соотношения (725), которое должно быть установлено заранее из каких-либо соображений, выходящих за рамки теории. Если каким-то способом найдена скорость возникновения теплоты диссипации, то выражающая ее формула произвольно (формально) расчленяется на поток и силу. Например, для термических явлений известные формулы (541) и (543) можно расчленить на поток и силу следующим образом: J = dQQ/(Fdt) вт/м2; (727) Y = - (1/Т)(dТ/dх) 1/м; (727) J = dQQ/(ТFdt) вт/(м2×град); (728) Y = - dТ/dх град/м; (728) J = dQQ/(dVdt) вт/м3; (729) Y = - dТ/Т; (729) J = dQQ дж; (730) Y = - dТ/(Т dVdt) 1/(м3×сек) (730) и т.д. На выбор потока и силы накладывается только одно ограничение – теорема Кюри (§ 34). По Онзагеру, все выбранные потоки и силы совершенно равноценны в теоретическом отношении.
3. Обсуждение основных идей.
Для доказательства теоремы взаимности Онзагер воспользовался принципом микроскопической обратимости из теории детального равновесия химических реакций. В условиях равновесия (именно так его применяют химики) справедливость этого принципа не вызывает сомнений. Что касается неравновесных систем, то для них этот принцип теряет силу, ибо, согласно общей теории, все микроскопические процессы, происходящие не при нулевых разностях потенциалов, необратимы. В результате уравнения движения оказываются несимметричными (необратимыми) относительно времени, так как их надо сочетать с уравнением закона диссипации.
Это замечание в равной мере касается всех известных теорий физической кинетики, поскольку все они пользуются обратимыми уравнениями механики, в том числе квантовой, и распространяют их на реальные необратимые системы. Как следствие, полученные результаты справедливы только для практически обратимых процессов. Онзагер распространил принцип микроскопической обратимости на неравновесные системы, находящиеся вблизи состояния равновесия, и таким образом доказал справедливость соотношения (726). На этом основании термодинамика Онзагера, как и Клаузиуса, справедлива только для условий, близких к равновесным. Кроме того, только в этих условиях действует понятие энтропии, положенное в основу построения теории. Специфическая особенность теории Онзагера заключена в способе выбора потоков и сил с помощью выражений (725). Однако трудность предварительного нахождения, без знания закона диссипации, конкретного вида соотношения (725) и формальный характер выбранных потоков и сил ограничивают возможности теории и часто приводят к неясностям. Например, неточности содержатся во всех трех наиболее известных приложениях теории Онзагера – имеются в виду термоэлектрические, термофильтрационные и химические явления. Отсутствие простого и ясного физического смысла в выбираемых по методу Онзагера потоках и силах [см., например, формулы (727) – (730)] делает весьма условным даже само представление о переносе (о потоках). При этом Онзагер, как и Клаузиус, исходит из идеи о том, что в термических явлениях объектом переноса служит теплота. Легко убедиться в том, что термодинамика Онзагера вытекает из общей теории в качестве частного случая, ибо ее основные детали, включая термодинамику Клаузиуса и соотношения (724) – (726), содержатся в этой теории.
4. Термодинамика Онзагера и перенос.
Основные понятия в термодинамике Онзагера имеют двойственный характер. С одной стороны, Онзагер рассматривает потоки, т.е. закладывает в теорию идеи переноса, пусть даже не зарядов – это не столь важно. С другой стороны, он применяет для этого первое и второе начала, которые непригодны для оценки процессов переноса. В результате с методологической точки зрения теоретические построения Онзагера оказываются весьма искусственными: Онзагеру пришлось сделать все понятия сугубо формальными и ограничиться рассмотрением лишь систем, находящихся вблизи состояния равновесия. Лучше всего имеющиеся в теории противоречия и трудности выражены следующими словами К. Денбига, много сделавшего для развития термодинамики необратимых процессов [10]: «...всякая наглядная картина по отношению к потоку энтропии становится совершенно неуместной и трудности понимания очень сильно возрастают».
Если в классической термодинамике не возникает даже и мысли о переносе, то в термодинамике необратимых процессов прямо говорится о потоках, хотя в обоих случаях используется один и тот же теоретический аппарат, предназначенный для изучения состояний равновесия. Таким образом, теория Онзагера предельно выпукло демонстрирует несоответствие между характером изучаемых реальных процессов переноса и применяемым для этого аппаратом (энтропия и связанные с нею понятия), которому чужды идеи переноса. Это несоответствие послужило толчком для поисков новых путей.
Теория теплообмена.
Основные законы теории.
Теория теплообмена базируется на трех основных законах: теплопроводности Фурье [формула (317)] JQ = LQY Q = - LQ(dТ/dх) вт/м2, теплоотдачи на поверхности тела Ньютона JQ = a Q Х Q = - a Q d Т вт/м2 (731) и излучения абсолютно черного тела Стефана-Больцмана JQ = s Q Т4 вт/м2, (732) где a Q - так называемый коэффициент теплоотдачи, вт/(м2×град); s Q - постоянная Стефана-Больцмана s Q = 5,675×10-8 вт/(м2×град4). (733) Известное дифференциальное уравнение теплообмена на поверхности тела находится из формул (317) и (731). Имеем LQ(dТ/dх) - aQ dТ = 0. (734) В теории теплопроводности используется также дифференциальное уравнение теплопроводности Фурье [формула (356)] ¶ Т/ ¶ t = DQ(¶2Т/ ¶x2) град/сек. Об уравнении Фурье много говорилось в § 40. С помощью этих законов находятся все многочисленные уравнения переноса теплоты, используемые на практике. В теории теплообмена рассматривается именно перенос теплоты. Коэффициенты LQ и aQ для реальных тел применительно к различным условиям теплообмена определяются из опыта. Для этого разработано большое количество методов, широко использующих теорию подобия.
2. Обсуждение основных идей.
Нетрудно показать, что все положения теории теплообмена, рассматривающей в основном только одну – термическую – степень свободы, вытекают из общей теории как частные случаи. Например, о законе Фурье говорится в § 37. Закон Ньютона получается, если уравнение (249) записать для явления отдачи термического заряда:
J Q = a QХ Q = - a Q dТ вт/(м2×град), (735) где a Q - коэффициент термоотдачи (поверхностная проводимость по отношению к термическому заряду), вт/(м2×град2). Умножив левую и правую части уравнения (735) на Т, получим уравнение (731), где JQ = ТJ Q вт/м2; (736) a Q = Т a Q вт/(м2×град). (736) Закон Стефана-Больцмана выводится способом, изложенным в работе Зоммерфельда [13]. Дифференциальное уравнение теплообмена (734) есть частный случай выражения (651) общей теории и т.д. Общая теория изучает свойства систем со многими степенями свободы, поэтому ее применение к решению различных задач теплообмена дает много новых результатов, имеющих важное практическое значение. Например, любая среда, используемая в теплообменных устройствах, располагает большим количеством степеней свободы. Это значит, что с помощью всех этих степеней свободы можно влиять на термическую, т.е. на интенсивность теплообмена. В частности, из четвертой строчки уравнения (594) получаются следующие общие выражения для эффективных коэффициентов термоотдачи и теплоотдачи: a Qэф = a Qфз(d mфз/ dТ) + a Qдф(d mдф/ dТ) + a QQ + + a Q V(dР/ dТ) + a Q Y(d j/ dТ) +... вт/(м2×град2); (737) a Qэф = Тфз a Qфз вт/(м2×град); (738) a QQ = Тфз a QQ вт/(м2×град), (739) где a Qэф - эффективный коэффициент теплоотдачи, вт/(м2×град); a QQ - обычный (термический) коэффициент теплоотдачи, используемый в теории теплообмена, вт/(м2×град). В данном случае вместо потоков I взяты потоки J, находящие в теории теплообмена более широкое распространение. Формула (737) получена путем приравнивания четвертой строчки уравнения (594) выражению J Q = - a Qэф dТ вт/(м2×град). (740) При этом поток теплоты J Q = ТфзJ Q = - a Qэф dТ вт/м2. (741) Эффективный коэффициент теплоотдачи a Qэф в формуле (737) учитывает влияние на процесс теплообмена потоков фазовой и диффузионной масс, объема и электрического заряда. Аналогичную формулу можно написать для любого числа степеней свободы. Анализ показывает, что такие дополнительные степени свободы, как фазовая (испарение и плавление), электрическая, вибрационная и т.д. позволяют увеличить интенсивность теплообмена в десятки и сотни раз, диффузионная – в несколько раз и т.д. Например, по данным И.Г. Аладьева и В.А. Ефимова, а также З.Ф. Слезенко, незначительный поток электрического заряда увеличивает коэффициент теплоотдачи до 30 раз. По З.Ф. Слезенко, примерно во столько же раз интенсифицируется теплообмен под действием ультразвука (при частоте 16 кгц). При частотах порядка 40 кгц интенсивность теплообмена возрастает в сотни раз.
Химия.
Общие соображения.
При химических и фазовых превращениях происходит изменение массы веществ. Например, если в однородной смеси газообразных водорода и кислорода осуществляется реакция образования воды, то массы свободных водорода и кислорода уменьшаются, а масса воды возрастает. При этом перенос обобщенного заряда (массы) через контрольную поверхность системы приобретает известную условность. Эта условность относится как к самому процессу переноса, так и к способу выделения системы из окружающей среды. Действительно, в данном случае уже нет геометрически четко очерченной контрольной поверхности, через которую осуществлялся бы видимый перенос массы. Равномерно распределенные по объему системы молекулы водорода, кислорода и воды выделяются в особые подсистемы, между которыми и происходит обмен массой (систему в целом обычно составляет вся совокупность молекул водорода, кислорода и воды). В рассматриваемом случае контрольная поверхность, разделяющая подсистемы, проводится мысленно и охватывает все однотипные молекулы системы. Молекулы водорода и кислорода, вступившие в реакцию, считаются выбывшими из соответствующих подсистем и поступившими в подсистему с молекулами воды. Для большинства явлений перепад потенциала в системе определяет степень ее неравновесности, а напор – интенсивность взаимодействия с окружающей средой. В случае химических, некоторых фазовых и субстанциальных превращений (при равномерном перемешивании подсистем между собой) напор потенциала является одновременно перепадом. В этих условиях понятия неравномерности и нестационарности органически переплетаются между собой: нестационарная система одновременно является неравновесной, а стационарная – равновесной. Статодинамический подход часто позволяет легко справиться с этой трудностью и рассматривать существенно неравновесную в целом химическую или фазовую систему как совокупность равновесных (статодинамических) подсистем. Свойства любой статодинамической системы, в том числе химической, описываются простейшими дифференциальными уравнениями переноса, выведенными в § 81. В тех случаях, когда каждая из подсистем не может рассматриваться как равновесная, приходится составлять весьма сложные уравнения переноса типа (349) и т.д. Ниже для простоты разбирается статодинамический пример.
2. Тройная мономолекулярная реакция.
Для выяснения некоторых особенностей химических и фазовых превращений обратимся к анализу неравновесной системы, которую можно свести к совокупности статодинамических подсистем. Предположим, что осуществляется тройная мономолекулярная реакция по схеме: А «В; В «С; С «А. (742) Каждое из веществ (равновесных подсистем) А, В и С располагает всеми теми степенями свободы, которые фигурируют в формуле (594). При наличии трех подсистем имеются три направления переноса – АВ, ВС и СА. В общем случае взаимное влияние потоков существует как в пределах каждого направления, так и между отдельными направлениями. В целом получается весьма сложная картина взаимодействия потоков. Для простоты примем, что взаимное влияние потоков химической массы существует только между отдельными направлениями (АВ, ВС и СА), а взаимное влияние потоков все зарядов (химическая, фазовая и диффузионная массы, термический заряд, объем, количество кинетического движения, электрический заряд и т.д.) – только в пределах каждого из направлений. Уравнения потоков химической массы для разных подсистем имеют вид: UmA = ImA = ImAB + ImCA кг/сек; (743) UmВ = ImВ = ImAB + ImВC кг/сек; (743) UmС = ImС = ImBС + ImCА кг/сек. (743) От подсистемы А масса направляется к подсистемам В и С. То же можно сказать о подсистемах В и С. Аналогичные уравнения записываются для других зарядов. Частные потоки ImAB и т.д. находятся с учетом взаимного влияния зарядов. Например, для направления АВ имеем (ограничиваемся только химической, термической и механической степенями свободы): ImAB = b mmАВ ХпmАВ + b m QАВХ QАВ + b mVАВХ VАВ кг/сек; (744) I Q AB = b Q mАВ ХпmАВ + b QQАВХ QАВ + b Q VАВХ VАВ кг/сек; (744) IVAB = b VmАВ ХпmАВ + b V QАВХ QАВ + b VVАВХ VАВ кг/сек, (744) где b m QАВ = b Q mАВ; b mVАВ = b VmАВ; b Q VАВ = b V QАВ. (745) Индексом «п» вверху обозначены величины, относящиеся к полным потокам химической массы, с учетом взаимного влияния направлений АВ, ВС и СА. Аналогичные уравнения записываются для направлений ВС и СА. Взаимное влияние потоков химической массы (между направлениями АВ, ВС и СА) определяются формулами: IпmAB = b mmАВ ХmАВ + b mАВВСХ mВС + b mАВСАХ mСА кг/сек; (746) IпmBС = b mВСАВ ХmАВ + b mmВСХ mВС + b mВССАХ mСА кг/сек; (746) IпmСA = b mСААВ ХmАВ + b mСАВСХ mВС + b mmСАХ mСА кг/сек, (746) где IпmAB = b mmАВ ХпmАВ; (747) IпmBС = b mmВС ХпmВС; (747) IпmСA = b mmСА ХпmСА; (747) b mАВВС = b mВСАВ; b mАВСА = b mСААВ; b mВССА = b mСАВС. (748) Найденные из уравнений (746) и (747) полные силы Хп подставляются в уравнения (744). Если в более общем случае учитывать взаимное влияние всех потоков внутри каждого направления и между отдельными направлениями, тогда надо систему уравнений (744), записанную для всех степеней свободы и всех направлений, дополнить совокупностями уравнений типа (746), записанных для каждой из степеней свободы. Термический, объемный, электрический и прочие эффекты химической реакции находятся в виде отношения соответствующих потоков для отдельных направлений. Например, термический эффект реакции для направления АВ (без учета диссипации): s Q mАВ = I QАВ/I mАВ = Q/m дж/(кг×град). (749) Если все силы, кроме ХпmАВ, равны нулю, то на основе закона отношения потоков получаем: s Q mmmАВ = I QАВ/I mАВ = Q/m = = b Q mАВ / b mmАВ = К Q mАВР /КmmАВР дж/(кг×град). (750) Следует помнить, что на этот эффект накладывается диссипация, вызванная неравенством нулю напора химического потенциала. В равновесных условиях весь термический эффект реакции для направления АВ сводится к определяемому формулой (750). Суммарный термический эффект всей химической реакции в целом находится путем сложения эффектов от направления АВ, ВС и СА. Для определения термической работы (теплоты) реакции коэффициент s Q mmm умножается на температуру.
3. Анализ известных решений.
Известны два различных решения рассмотренной выше задачи о тройной мономолекулярной реакции. Полученные методами термодинамики Онзагера. Первое решение имеет вид: U1 = b 11Х1 + b 12Х2 + b 13Х3; (751) U2 = b 21Х1 + b 22Х2 + b 23Х3; (751) U3 = b 31Х1 + b 32Х2 + b 33Х3, (751) где Х1 = mВ - mС; (752) Х2 = mС - mА; (752) Х3 = mА - mВ = - Х1 – Х2. (752) Эти разности потенциалов между подсистемами представляют собой химическое сродство по де Донде. Второе решение выглядит следующим образом: UА = - b 11ХА - b 12ХВ - b 13ХС; (753) UВ = - b 21ХА - b 22ХВ - b 23ХС; (753) UВ = - b 31ХА - b 32ХВ - b 33ХС, (753) где ХА = mР - mА; (754) ХВ = mР - mВ; (754) ХС = mР - mС; (754) mР – равновесное значение химического потенциала (общее для всех веществ). Сопоставление формул (751) и (753) с общими решениями (743) – (748) показывает, что эти формулы справедливы только для систем, находящихся вблизи состояния равновесия, и только тогда, когда отсутствуют все потоки увлечения, кроме потоков массы. В этих условиях от общего решения остается только одно уравнение (746). Формула (753) соответствует приближенному методу решения задачи с использованием среднего «калориметрического» (равновесного) значения потенциала (§ 81). Из всего сказанного ясно, что классическая термодинамика дает возможность оценивать свойства химической системы лишь в условиях равновесия. Термодинамика Онзагера несколько раздвигает рамки теории – она позволяет рассматривать химические реакции вблизи состояния равновесия, но при этом не учитывает влияния всех степеней свободы (термической, механической и т.д.), кроме химической, что является принципиальным недостатком. С помощью общей теории химические системы можно изучать в любых условиях – равновесных и неравновесных, стационарных и нестационарных – с учетом взаимного влияния всех существующих форм движения. Наблюдаемая в опытах нелинейная связь между потоками U и силами Х в формулах (751) и (753) объясняется двумя причинами. Главная из них состоит в том, что этими формулами не учитывается влияние на поток массы всех сил из числа связанных степеней свободы, кроме химической. В результате воздействие неучтенных сил различного рода на поток массы воспринимается в виде нелинейной зависимости между потоком массы U и химической силы Х в формулах (751) и (753). Вторая состоит в том, что коэффициенты b в общем случае суть величины переменные, зависящие от зарядов, а следовательно, и от сил Х. Это обстоятельство общей теорией учитывается. Коэффициенты b постоянны только в случае идеальных тел. Однако, как ясно из предыдущего, реальные тела очень часто можно приближенно рассматривать как идеальные. Поэтому зависимостью коэффициентов b от химических сил Х часто можно пренебречь.
4. Химия, термодинамика и общая теория.
В заключение остановимся на вопросе о том, каким аппаратом располагала химическая теория до термодинамики Онзагера и кратко покажем, что весь этот аппарат вытекает, как частный случай, из общей теории. Речь идет о первом и втором началах, уравнении Гиббса и принципе максимального значения энтропии в условиях равновесия химической реакции, которые заимствованы из классической термодинамики, а также о принципе Ле Шателье, законе фаз Гиббса, законе Гесса, периодическом законе Менделеева, основном постулате химической кинетики и т.д., которые составляют специфический аппарат химической теории. О первом и втором началах, уравнении Гиббса и принципе максимального значения энтропии при равновесной химической реакции уже говорилось достаточно. Суть принципа смещения равновесия Ле Шателье (1884) состоит в следующем. Если система находится в состоянии равновесия, то при действии на нее сил (имеются в виду потенциалы), вызывающих нарушение равновесия, система переходит в такое состояние, в котором эффект внешнего воздействия ослабляется. Этот вывод непосредственно вытекает из закона состояния. Всякое изменение потенциалов окружающей среды (температуры, давления, химического потенциала и т.д.) сразу же выражается в переносе через контрольную поверхность определенного количества соответствующих зарядов (термического, объема, массы и т.д.). В результате устанавливается равновесие на новом уровне потенциалов, действие окружающей среды прекращается. Принцип Ле Шателье характеризует лишь направление смещения равновесия, закон состояния определяет также количественную сторону смещения. Закон фаз Гиббса выводится из закона состояния или переноса. Он определяет число химических степеней свободы равновесной системы f = К – Ф + n, (755) где К – число компонентов, каждый из которых находится во всех Ф фазах; n - число величин, одинаковых во всех фазах системы (имеются в виду потенциалы). Согласно закону Г.И. Гесса (1840), тепловой эффект процесса не зависит от промежуточных стадий, а определяется лишь начальным и конечным состояниями системы. Этот вывод есть следствие законов сохранения и состояния. В соответствии с законом состояния конечное состояние изучаемой системы получается из начального путем изменения зарядов на определенные величины DЕ (в том числе термического, на D Q), причем разности DЕ не зависят от промежуточных состояний системы (промежуточных реакций). Если переход из начального состояния в конечное происходит при постоянных потенциалах Р, то все совершаемые работы Q = Р DЕ дж, (756) в том числе термическая работа QQ = Т D Q дж, (757) представляющая собой тепловой эффект процесса, будут иметь одни и те же значения, независимо от промежуточных стадий (этот вывод следует из закона сохранения энергии). Таким образом, общая теория дополняет и уточняет закон Гесса. Дополнение состоит в том, что в рассматриваемых условиях сохраняются постоянными, не зависящими от промежуточных стадий, не только тепловой эффект (термическая работа), но и все остальные эффекты – работы (механическая, химическая и т.д.), а также изменения всех зарядов (термического, объема, массы и т.д.). Уточнение сводится к требованию, чтобы переход из начального состояния в конечное происходил равновесно (обратимо). При необратимых процессах разные пути перехода могут дать неодинаковые тепловые эффекты из-за различия в степени необратимости переходных процессов. При этом в действие вступает закон диссипации. Законы сохранения, состояния и диссипации позволяют в каждом конкретном случае вычислить любой эффект процесса при любом характере изменения зарядов и потенциалов. Что касается периодического закона, то каждый элемент таблицы Д.И. Менделеева представляет собой ансамбль микрозарядов, причем переход от одного микроансамбля к другому совершается благодаря изменению числа элементарных квантов зарядов. Следовательно, периодический закон Д.И. Менделеева есть частный случай закона состояния, а периодическая таблица элементов может быть описана уравнениями состояния типа (180) – (182). При написании уравнений следует учитывать структуру частиц и атомов и сложный характер взаимного влияния квантов разнородных зарядов, о чем говорилось выше, например, при рассмотрении закона силового взаимодействия зарядов (§ 82) и тройной мономолекулярной реакции. В общем случае уравнения состояния могут характеризовать все свойства элементов, включая даже такие, как цвет, запах, вкус и т.д. Общее количество возможных элементов неограниченно велико. Аналогичным образом можно прийти к основному уравнению химической кинетики и т.д.
Механика.
Механика Ньютона.
Классическая механика Ньютона базируется на трех главных законах. Первый закон Ньютона (принцип инерции) гласит: всякое тело сохраняет состояние покоя или равномерного и прямолинейного движения, пока воздействие со стороны других тел не заставит его изменить это состояние. Согласно второму закону Ньютона, изменение количества движения пропорционально приложенной движущей силе и происходит по направлению той прямой, по которой эта сила действует. Математически второй закон может быть выражен равенствами: d(m w) = Рх dt н×сек; (758) Рх = d(m w)/ dt = m(d w /dt) н. (759) Сила равна произведению массы на ускорение. Наконец, третий закон Ньютона утверждает, что действию всегда есть равное и противоположно направленное противодействие. На основе трех перечисленных законов было развито очень стройное здание классической механики, которую применяют для изучения всех видов механического движения самых разнообразных тел, начиная от микромира и кончая мега- и гигамирами. Нетрудно показать, что законы Ньютона вытекают как частные случаи из законов общей теории. Действительно, первый закон (инерции) есть следствие законов сохранения и состояния. Согласно уравнению закона состояния для кинетическо-хронально-перемещательной и т.д. системы (выписываем первую строчку этого уравнения в сокращенном виде), d w = АКК dК + АК t dt + АКх dх +... м/сек, (760) скорость тела является функцией таких зарядов, как количество движения, время, перемещение и т.д. Если тело представляет собой изолированную систему, то изменения всех зарядов равны нулю (соблюдается закон сохранения). При этом отсутствует изменение состояния движения (изменение скорости d w = 0). Только нарушение изоляции тела (воздействие на него извне) может изменить существующее состояние движения (скорость d w). В этом и заключается суть первого закона. Второй закон Ньютона есть частный случай закона состояния. Например, из второй строчки упомянутого выше уравнения состояния (приводим ее в сокращенном виде)
|
|||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 616; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.6.114 (0.111 с.) |
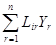 , (724)
, (724)


