Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ферменты, наиболее широко используемые в диагностикеСодержание книги
Поиск на нашем сайте
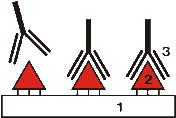
Основы иммуноферментного анализа Сущность ИФА, относящегося к иммунохимическим методам, заключается в специфическом взаимодействии антигена и антитела с последующим присоединением к образующемуся комплексу коньюгата – анти-антитела, меченного ферментом. Фермент вызывает превращение неокрашенного субстрата (хромогена) в окрашенный продукт, выявляемый фотометрически. Интенсивность окраски пропорциональна концентрации комплекса антиген-антитело. В качестве иммобилизованного на поверхности анти-антитела (антивидового иммуноглобулина) фермента чаще используются пероксидазы. При разложении ими Н2О2 выделяется кислород, вызывающий окисление хромогена в окрашенный продукт. Процедура твердофазного ИФА (ELISA - еnzyme-linked immunosorbent assay) включает следующие этапы: 1) специфическое связывание антигена (2), пришитого к твердой фазе (1- планшета) с имеющимся в сыворотке антителом(3);
Клинико-диагностическое значение ИФА ИФА широко используется в клинике с целью: 1) диагностики инфекционных и паразитарных заболеваний; 2) количественного определения гормонов и других биологически активных соединений; 3) диагностика ранних сроков беременности; 4) выявление онкомаркеров. Примеры тестов контроля исходного уровня знаний Вид 1. Один наиболее верный ответ. 1.1. Молярная активность (число оборотов) выражается в …. а) моль/мг мин б) моль/сек в) кат/ г-моль г) моль/кг сек
1.2. Мультиэнзимные комплексы представляют собой …. а) надмолекулярные структуры б) иммобилизованные ферменты в) олигомерные белки г) множественные формы ферментов Вид 2. Установите соответствие. 2.1. Наследственное заболевание – дефектный фермент 1. фенилкетонурия а) глюкозо-6-фосфатаза 2. алкаптонурия б) тирозиназа 3. болезнь Гирке в) фенилаланингидроксилаза 4. галактоземия г) гомогентезиназа 5. альбинизм д) галактокиназа
2.2. Единицы измерения активности ферментов 1. число оборотов а) кат/г-моль 2. катал б) мкмоль/мин 3. международные единицы в) моль/сек
2.3. Заболевание – индикаторный фермент. 1. острый панкреатит а) ЛДГ(изоферменты) 2. вирусный гепатит б) аминотрансферазы 3. заболевания костей в) креатинкиназа (изоферменты) 4. механическая желтуха г) щелочная фосфатаза (изоферменты) 5. рак предстательной железы д) кислая фосфатаза 6. инфаркт миокарда е) α-амилаза Вид 3. Правильное сочетание ответов. 3.1. Преимущества иммобилизованных ферментов: 1. имеют большую специфичность к субстрату 2. отличаются большей активностью 3. отличаются механизмом катализа 4. имеют большую стабильность 5. не могут использоваться многократно
3.2. Изоферменты лактатдегидрогеназы отличаются … 1. субъединичным составом 2. тканевой локализацией 3. электрофоретической подвижностью 4. внутриклеточной локализацией 5. катализируемой реакцией
Вид 4. Определите правильность утверждений в предложении и установите наличие причинной связи между ними. 4.1. Определение активности ферментов необходимо производить при полном насыщении фермента субстратом - при Кm>[S], поскольку именно в этих условиях скорость реакции будет пропорциональна концентрации фермента.
4.2. При электрофорезе в полиакриламидном геле изофермент ЛДГ 1 первым мигрирует к аноду, поскольку состоит из 4-х М-субъедниц, обладающих наибольшим отрицательным зарядом. Примеры ситуационных задач Задача 1. При добавлении в среду 0,002 мкмоль кристаллического фермента лактатдегидрогеназы наблюдается превращение субстрата со скоростью 9,6 мкмоль в минуту. Подсчитайте молярную активность (число оборотов) фермента.
|
||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 390; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.008 с.) |