
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные положения квантовой механики.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Корпускулярно-волновой дуализм света. Т.о., в одних опытах (дифракция, интерференция, поляризация) свет проявляет волновые свойства, в других же (тепловое излучение, фотоэффект, эффект Комптона) он ведет себя как поток частиц-фотонов, но никогда не проявляет волновые и корпускулярные свойства одновременно. Волновая и квантовая теории света дополняют друг друга. Двойственная природа света получила название корпускулярно-волнового дуализма света и находит свое выражение в формулах, определяющих основные характеристики фотонов. Как видно из этих формул, корпускулярные характеристики фотона – энергия εf = hv иимпульс рf = hv/c=h/λ – связаны с волновыми характеристиками света: его частотой ν и длиной волны λ. Большая группа оптических явлений – интерференция, дифракция, поляризация – полностью объясняется в волновой оптике. Однако, если «перемещаться» от длинных волн в сторону более коротких, то волновые свойства света будут проявляться все слабее, уступая место более отчетливо проявляющимся квантовым свойствам. Это видно, например, из существования «красной границы» фотоэффекта и такой же границы для фотохимических реакций.
С квантовой точки зрения образование на экране дифракционной картины означает, что при прохождении света через щель происходит перераспределение фотонов в пространстве. В результате этого в разные точки экрана попадает различное число фотонов. Освещенность экрана в данной точке будет тем больше, чем большей будет суммарная энергия фотонов, попадающих за единицу времени в данную точку. Эта энергия, в свою очередь, пропорциональна числу п(x) фотонов, доставивших эту энергию. Таким образом, I(x) ~п(x). Из сказанного следует, что E(x) 2~п(x). Квадрат амплитуды световой волны в какой-либо точке пространства пропорционален числу фотонов, попадающих в эту точку. Иными словами, квадрат амплитуды световой волны в данной точке пространства является мерой вероятности попадания фотонов в эту точку. Таким образом, волновые и квантовые свойства света не исключают, а, наоборот, взаимно дополняют друг друга. Квантовые свойства света обусловлены тем, что энергия, импульс и масса излучения сосредоточены в частицах – фотонах. Вероятность нахождения фотонов в различных точках пространства определяется волновыми свойствами света – амплитудой световой волны (квадратом ее модуля). Далее было установлено, что волновые свойства присущи не только совокупности большого числа одновременно летящих фотонов. Каждый отдельный фотон обладает волновыми свойствами. Волновые свойства фотона проявляются в том, что для него нельзя точно указать, в какую именноточку экрана он попадет после прохождения щели. Можно говорить лишь о вероятности попадания каждого фотонав ту или иную точку экрана. Такое истолкование связи между волновыми и квантовыми свойствами света сыграло выдающуюся роль в развитии современной физики. Волновые свойства микрочастиц. Корпускулярно-волновой дуализм присущ не только свету, но и частицам вещества. Эту идею высказал, исходя из соображений симметрии, Луи де Бройль: если свет, который рассматривался как электромагнитная волна, может проявлять корпускулярные свойства, то и частицы вещества должны проявлять волновые свойства. Согласно этой идее, импульс частицы с массой m и скоростью υ равен р = mυ, а с другой стороны, он равен p= h/λ. Следовательно, движущейся частице можно поставить в соответствие волну с длиной: λБ = h/p = h/mυ. Величину λБ называют дебройлевской длиной волны частицы. Экспериментально волновые свойства микрочастиц были обнаружены в опытах по дифракции электронов на кристаллах. Наличие волновых свойств у частиц вносит ограничения в применимости к ним классической механики, согласно которой частица в любой момент времени занимает определенное положение в пространстве и обладает определенным импульсом. Когда проводится какое-либо измерение, его результат содержит некоторую неопределенность, обусловленную двумя факторами: корпускулярно-волновым дуализмом и неизбежным взаимодействием наблюдаемого объекта с регистрирующим прибором, приводящим к изменению состояния объекта. Поэтому существует предел, ограничивающий точность измерений. Этот предел не зависит от степени совершенства измерительного прибора, а присущ самой природе вещей. Это и есть принцип неопределенностей Гейзенберга. Количественные соотношения, выражающие этот принцип для конкретных динамических переменных, называются соотношениями неопределенностей. Наиболее важными являются два из них:
Первое соотношение утверждает, что нельзя измерить одновременно с абсолютной точностью положение (координату) и проекцию импульса микрочастицы на ту же ось. Чем точнее мы пытаемся определить положение объекта, т.е. чем меньше Δ х, тем больше будет неопределенность импульса Δ рx. Этот вывод можно понять из следующих рассуждений: пусть мы хотим как можно точнее узнать положение микрочастицы (Δ х→0). Для этого мы должны использовать фотоны с малой длиной волны λ (именно λ определяет точность измерения положения ∆х) и, соответственно, большим импульсом рf = h/λ. В результате такого соударения двух частиц измеряемая частица приобретает непредсказуемый импульс. Если же мы попытаемся точно измерить проекцию импульса, то большой окажется неопределенность в положении объекта. Принцип неопределенностей в то же время не запрещает точно определить что-то одно: либо положение, либо импульс. Можно также с абсолютной точностью измерить координату и проекции импульса на другие оси. Согласно этому соотношению неопределенностей: а) объяснена устойчивость атома; при гипотетическом падении электрона на ядро неопределенность положения электрона уменьшилась бы на 5 порядков с 10 –10 м (размер атома) до 10 –15 м (размер ядра). На 5 порядков соответственно увеличилась бы неопределенность импульса электрона и он, получив бы такую энергию, не смог бы удержаться в ядре; б) невозможно определить траекторию движения микрочастицы (для этого необходимо знать в каждый момент времени абсолютно точно и координату и импульс частицы); Второе соотношение устанавливает связь между неопределенностью энергии Δ E квазистационарного возбужденного состояния и средним временем жизни Δ t возбужденного состояния в атомных процессах. Например, достаточно точно можно измерить энергию системы в стационарном состоянии, время жизни в котором велико (Δ t → ∞), если же система находится в нестационарном состоянии, время жизни Δ t в котором конечно, энергию можно измерить с погрешностью порядка Δ E ~ ħ /Δ t. Волновая функция, физический смысл и свойства. Состояние квантовой частицы нельзя определять, как в классической механике одновременным заданием в каждый момент времени координат и импульса. Это запрещено принципом неопределенностей. По аналогии с электромагнитной волной, для которой электромагнитное поле определяется заданием некоторой функции координат и времени E(x,y,z,t), для описания движения микрочастиц вводится некоторая функция координат и времени Ψ(x,y,z,t), характеризующая волну де Бройля, и получившая название волновой функции (ВФ). Сама волновая функция Ψ в общем случае комплексна и поэтому не имеет наглядного физического представления, ее нельзя продемонстрировать экспериментально. Согласно М.Борну, физический смысл имеет квадрат модуля ВФ Т.о, Волну де Бройля можно рассматривать как волну вероятности, амплитудой которой является волновая функция. Де Бройль постулировал, что свободное движение частицы с определенной энергией E и импульсом
Функция Ψ должна удовлетворять т.н. стандартным условиям. Она должна быть однозначной, поскольку микрочастица в определенный момент времени может находиться только в одной точке пространства. Волновая функция и ее частные производные по координатам являются непрерывными во всех точках пространства (при движении частица не может исчезать в одном месте и появляться в другом). И наконец, волновая функция должна быть конечна, т.е. нигде не обращаться в бесконечность. Поскольку значение Волновую функцию, для которой выполняется это соотношение, называют нормированной, а само равенство – условием нормировки волновой функции. Нахождение вида волновой функции частицы, движущейся под действием внешних сил, является основной задачей квантовой механики, так как задание волновой функции есть полное и исчерпывающее описание этой частицы. Это связано с тем, что вероятностное поведение микрочастиц лежит в самой их природе. Уравнение Шредингера. Волны де Бройля описывают состояние только свободной частицы. В 1926 г. Э.Шредингер обобщил гипотезу де Бройля на случай движения микрочастицы во внешнем силовом поле и получил уравнение, описывающее поведение (распространение) волн вероятности во внешних силовых полях. Это уравнение, в результате решения которого получается конкретный вид ВФ, получило название волнового уравнения, или уравнения Шредингера
где m – масса частицы, U(x,y,z,t) – потенциальная функция частицы в силовом поле. Как и все основные уравнения физики (например, законы Ньютона, уравнения Максвелла), уравнение Шредингера не имеет вывода. Правильность уравнения Шредингера и толкование смысла фигурирующей в нем волновой функции подтверждаются огромным опытным материалом современной физики. То, что уравнение Шредингера содержит лишь первую производную от Ψ по времени, связано с выражением принципа причинности: если известна волновая функция Ψ(x,y,z,0) частицы в начальный момент времени, то можно однозначно определить ее волновую функцию Ψ(x,y,z,t) в любые последующие моменты времени t > 0. Однако, точное знание ВФ для какой-либо точки пространства позволяет определить лишь вероятность обнаружения микрочастицы в этой точке. Часто потенциальная функция U частицы явным образом не зависит от времени и в этом случае она имеет смысл потенциальной энергии. Силы, действующие на частицу, а следовательно, и U(х,у,z) зависят только от координат. В этих случаях уравнение Шредингера можно упростить, исключив всякую зависимость от t. Это получается, если ВФ представить в виде произведения координатной и временной частей:
Подставив в зависящее от времени уравнение Шредингера это выражение и сократив все уравнение затем на общий экспоненциальный множитель, получим:
Это уравнение называется уравнением Шредингера для стационарных состояний. Волновое уравнение Шредингера играет в квантовой механике ту же роль, что 2 закон Ньютона в классической механике. Задать закон движения частицы в квантовой механике – значит определить Ψ -функцию в каждый момент времени в каждой точке пространства. Так как уравнение Шредингера является уравнением второго порядка в частных производных, то для его решения необходимо задавать начальные и граничные условия. Квантовая частица в потенциальной яме. Рассмотрим одномерное (вдоль оси х) движение частицы в потенциальном поле, называющемся бесконечно глубокой прямоугольной потенциальной ямой шириной ℓ:
Так как энергия частицы Е не может быть бесконечной, частица не может находиться вне ямы, поэтому вероятность ее обнаружения вне ямы, а значит, и волновая функция, равна нулю: w (x <0)= w (x>ℓ) и ψ (x <0)= ψ (x>ℓ)=0. Из условия непрерывности ВФ вытекает равенство нулю ВФ и на границе ямы: ψ(x=0)=ψ(x=ℓ)=0. Это граничные условия для решения уравнения Шредингера для частицы внутри потенциальной ямы: где Е — полная энергия частицы. Решение такого дифференциального уравнения имеет вид: ψ=A·sin(k·x), где Используя граничное условие ψ(ℓ)=0, получим: κn ·ℓ=n·π, где n =1,2,3,... – любое целое число, большее нуля (квантовое число). Еслиучесть, что импульс частицы pn = ħ·kn, то можнонайти возможные значения энергии частицы:
Уравнение Шредингера имеет решения, удовлетворяющие граничным условиям только при дискретных значениях квантового числа п. Энергия частицы в бесконечно глубокой потенциальной яме оказывается квантованной. Состояние частицы с наименьшей возможной энергией (n =1) называется основным, все остальные состояния – возбужденными. Волновая функция, отвечающая n -му уровню энергии: На границах ямы при х = 0 и х = ℓ всегда | ψn| 2 = 0, однако, вeроятность нахождения частицы в определенной точке внутри ящика может сильно меняться при разных значениях квантового числа п. Выводы: энергия микрочастицы, движущейся в потенциальной яме, пробегает дискретный ряд значений; даже в основном состоянии частица не находится в состоянии полного покоя; дискретный характер энергетических уровней проявляется при малой массе частиц и малых размерах области, в которой происходит движение; при больших значениях квантовых чисел и пространственно неограниченном движении квантовомеханические соотношения переходят в формулы классической физики. Квантовым гармоническим осциллятором называется микрочастица массы т, находящаяся в параболической потенциальной яме вида U(x)=κ·x2/2 и совершающая гармоническое движение с частотой ω; κ -постоянная. Модель квантового осциллятора особенно полезна при исследовании малых колебаний систем около положения равновесия, например, колебаний атомов в узлах кристаллической решетки или колебаний атомов около их положений равновесия в молекуле. По аналогии с классической теорией (пружинный маятник) положим
Полученное уравнение имеет конечные, однозначные и непрерывные решения, т.е. собственные функции, не для всех значений энергии Е, а только при собственных значениях, удовлетворяющих условию: Число nυ называется колебательным квантовым числом. Из последнего равенства следует, что энергия квантового осциллятора квантуется. Энергетический спектр представляет собой эквидистантные, т.е. отстоящие друг от друга на одинаковую величину Δ E=ħω, уровни. Минимальная энергия, которой может обладать квантовый осциллятор, равна Е 0 = ħω / 2 и называется энергией нулевых колебаний, или нулевой энергией и соответствует абсолютному нулю температур. То, что минимальная энергия осциллятора не может быть равна нулю даже при 0К, находится в соответствии с признанием относительности покоя и вечности движения. Если бы энергия частицы равнялась нулю, то это означало бы, что частица покоится и ее импульс и координата одновременно имеют точные значения, что противоречит принципу неопределенностей. Существование нулевых колебаний доказывают опыты по наблюдению рассеяния света прозрачными кристаллами при сверхнизких (вплоть до 10 – 6К) температурах. Расчет показывает, что для квантового осциллятора возможны переходы только между соседними уровнями, т.е. с изменением квантового числа nυ на единицу: Δ nυ = ±1. Это условие называется правилом отбора, оно показывает, какие из всех мыслимых переходов реализуются в действительности. При каждом из переходов излучается или поглощается фотон (или другая частица – фонон) с энергией ħω, где ω – его циклическая частота. КВАНТОВАЯ ТЕОРИЯ АТОМА. Оптические атомные спектры. Известно, что в излучении нагретых тел представлены все длины волн (сплошной спектр). Если нагреть до достаточно высокой температуры атомарный газ, то в спектре его излучения (спектре испускания) появляются яркие светящиеся линии с определенными дискретными длинами волн. Такие спектры называются линейчатыми. Каждый химический элемент обладает собственным линейчатым спектром. Простейшим является атом водорода: он состоит из протона и электрона. У водорода самый простой спектр. Дж. Бальмер при изучении видимой части спектра водорода обнаружил четыре спектральные линии с частотами 4,552; 6,173; 6,912 и 7,317 (в 1014 с-1) и показал, что частоты этих линий могут быть рассчитаны по формуле: Установлено, что по мере увеличения частоты линии располагаются все ближе и ближе друг к другу и становятся все менее интенсивными. Вблизи линии с частотой 0,8242·1015 с-1 линии сгущаются настолько, что их трудно различить. Эта частота, соответствующая п=∞, называется границей серии, после нее уже не наблюдается отдельных линий, а имеется слабо выраженный сплошной спектр. Совокупность спектральных линий, обнаруживающих в своей последовательности и в распределении интенсивности описанную выше закономерность, называется спектральной серией. Наряду с серией Бальмера в спектре атома водорода был обнаружен ряд других серий, представляемых совершенно аналогичными формулами:
В ультрафиолетовой области Лайман открыл серию линий, частоты которых соответствуют значению m = 1. В инфракрасной области были обнаружены другие спектральные серии (серии Пашена m = 3, Брэкета m =4, Пфунда m = 5 и т.д.). Вид этих формул, дискретность частот, определяемую целыми числами n и m, не смогла объяснить классическая физика. Боровская модель атома водорода. Спектральные серии и устойчивость атома водорода Н.Бор объяснил на основе двух постулатов: Первый постулат: в атоме существуют такие орбиты, двигаясь по которым электроны энергии не излучают. Эти орбиты называются стационарными. Второй постулат: при переходеэлектронас одной стационарной орбиты на другуюиспускается или поглощается один фотон, энергия которого (в силу закона сохранения энергии) определяется соотношением: h·ν mn= E m – E n, где E m и En — энергии электрона в m -ом и n -ом стационарных состояниях. Стационарными орбитами считаются такие, на которых момент импульса электрона равен целому кратному ħ (условие квантования Бора). Момент импульса частицы массы т, движущейся по окружности радиусом r соскоростью υ, равен L = m·υ·r. Поэтому условие квантования Бора имеет вид: m·υ·rn = n·ħ, где n = 1,2,3,... Целое положительное число n называется квантовым числом орбиты, rn – радиус n -ой стационарной орбиты. Условие квантования можно получить, если считать, что на стационарной орбите укладывается целое число волн де Бройля, соответствующих электрону на этой орбите,: 2π· r n= n · λ Б. Если считать орбиту электрона круговой, то уравнение движения электрона по 2 закону Ньютона: Решая это уравнение совместно с условием квантования находим для радиуса n –стационарной орбиты: Полная энергия электрона в атоме водорода равна сумме его кинетической и потенциальной энергий: Решая это уравнение совместно с условиями квантования орбит и радиусов орбит находим для энергии стационарных состояний:
Энергия, равная 13,6 эВ, необходимая для удаления электрона из атома, называется энергией связи, или энергией ионизации Ei. При переходе с m –ой орбиты на n –ую испускается фотон с частотой:
Множитель Несмотря на успехи, модель атома водорода Бора была непоследовательна, т.к. в ней, с одной стороны, постулируется квантование орбит, а с другой стороны, движение электрона по орбите рассматривается классически. Атом водорода. Квантовомеханическое рассмотрение. Атом водорода представляет собой один электрон, находящийся в сферически симметричном поле положительно заряженного ядра. Потенциальная энергия взаимодействия электрона и ядра: ψ (r,θ,φ) = R (r)· Y (θ)· Ф (φ). В результате подстановки ψ (r,θ,φ) и разделения переменных уравнение разбивается на три независимых уравнения относительно r, θ и φ, соответственно. Учет физических условий приводит к возможным значениям R{r), Y (θ) и Ф (φ), а следовательно, и ψ -функции. При этом обнаруживается дискретность состояний. Математически дискретность состояний заключается в том, что каждая из трех функций имеет дискретный набор значений, описываемых соответствующими квантовыми числами: 1) главное квантовое число п = 1,2,3.... 2) орбитальное квантовое число ℓ = 0,1,2,...(n – 1) – определяет геометрическую форму разрешенной для электрона области – орбиталь. Это число ℓ определяет значение орбитального момента импульса Lℓ электрона относительно ядра: 3) магнитное квантовое число mℓ = 0, ±1,±2,... ± ℓ, всего 2 ℓ + 1 значений. Это число определяет проекции орбитального момента импульса электрона на некоторое выделенное направление z: Lℓz =mℓ ·ħ. По другому, оно определяет ориентацию в пространстве орбитали. Правило отбора: Δ mℓ = 0,±1; 4)спиновое квантовое число mS, которое получается не из уравнения Шредингера, а из совокупности опытных данных. Это число может принимать только два значения (±½) и определяет возможные значения проекции LSZ на ось z собственного спинового момента импульса LS электрона: LSz = mS ·ħ. Правило отбора для спинового квантового числа: Δ m S = 0. Механическим моментам (орбитальному Lℓ и спиновому LS) соответствуют магнитные моменты, т.к. электрон – заряженная частица. Перечисленные четыре квантовых числа п, ℓ, mℓ и mS полностью описывают состояние электрона в атоме. Спин. Расчет с помощью уравнения Шредингера энергетического спектра атома водорода показал незначительное расхождение теории с экспериментом. Высокоточные измерения обнаруживают т.н. тонкую структуру уровней энергии – их расщепление на ряд близких подуровней. Полностью объяснить феномен тонкой структуры смогли лишь на основе такого фундаментального квантово-механического понятия, как спин элементарной частицы. К этому понятию привели результаты опытов О. Штерна и В. Герлаха, еще в 1922 г. наблюдавших расщепление (раздвоение) узкого пучка атомов серебра под действием неоднородного магнитного поля. Подобное поведение атомов можно объяснить, лишь предположив, что электрон, кроме орбитального, обладает собственным моментом импульса– спином и связанным с ним собственным магнитным моментом. Такое предположение было сделано в 1925 г. Дж. Уленбеком и С. Гаудсмитом. Для квантово-механического описания микрочастицы необходимо задать проекцию спина на выбранную ось. Проекция спина может дискретно меняться на величину, кратную ћ. Число проекций равно в общем случае 2s + 1, где s– спиновое число частицы. Так, например, для электрона, имеющего спиновое число s=½ и спин Значениями спина отличаются два фундаментальных класса элементарных частиц: фермионы имеют полуцелый спин, а бозоны – целочисленный спин. Спин, равный 1/2ћ, имеют электрон, протон, нейтрон, нейтрино, мюон и др. Спин фотона и глюона равен 1ћ, гравитона 2ћ. Спин элементарных частиц лежит в основе квантовой статистики и влияет на поведение систем, состоящих из тождественных частиц. Спин лежит в основе фундаментального принципа квантовой теории – принципа Паули, согласно которому две тождественные частицы с полуцелым спином (фермионы) не могут одновременно находиться в одном и том же квантовом состоянии. Благодаря этому принципу смогли объяснить образование электронных оболочек в атомах и связанную с этим закономерность периодической таблицы Менделеева; формирование ядерных оболочек и их строение; понять химическую связь молекул и многое другое. Со спином связывают появление таких необычных свойств, как сверхтекучесть гелия и сверхпроводимость у некоторых веществ.
Элементы квантовой статистики. Метод, позволяющий перейти от исследования движения отдельных частиц к поведению систем из огромного их числа, называется статистическим. При применении квантовой механики к системам одинаковых частиц были обнаружены свойства, не имеющие классических аналогов. Впервые это стало очевидным при построении теории электронных оболочек многоэлектронных атомов и при рассмотрении равновесного излучения как газа фотонов. Условия применимости классической статистики – это условия, при которых в движении микрообъектов не проявляются квантовые эффекты. Классические частицы всегда можно различить по их состояниям: координатам и импульсам. Три основных отличия квантовой статистики от классической: 1) квантовая механика – статистическая теория. Состояние квантовой системы определяется вероятностными законами распределения; 2) в квантовой механике многие физические величины могут принимать лишь дискретный ряд значений, в классической механике они непрерывны; 3) наиболее важное отличие классической и квантовой статистик связано с принципом тождественности, имеющим место только в квантовой механике. Поскольку в силу принципа неопределенностей понятие траектории частицы утрачивает смысл, то и различить частицы одинаковой природы невозможно, т.е. частицы становятся тождественными. Кроме того, системы частиц с целым (бозоны) и полуцелым (фермионы) спином подчиняются разным законам. Бозоны описываются симметричными волновыми функциями (перестановка двух бозонов не изменяет ни одной из характеристик системы бозонов). К бозонам относятся частицы-переносчики взаимодействия, например, фотоны, глюоны, фононы, гравитоны. В каждом квантовом состоянии может находиться неограниченное количество бозонов. Их распределение по состояниям описывается т.н. статистикой Бозе–Эйнштейна. Фермионы описываются антисимметричной волновой функцией (при перестановке двух фермионов волновая функция, описывающая систему фермионов, изменяет знак). К фермионам относятся частицы вещества, например, электроны, протоны, нейтроны, кварки и др. Они подчиняются принципу Паули: в каждом квантовом состоянии может находиться только одна частица. Их распределение по состояниям описывается статистикой Ферми–Дирака. Различие статистик легко понять на следующем модельном примере: пусть нам надо распределить две частицы a и b по двум состояниям. Классические частицы можно распределить 4 способами; бозоны с учетом тождественности частиц – 3 способами; фермионы с учетом тождественности частиц и принципа Паули – 1 способом.
В случае, когда дискретностью квантовых состояний можно пренебречь, например, при высоких температурах, оба распределения перейдут в классическое распределение Больцмана. Периодическая система элементов. По мере увеличения порядкового номера Z атома происходит последовательное заполнение электронных уровней атома в соответствии с принципом Паули: в атоме не может быть электронов с одинаковыми значениями всех четырех квантовых чисел п, ℓ, mℓ, mS. Поэтому каждый следующий электрон невозбужденного атома должен занимать самый глубокий из еще не заполненных уровней. Каждому значению п соответствует 2п2 состояний, отличающихся друг от друга значениями квантовых чисел ℓ, mℓ, mS. Совокупность электронов атома с одинаковыми значениями квантового числа п образует оболочку. Оболочки обозначают большими буквами латинского алфавита: п (Оболочка): 1(К), 2(L), 3(М), 4(N)… Оболочки подразделяют на подоболочки, различающиеся орбитальным квантовым числом ℓ. Число состояний в подоболочке равно 2(2· ℓ +1). Подоболочки обозначают в виде 1 s; 2 s, 2 p; 3 s, З р, 3 d;...,,где цифра означает квантовое число п, т.е. принадлежность к соответствующей оболочке, а буква – орбитальное состояние или орбиталь согласно схеме: ℓ (Орбиталь): 0(s), 1(p), 2(d), 3(f)… Различные состояния в подоболочке отличаются значениями квантовых чисел mℓ и mS. Число возможных состояний в К, L, М, N,... оболочках равно соответственно 2, 8, 18, 32,..., т.е. 2 n 2. Заполнение периодической системы элементов основано на идее об оболочечной структуре электронного облака атома. Каждый следующий атом получается из предыдущего добавлением к заряду ядра единицы и добавлением одного электрона, помещаемого в разрешенное принципом Паули состояние с наименьшей энергией. Распределение электронов по состояниям называется электронной конфигурацией, например, для атома хлора (Z=17): 1s22s22p63s23p5. Оболочка или подоболочка, полностью заполненная электронами, называется замкнутой и соответствует инертному газу. Наблюдаемая периодичность химических и физических свойств атомов объясняется поведением внешних валентных электронов. Лазер. Между энергетическими уровнями атомов могут осуществляться следующие переходы: 1.Самопроизвольныепереходысуровней с большей энергией на уровни с меньшей энергией. В результате наблюдается спонтанное излучение – испускание атомами фотонов. 2. П
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 2777; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.240.101 (0.014 с.) |

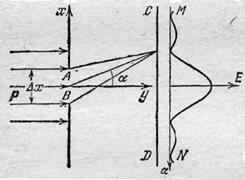 Рассмотрим связь волновых и квантовых свойств света на примере прохождения света через щель в непрозрачном экране (рис.). Предположим, что параллельный пучок монохроматических световых лучей проходит через щель АВ вдоль оси ординат. На экране CD, расположенном за щелью, возникает дифракционная картина. В каждую точку экрана х попадает плоская гармоническая волна: E(x,t)=E0·exp(-i·k·x) · exp(-i·ω·t)= E(x) · exp(-i·ω·t) и наблюдается определенная освещенность, пропорциональная интенсивности I(x) вэтой точке. На рис. справа изображено распределение интенсивности света по экрану, пропорциональное квадрату амплитуды Е(х) световой волны I(x)~E(x) 2.
Рассмотрим связь волновых и квантовых свойств света на примере прохождения света через щель в непрозрачном экране (рис.). Предположим, что параллельный пучок монохроматических световых лучей проходит через щель АВ вдоль оси ординат. На экране CD, расположенном за щелью, возникает дифракционная картина. В каждую точку экрана х попадает плоская гармоническая волна: E(x,t)=E0·exp(-i·k·x) · exp(-i·ω·t)= E(x) · exp(-i·ω·t) и наблюдается определенная освещенность, пропорциональная интенсивности I(x) вэтой точке. На рис. справа изображено распределение интенсивности света по экрану, пропорциональное квадрату амплитуды Е(х) световой волны I(x)~E(x) 2.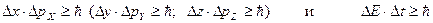 .
.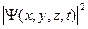 , с помощью которого определяется вероятность dP того, что частица в момент времени t будет обнаружена в элементе объема dV, расположенном в окрестности точки х, у,z:
, с помощью которого определяется вероятность dP того, что частица в момент времени t будет обнаружена в элементе объема dV, расположенном в окрестности точки х, у,z: 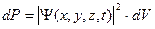 .
.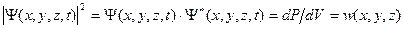 , где Ψ * означает комплексно сопряженную к Ψ величину, является плотностью вероятности.
, где Ψ * означает комплексно сопряженную к Ψ величину, является плотностью вероятности.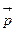 описывается волновой функцией вида:
описывается волновой функцией вида: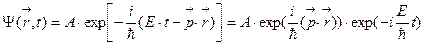 .
. 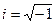 – мнимая единица.
– мнимая единица.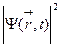 , вычисленное в некоторой точке, пропорционально вероятности Р обнаружения частицы, описываемой функцией Ψ, в этой точке, то интеграл от
, вычисленное в некоторой точке, пропорционально вероятности Р обнаружения частицы, описываемой функцией Ψ, в этой точке, то интеграл от 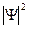 по всему пространству должен быть конечным, так как в любом случае частица где-то должна быть. Обычно этот интеграл приравнивают единице:
по всему пространству должен быть конечным, так как в любом случае частица где-то должна быть. Обычно этот интеграл приравнивают единице: 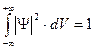 .
.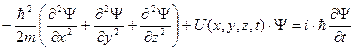 ,
,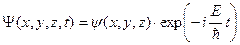 .
.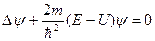 , где
, где 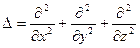 - т.н. оператор Лапласа.
- т.н. оператор Лапласа.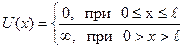 .
.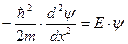 ,
,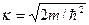 - волновое число.
- волновое число.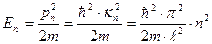 .
.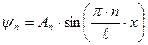 . Постоянную Аn определим из условия нормировки
. Постоянную Аn определим из условия нормировки 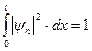 ;
; 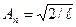 и
и 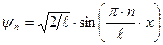 .
.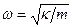 . Тогда для потенциальной энергии получим:
. Тогда для потенциальной энергии получим: . Стационарное уравнение Шредингера в данном случае будет иметь вид:
. Стационарное уравнение Шредингера в данном случае будет иметь вид: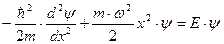 .
.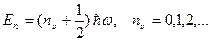
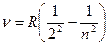 , где для первых четырех линий n принимает значения 3, 4, 5 и 6. R= 3,29·1015 c-1 - постоянная Ридберга, была определена экспериментально. Впоследствии были обнаружены линии, соответствующие другим значениям п> 6.
, где для первых четырех линий n принимает значения 3, 4, 5 и 6. R= 3,29·1015 c-1 - постоянная Ридберга, была определена экспериментально. Впоследствии были обнаружены линии, соответствующие другим значениям п> 6.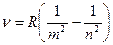 , m =1,2,3,… n=m+1,m+2,… Это т.н. обобщенная формула Бальмера.
, m =1,2,3,… n=m+1,m+2,… Это т.н. обобщенная формула Бальмера.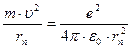 .
.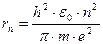 . Радиус ближайшей к ядру орбиты (т.н. первой боровской орбиты с п = 1) равен r1 =0,53·10 - 10м.
. Радиус ближайшей к ядру орбиты (т.н. первой боровской орбиты с п = 1) равен r1 =0,53·10 - 10м.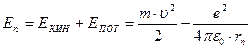 .
.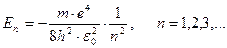 Из последнего соотношения видно, что так же, как и радиусы орбит, энергия электрона квантуется, т.е. принимает ряд дискретных значений. Ближайшая к ядру орбита (n =1) имеет самую низкую энергию (основное состояние):
Из последнего соотношения видно, что так же, как и радиусы орбит, энергия электрона квантуется, т.е. принимает ряд дискретных значений. Ближайшая к ядру орбита (n =1) имеет самую низкую энергию (основное состояние):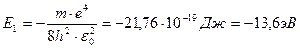 .
.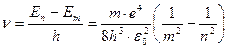 , что совпадает с формулой Бальмера.
, что совпадает с формулой Бальмера.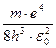 равен 3,29·1015 с-1, что совпадает с постоянной Ридберга.
равен 3,29·1015 с-1, что совпадает с постоянной Ридберга.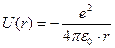 , т.е. можно считать, что электрон движется в гиперболической потенциальной яме. Уравнение Шредингера принимает вид:
, т.е. можно считать, что электрон движется в гиперболической потенциальной яме. Уравнение Шредингера принимает вид: 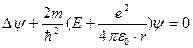 и его удобнее решать в сферической системе координат r, θ и φ. При этом решение ищется в виде произведения трех функций, каждая из которых зависит от одной переменной:
и его удобнее решать в сферической системе координат r, θ и φ. При этом решение ищется в виде произведения трех функций, каждая из которых зависит от одной переменной: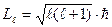 . При переходах из одного состояния в другое ℓ изменяется в соответствии с правилом отбора Δ ℓ = ±1. Правило отбора по квантовому числу ℓ обусловлено законом сохранения момента импульса.
. При переходах из одного состояния в другое ℓ изменяется в соответствии с правилом отбора Δ ℓ = ±1. Правило отбора по квантовому числу ℓ обусловлено законом сохранения момента импульса.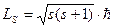 ; s = ½;
; s = ½;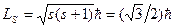 , проекция его спина на выбранную произвольную ось z
, проекция его спина на выбранную произвольную ось z 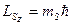 может принимать два значения (mS=±½):
может принимать два значения (mS=±½):  .
.


