
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Распределение молекул по скоростям.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Среднюю квадратичную скорость молекул газа при температуре Т можно оценить по (2) и (6):
Кривая на рисунке имеет максимум, т. е. молекул со скоростью Для нахождения положения максимума, т. е. наиболее вероятной скорости При повышении температуры кривая деформируется,
Молекулы газа, находящиеся в поле тяготения, участвуют в тепловом движении и испытывают действие силы тяжести. Это приводит к стационарному состоянию, при котором наблюдается уменьшение концентрации n и давления p газа с возрастанием высоты над Землей. К этому выводу можно прийти путем таких рассуждений. На рисунке показан столб газа. На высоте h выделим слой толщиной dh. Слой dh давит своей тяжестью dm·g = ρ·S·dh·g на нижний слой. В результате давление (сила на единицу площади) над слоем будет на dp = ρ·g·dh меньше, чем под слоем и связь между ρ и h будет такой: –dp= ρ·g·dh. Перед dp поставлен знак «минус», так как с увеличением h давление р не возрастает, а убывает, приращения dh и dp имеют разные знаки. Если заменим, использовав (8), dp на k·T·dn и плотность ρ на m0·n, то получим:
где n0– концентрация молекул у поверхности (h=0), εП – потенциальная энергия молекулы (в общем случае не только в поле силы тяжести). (17) справедливо, если Т с высотой не меняется, что не всегда так. Это очень важное не только для этого раздела выражение – формула Больцмана – распределение числа частиц по энергии.
ОСНОВЫ ТЕРМОДИНАМИКИ Термодинамика – учение о превращениях одного вида энергии в другой, о передаче энергии от тела к телу. Термодинамика изучает свойства макроскопических тел без рассмотрения их молекулярной структуры. Термодинамическая система (ТС) – макроскопические тела, которые могут обмениваться энергией как друг с другом, так и с внешней средой. Равновесное состояние ТС - состояние, при котором термодинамические параметры (давление, температура и объем) остаются постоянными сколь угодно долго при неизменных внешних условиях. Термодинамический процесс – изменение состояния ТС, характеризующееся изменением ее параметров. Состояние ТС характеризуют также внутренней энергией, которая равна сумме кинетических энергий беспорядочного движения всех молекул и потенциальных энергий взаимодействия молекул друг с другом. Система тел называется изолированной, или замкнутой, если нет обмена энергией с окружающей средой. Первое начало термодинамики Тела и системы могут обмениваться энергией друг с другом. Существует два вида обмена энергией. Это может быть работа, произведенная одним телом (системой) над другим телом (системой). Примером может служить перемещение тела или его частей под действием упругих, электрических или других сил. Другой способ обмена энергией – путем передачи энергии неупорядоченного, хаотического движения молекул. Тогда говорят о передаче тепла. Например, передача энергии от нагретого тела к холодному происходит за счет передачи кинетической энергии хаотически движущихся молекул одного тела хаотическому движению молекул другого тела. В обоих этих случаях изменяется внутренняя энергия U. Сказанное выше можно записать как: Δ U = Q + А’, где Q – энергия, поступающая в систему при теплообмене, а А’ – работа, совершаемая внешними телами над системой. Исторически принято это соотношение записывать как: Q = ΔU + А (18), где А = – А’ –работа, совершаемая самой системой. (18), представляющее собой закон сохранения энергии, получило название первого начала термодинамики: «Подведенное к телу количество теплоты идет на увеличение внутренней энергии тела и на работу, которую тело производит». Очень важно отметить различие между величинами U с одной стороны, и А и Q – с другой. Внутренняя энергия U – это функция состояния системы. Если в состоянии 1 внутренняя энергия равна U1, то что бы ни происходило с системой, какую бы работу она ни совершала, какие бы количества теплоты к ней ни подводились, если система вернулась в то же состояние 1 (т. е. процесс оказался круговым, совершен цикл), ее внутренняя энергия будет снова U1 (Δ U =0). В то же время Q и А – это только передаваемые телу или получаемые от тела порции энергии. Они связаны с передачей энергии, а не с каким-то запасом их в теле. Бессмысленно говорить о запасе работы в теле. И так же бессмысленно говорить о запасе теплоты в теле. Работа и теплота не являются функциями состояния тела. Переходя к бесконечно малым порциям энергии, запишем первое начало в дифференциальной форме: δQ = dU + δA. (19). Здесь специально даны разные обозначения бесконечно малых («d...» и «δ …»), чтобы отразить то обстоятельство, что U – функция состояния, a Q и А – нет.
|
||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 729; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.72.210 (0.007 с.) |

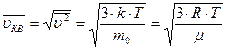 (12).
(12). Однако, отдельные молекулы даже в случае одного типа газа имеют разные скорости. Разброс по скоростям может быть весьма велик. Это отражено на рисунке, на котором по вертикали отложена доля от общего числа молекул в единице объема Δ n/n, имеющих скорости в некотором интервале от υдо υ + Δ υ, в расчете на единицу этого интервала, т. е. Δ n/(n· Δ υ).
Однако, отдельные молекулы даже в случае одного типа газа имеют разные скорости. Разброс по скоростям может быть весьма велик. Это отражено на рисунке, на котором по вертикали отложена доля от общего числа молекул в единице объема Δ n/n, имеющих скорости в некотором интервале от υдо υ + Δ υ, в расчете на единицу этого интервала, т. е. Δ n/(n· Δ υ). больше всего (
больше всего ( – наиболее вероятная скорость). Видно, что есть молекулы с υ, близкими к нулю, и есть молекулы с очень большими υ. Максвелл теоретически вывел формулу для этой функции распределения f(υ):
– наиболее вероятная скорость). Видно, что есть молекулы с υ, близкими к нулю, и есть молекулы с очень большими υ. Максвелл теоретически вывел формулу для этой функции распределения f(υ):  (13).
(13). (14).
(14). Распределение Больцмана
Распределение Больцмана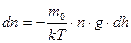 (15). Вычислив определенный интеграл от (15),
(15). Вычислив определенный интеграл от (15),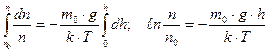 (16) получим выражение
(16) получим выражение  (17),
(17),


