
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нарушения секреции тиреокальцитонинаСодержание книги
Поиск на нашем сайте
Проявляются расстройствами обмена ионов кальция и фосфата, главным образом, в костной ткани, а также в стенке кишок и почках, сказывающимися изменениями их содержания в крови. Клинически имеет значение лишь гиперпродукция тиреокальцитонина. Последняя возникает при опухолях парафолликулярных клеток ЩЖ. При этом наблюдается торможение резорбции Са 2+ в костях, всасывания Са 2+ в кишках и реабсорбции Са 2+ в канальцах почек. Итогом является развитие незначительной гипокальциемии То есть тиреокальцитонин проявляет антагонистическое по отношению к паратгормону действие.
Тиреоидиты Термином "тиреоидиты" объединяются различные по этиологии и патогенезу воспалительные заболевания ЩЖ, имеющие сходную клиническую симптоматику. По клиническому течению и патоморфологическим изменениям различают следующие виды тиреоидитов: 1) острый и подострый тиреоидиты, которые могут быть диффузными и очаговыми, инфекционными и неинфекционными; 2) хронические тиреоидиты, которые могут быть аутоиммунными, фиброзно-инвазивными, специфическими (туберкулезными, сифилитическими, актиномикозными, лимфогранулематозными, амилоидозными). Острые тиреоидиты вызываются как бактериальной инфекцией, так и травмами (механическими, лучевыми), приводящими к кровоизлияниям в железу и развитию асептического воспаления.При инфекционном тиреоидите функция ЩЖ нормальная или снижена, а при неинфекционных острых тиреоидитах, как правило, увеличена. Лечение осуществляют антибиотиками (к которым чувствителен возбудитель). Проводят также симптоматическое лечение: анальгетики, b-адреноблокаторы и др. Подострый тиреоидит (гранулематозный тиреоидит) является наиболее распространенной формой заболевания, особенно в осенне-зимний сезоны года, у женщин в возрасте 30-40 лет. Заболевание возникает после перенесенной вирусной инфекции (кори, паротита, аденовирусных заболеваний). Оно характеризуется увеличением ЩЖ за счет появления и разрастания гранулем, приводящего к повреждению части фолликулов, отеку и инфильтрации интерстициальной ткани, а также повышению функциональной активности сохраненных фолликулов. Последнее и приводит к клинической картине тиреотоксикоза. Со временем (через 6-8 месяцев) функция ЩЖ нормализуется. Лечебный эффект дают глюкокортикоидные препараты или препараты салицилового или пиразолидонового ряда. Антибиотики и мерказолил не эффективны. Хронические тиреоидиты наиболее часто имеют аутоиммунное происхождение. Выделяют следующие его основные клинические формы: 1) аутоиммунный (лимфоцитарный) тиреоидит, 2) тиреоидит Хасимото (Хашимото), 3) послеродовой тиреоидит и др. Для всех этих форм тиреоидитов характерно: наличие антигенов и антител, возможность моделирования заболевания на животных, возможность переноса заболевания (с помощью антигенов, антител и иммунокомпетентных клеток) от больного животного здоровому. Аутоиммунный (лимфоцитарный) тиреоидит (АИТ) является одним из наиболее частых заболеваний ЩЖ. У детей встречается в 0,1-1,2% случаев, у женщин страше 60 лет – в 6-11% случаев. Больные женщины встречаются в 2,5 раза чаще, чем больные мужчины. Впервые данное заболевание описано Х.Хашимото (H. Hashimoto) в 1912 году. В этиологии АИТ ведущее значение имеет наличие наследственного предрасположения к его развитию. Так, если у разнояйцовых близнецов АИТ возникает в 3-9% случаев, то у однояйцовых – в 30-60% случаев. АИТ довольно часто сочетается с другими аутоиммунными заболеваниями. В патогенезе развития АИТ большую роль играет генетически детерминированный дефект иммунного ответа, приводящего к Т-лимфоцитарной агрессии против собственных тиреоцитов, завершающейся их разрушением. Клиника АИТ. В большинстве случаев АИТ манифестирует в возрасте между 30 и 60 годами. Различают две основные клинические формы АИТ: в 90% случаев – гипертрофическая (зоб Хашимото) и в 10% случаев – атрофическая (первичная микседема). АИТ длительное время протекает бессимптомно, в 10% случаев возникает транзиторный (не более 6 месяцев) тиреотоксикоз, однако рано или поздно, но все равно (примерно в 80% случаев) завершается развитием субклинического и манифестного гипотиреоза. Лечение АИТ в подавляющем большинстве случаев консервативное. Преимущественно включает назначение тироксина, который не только компенсирует сниженную функцию ЩЖ, но и уменьшает выработку гипофизом ТТГ. Последний способствует высвобождению измененного тиреоглобулина в кровь, к которому образуются антитела, поддерживающие прогрессирование АИТ. Применение глюкокортикоидов, иммунномодуляторов, плазмофереза, гемосорбции, лазерной терапии не всегда эффективно. В основе тиреоидита Хашимото лежит генетически обусловленный дефект иммунокомпетентных клеток (главным образом, Т-супрессоров). Последний приводит к срыву естественной толерантности и инфильтрации ЩЖ макрофагами, лимфоцитами и плазматическими клетками. Образуются антитела к тиреоглобулину, микросомальному антигену, рецепторам ТТГ. Последнее приводит к образованию иммунных комплексов и выработке различных ФАВ. Итогом является снижение функции ЩЖ (как на фоне гипертрофических, так и атрофических ее изменений). Лечение осуществляется препаратами тиреоидных гормонов, исключением йодсодержащих веществ, осторожным назначением глюкокортикоидных препаратов. При угрозе малигнизации проводится струмэктомия.
Зоб Зоб (struma) - это патологически увеличенная щитовидная железа, имеющая различ- ные причины, механизмы и клинические проявления. В основе развития зоба чаще лежат следующие процессы: 1) гипертрофия и гиперплазия тиреоидного эпителия и/или соединительной ткани; 2) новообразования (доброкачественные и злокачественные; 3) воспаление (острое, хроническое, асептическое, септическое и др.). В зависимости от функциональной активности различают следующие виды зоба: 1) эутиреоидный (характеризуется нормальной, ненарушенной функцией ЩЖ), 2) эндемический (характеризуется пониженной функцией ЩЖ), 3) тиреотоксический (характеризуется существенно повышенной функцией ЩЖ, наблюдается при Базедовой болезни),
Рис. 37-10. Узловой зоб. Сначала эутиреоидный, затем гипотиреоидный (Балаболкин М.И., 1998)
37.4.9. Патология околощитовидных желез
Различают гиперпаратиреоз и гипопаратиреоз. Каждый из них может быть первичным и вторичным, врожденным и приобретенным, острым и хроническим. Проявляется нарушениями секреции паратгормона и/или чувствительности к нему рецепторно-клеточных структур организма. Гиперпаратиреоз (ГПТ) возникает в результате патологической гипертрофии и гиперплазии околощитовидных желез, либо их аденомы или аденокарциномы. Клинически различают костную (отеопоротическую, фирозно-кистозную остеодистрофию), висцеральную (с преимущественным поражением почек, пищеварительного тракта и нервно-психической сферы) и смешанную форму. ГПТ рассматривают приемущественно как фиброзно-кистозную остеодистрофию или болезнь Реклингаузена. Данным заболеванием чаще (в 2 - 3 раза) страдают женщины, особенно 20 - 50 лет. ГПТ развивается обычно медленно и характеризуется различными симптомами. Наиболее рано развиваются: общая и мышечная слабость, быстрая утомляемость при незначительной работе, снижение нервно-мышечной возбудимости, повышение раздражительности, плаксивости, появление депрессии, расшатывание и выпадение зубов, боли в мышцах, суставах и костях, развитие остеопороза, кистообразований и деформаций скелета, частых, обычно мало болезненных переломов костей конечностей и позвонков, медленное их заживление. Прогрессирующий остеопороз характеризуется существенным перемещением минеральных веществ их костей в мышцы и внутренние органы. Наблюдается отложение ионов Са2+ в почках, легких, сердце, сосудах и других тканях. То есть, происходит их обызвествление. В крови концентрация Са2+ увеличивается до 3,5-5 ммоль/л (14-20 мг %), а содержание неорганического фосфата, калия и магния снижается. Одновременно повышается выделение с мочой фосфатов. Распространенный нефрокальциноз приводит к прогрессированию почечной недостаточности. Могут развиваться панкреокальциноз, калькулезный холецистит. Появляется жажда, полиурия, рвота, тошнота. Организм обезвоживается, снижается чувствительность клеток канальцев к АДГ. Масса тела прогрессивно снижается. Часто развивается лихорадка. Тяжелыми осложнениями ГПТ являются гиперпаратиреоидный гиперкальциемический криз, почечная и/или сердечно-сосудистая недостаточность, уремическая кома, расстройства психики. Летальность при этом достигает 50-60 %. Гипопаратиреоз развивается вследствие гипотрофических и гипоплазических изменений клеток оклощитовидных желез. Наиболее частыми причинами его развития являются: операции на щитовидной и околощитовидных железах; лучевые, инфекционные, токсические факторы; недостаток кровоснабжения и иннервации; развитие гормонально-неактивных опухолей (сдавливающих гормонопродуцирующие клетки). Кроме органической гипофункции ОЩЖ нередко может развиться и функциональная ее недостаточность, в частности, при беременности, лактации, интенсивном росте тела (то есть в случаях существенного повышения потребностей организма в кальции). В патогенезе гипопаратиреоза важную роль играют: абсолютный или относительный дефицит паратгормона, а также снижение чувствительности к нему специфических рецепторов. Недостаток гормона приводит к снижению, во 1-х, мобилизации Са+2 из костей; во 2-х, реабсорбции Ca+2 в канальцах почек; в 3-х, всасывания Са+2 в кишках, а также к повышению реабсорбции в канальцах почек фосфата. В итоге развиваются гипокальциемия и гиперфосфатемия, гиперкальциурия и гипофосфатурия. Содержание Са+2 в крови с 2,2-3,0 ммоль/л (9-12 мг %) снижается даже до 1-1,2 ммоль/л (4-5 мг %), а неорганического фосфата возрастает. Нарушается соотношение двухвалентных ионов ( Са+2, Mg+2, P+2) и одновалентных ионов (Na+, К+), развивается алкалоз. По клиническому течению гипопаратиреоза различают манифестную (острую и хроническую) и скрытую (латентную) формы. Выделяют следующие основные клинические виды гипопаратиреоза: паратиреопривная тетания, спазмофилия, паратиреопривная кахексия. Паратиреопривная тетания характеризуется повышением нервно-мышечной возбудимости и проводимости, реактивности вегетативной нервной системы, судорожной готовностью множественными болезненными сокращениями скелетных мышечных волокон, переходящими сначала в клонические, а позже - в тонические судороги. Одновременно могут возникать судорожные сокращения гладких мышц (ларингоспазм, пилороспазм и др.). Больные отличаются вялостью, нарушением походки. У них снижается аппетит, дезинтоксикационная функция печени. Появляются жажда, одышка, гипотермия, головокружения, расстройства зрения, слуха, формирования зубов, появление и прогрессирование кариеса, нарушения трофики волос, ногтей, кожи. Спазмофилия чаще развивается у детей 1-2 лет и сочетается с рахитом. До 80% случаев имеет наследственное происхождение. Проявляется периодически возникающими судорожными сокращениями скелетных мышц, а также ларингоспазмом. Важным провоцирующим фактором является повышение температуры окружающей среды, дефицит кальция и витамина D в пище, алкалоз (рвота, гипервентиляция), отравления и др. Паратиреопривная кахексия - наиболее частая клиническая форма хронического гипопаратиреоза. У больных прогрессивно снижается аппетит, вплоть до развития анорексии. Характерны диспепсические расстройства, патология зубо-челюстного аппарата, двусторонняя катаракта, сухость, шелушение, экзема кожи, склонность к развитию кандидамикоза, инфицирования, дистрофических расстройств (склероза скелета), прогрессирующего исхудания организма.
ПАТОЛОГИЯ ПОЛОВЫХ ЖЕЛЕЗ
Различают гипо-, гипер- и дисфункции яичников и семенников, первичного и вторичного генеза наследственного приобретенного (как внутриутрубно, так и в постнатальный период жизни индивида) происхождения. Рассмотрим сначала патологию яичников, а затем - патологию семенников. Гипофункция (гипогонадизм) яичников - собирательный клинический термин, включающий различные по этиологии и патогенезу заболевания женских гонад, для которых характерны сходные симптомы полового недоразвития (аменорея, бесплодие, гипоэстрогения, гипоплазия и гипотрофия яичников и матки). Синдром истощения яичников (преждевременный климакс) является основ-ной клинической формой первичной овариальной гипофункции яичников. Он развивается у женщин 35-40 лет. В этиологии важную роль играют, во 1-х, различные патогенные факторы внешней среды, действующие в различные периоды онтогенеза; во 2-х, наследственная предрасположенность, генные мутации и аутоиммунные нарушения половых клеток яичников. Клинические расстройства возникают на фоне предшествующих в течение 12-20 лет нормальных менструальных и генеративных функций и проявляются в виде: аменореи, приливов жара к голове, повышенной потливости, слабости, утомляемости, болей в голове и сердце, снижения работоспособности. Определяются уменьшенные размеры яичников и матки, отсутствие желтых тел и фолликулов, низкий уровень эстрогенов и пролактина и резко повышенное содержание ЛГ и ФСГ в крови. Назначение эстрогенов и эстрогенгестагенных препаратов улучшает общее состояние больных. Изолированная гипогонадотропная (вторичная) гипофункция яичников, а также функциональные и органические расстройства гипоталамо-гипофизарной системы представляют важные клинические формы вторичной гипофункции яичников. В яичниках отмечается нормальное количество примордиальных фолликулов, которые однако не дозревают. Характерны первичная или вторичная аменорея, гипотрофия и гипоплазия яичников и матки, гипоэстрогения, при наличии обычно нормального содержания ФСГ, ЛГ, и ЛТГ. Синдром поликистозных яичников (синдром овариальной гиперандрогении неопухолевого генеза, синдром Штейна-Левенталя) имеет важное самостоятельное, клиническое значение. Этим заболеванием страдают до 3 % всех гинекологических больных особенно молодого возраста. В патогенезе ведущее значение имеет избыточная продукция андрогенов, сначала в надпочечниках, затем в яичниках, а также в результате нарушенного периферического их метаболизма. Одновременно определяется повышенный уровень ЛГ, нормальный или сниженный уровень ФСГ и чаще повышенное содержание пролактина в крови. Гиперандрогения с явлениями гирсутизма (рис. 37-11) и гипертрофией клитора сочетается с аменореей, ановуляцией, бесплодием, ожирением организма и развитием обильных acne vulgaris. То есть, развиваются явления псевдогермафродитизма. Вирилизирующие опухоли яичников (синдром овариальной гиперандрогении опухолевого генеза). Опухолевые клетки яичников продуцируют повышенные количества мужских половых гормонов: тестостерон, андростендион, дегидроэпиандростерон. Клинически проявляются либо отстуствием менструации (аменорея), либо нерегулярными скудными менструациями (олигоопсоменорея), либо ациклическими маточными кровотечениями (метроррагия). Формируются и прогрессируют герсутизм, облысение и телосложение по мужскому типу (рис. 37-12), огрубение голоса, снижение и исчезновение вторичных половых признаков (молочных желез, жировых отложений на бедрах, уменьшение матки и др.), возникновение гипертрофии и вирилизации клитора и формирование псевдогермафродитизма. Лечение: оперативное удаление опухоли в сочетании с химиотерапей и облучением. Спонтанный аборт обычно развивается в результате недоразвития желтого тела яичников и уменьшения секреции прогестерона.
Рис. 37-11. Гирсутизм при синдроме поликистозных яичников у больной. Рис. 37-12. Внешний вид больной с вирилизирующей опухолью яичников
Гипофункция (гипогонадизм) семенников (тестикулярная недостаточность) обусловлена снижением продукции и действия андрогенов, приводящем к недоразвитию половых органов, вторичных половых признаков и бесплодию. Первичный гипогонадизм проявляется гиперсекрецией гонадотропных гормонов, а вторичный – их гипосекрецией. Врожденный первичный гипогонадизм (врожденный или внутриутробный анорхизм) характеризуется отсутствием семенников у нормальных по генотипу и фенотипу мальчиков. Клинически проявляется отсутствием развития вторичных половых признаков в пубертатный период, недоразвитием скелета, возникновением ожирения и бесплодием. Пубертатная форма гипогонадизма характеризуется развитием выраженного евнухоиодного синдрома: отсутствием или резким снижением вторичных половых признаков, слабым развитием мускулатуры, высоким ростом, длинными конечностями, отложением подкожного жира по женскому типу, истинной гинекомастией, бледной кожей, недоразвитием полового члена, мошонки, яичек и нередко неопущением яичек в мошонку (крипторхизм), а также резким снижением содержания андрогенов и увеличением гонадотропинов в крови. Постпубертатная форма первичного гипогонадизма развивается после нормального периода полового развития организма в результате деструктивно-воспалительных процессов в тестикулах. Она характеризуется ослаблением и даже исчезновением вторичных половых признаков, уменьшением оволосения на лице и теле, гипоплазией семенников, прогрессирующем нарушением половых функций (либидо, эрекции, эякуляции, оргазма), приводящих к импотенции и бесплодию. На фоне гипогонадизма семенников, также как и яичников, отмечается раннее развитие и прогрессирование атеросклероза. Гиперфункция половых желез развивается в результате гормонально актиных опухолей (доброкачественных или злокачественных лейдигом и сертолеом) либо первичной или вторичной гиперплазии железистой ткани гонад. Сопровождается преждевременным (до 9-10 лет) половым созреванием и проявляется преждевременной гипертрофией наружных и внутренних половых органов, ранним и более сильным развитием вторичных половых признаков. У мальчиков под влиянием избытка андрогенов происходят более ранние: - оволосение тела по мужскому типу, особенно лобка, корня полового члена, медиальных поверхностей бедер, подмышечных впадин, лица; - рост яичек, мошонки, полового члена (в длину и ширину); - пигментация кожи, мошонки; - появление и усиление низкого голоса; - как развитие скелетных мышц и костей, так и прекращение их роста (внешне напоминают «маленьких геркулесов»). При увеличенной продукции гонадотропинов рано созревают спрематозиоды и организм мальчика способен к детопроизводству, а при сниженной их продукции – не способен. У девочек под влиянием избытка эстрогенов происходят более ранние: - увеличение и уплотнение сосков молочных желез; - оволосение тела по женскому типу, особенно лобка в виде треугольника; - рост больших и малых половых губ, клитора и всего тела; - появление менструаций; - как развитие скелетных мышц, подкожной жировой клетчатки в области таза и бедер, так и прекращение их роста. У девушек и женщин избыточная продукция эстрогенов сопровождается развитием персистирующих фолликулов (не достигающих полного созревания), приводящих к расстройству овуляции. При этом, как правило, наблюдаются, расстройства менструального цикла и возникают различного характера маточные кровотечения. Избыточная же продукция прогестерона характеризуется развитием псевдобеременности с гипертрофией матки, молочных желез и отсутсвием менструаций.
|
||||
|
Последнее изменение этой страницы: 2016-06-28; просмотров: 276; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.193.193 (0.014 с.) |

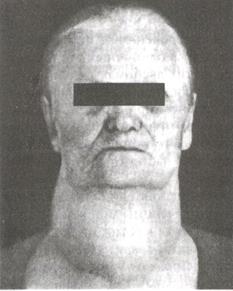 В зависимости от особенностей строения зоб может быть следующих видов: 1) узловой (аденоматозный - ткань ЩЖ имеет вид узлов, рис. 37-10), 2) диффузный (ткань ЩЖ равномерно увеличена, см. рис. 37-6), 3) диффузно-узловой (смешанный - на фоне равномерно увеличенной ткани ЩЖ имеется один или несколько узлов), 4) эктопический (абберрантный- патологически увеличенная добавочная ЩЖ), 5) коллоидный (фолликулы ЩЖ переполнены уплотнившимся слизеподобным веществом коллоидом) и др. 6) кистозный (характеризуется расширением фолликулов ЩЖ с образованием кист - полостей, образованных фиброзной тканью, часто выстланных эпителиальными клетками) и др.
В зависимости от особенностей строения зоб может быть следующих видов: 1) узловой (аденоматозный - ткань ЩЖ имеет вид узлов, рис. 37-10), 2) диффузный (ткань ЩЖ равномерно увеличена, см. рис. 37-6), 3) диффузно-узловой (смешанный - на фоне равномерно увеличенной ткани ЩЖ имеется один или несколько узлов), 4) эктопический (абберрантный- патологически увеличенная добавочная ЩЖ), 5) коллоидный (фолликулы ЩЖ переполнены уплотнившимся слизеподобным веществом коллоидом) и др. 6) кистозный (характеризуется расширением фолликулов ЩЖ с образованием кист - полостей, образованных фиброзной тканью, часто выстланных эпителиальными клетками) и др.




