Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Легких при обструктивных и рестриктивных процессахСодержание книги
Поиск на нашем сайте
Нормальные спирографические пробы представлены на рис. 32-5 а. Для гиповентиляции обструктивного типа (рис. 32-5 б) весьма характерно снижение динамических объемов легких – ОФВ и МВЛ. Эти изменения могут быть использованы в качестве простейших функциональных тестов для установления нарушений бронхиальной проходимости в случае сохранения существенно неизмененных статических объемов легких: ДО, ООЛ, ЖЕЛ. Основное место в клинической практике в целях определения нарушений бронхиальной проходимости занимает форсированная спирометрия. Для ее осуществления необходимо определить два показателя: объем односекундного форсированного выдоха (ОФВ1 ) и ЖЕЛ.. Многочисленные экспериментальные и клинические исследования свидетельствуют о том, что в наибольшей зависимости от прилагаемого усилия для осуществления выдоха находится скорость воздушного потока в начале форсированного выдоха. Именно поэтому принято определять объем воздуха, выдыхаемого за первую секунду форсированного выдоха (ОФВ1). Этот показатель часто выражают в процентах от ЖЕЛ (ФЖЕЛ1), так называемый индекс Тиффно. Снижение этого отношения до величины 70% и менее однозначно свидетельствует о нарушении проходимости дыхательных путей. Для гиповентиляции рестриктивного типа (рис. 32-5,в) характерно уменьшение ООЛ, ЖЕЛ, а также других легочных объемов и емкостей. Наибольшую диагностическую ценность для выявления рестриктивных расстройств имеет измерение ЖЕЛ. По уменьшению ЖЕЛ определяют степень выраженности рестриктивных нарушений, так как этот показатель непосредственно характеризует пределы возможного расправления легких.
 
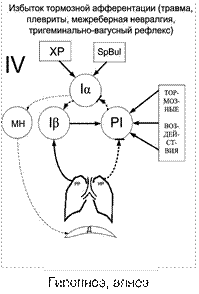
Рис. 32-5. Спирографические пробы в норме (а) и при обструктивных (б) и рестриктивных (в) нарушениях дыхания 32.4. Расстройства регуляции ВЕНТИЛЯЦИИ ЛЕГКИХ Патология дыхательного центра. Наиболее серьезные и быстро возникающие расстройства вентиляции легких возникают при различной патологии дыхательного центра (ДЦ), приводящей к ослаблению активности или рассогласованию инспираторных и экспираторных ядер. Известно, что ДЦ состоит из взаимосвязанных диффузных скоплений различных групп нейронов, расположенных в разных отделах ЦНС (от спинного мозга до коры больших полушарий головного мозга), ответственных за координированную и согласованную ритмическую деятельность дыхательных мышц и обеспечивающих приспособление вентиляции легких постоянно изменяющимся условиям внешней и внутренней сред в целях сохранения газового гомеостаза организма. В узком смысле под ДЦ понимают взаимосвязанные группы инспираторных (ИН) и экспираторных (ЭН) нейронов продолговатого мозга (так называемого центрального дыхательного регулятора – ЦДР), без функционирования которых ритмическое дыхание (вдох и выдох) в принципе невозможны. Внедрение в исследовательскую практику современных электрофизиологических методов позволило установить локализацию основных групп дыхательных нейронов. Например, вводя микроэлектроды, соединенные с усилителем, было показано, что ИН находятся в латеральной части дорсального дыхательного ядра продолговатого мозга. Их аксоны идут в шейный отдел спинного мозга, где импульсация переключается на мотонейроны, а те в свою очередь передают возбуждение на мышцы вдоха (внутренние межреберные мышцы) и диафрагму. Для того, чтобы понять, как работает дыхательный центр, обратимся к наиболее известной «трансформаторной теории» ритмогенеза ЦДР (К. Ойлер, Ф. Кларк, Г. Бредли, 1987), схематично представленной на рис. 6. Согласно данной модели, под влиянием хеморецептивной стимуляции возбуждается определенная группа ИН (ответственная за формирование т.н. центральной инспираторной активности - ЦИА. Чем сильнее афферентация (зависящая, главным образом, от напряжения СО2 в ликворе), тем быстрее происходит нарастание ЦИА и тем резче происходит вдох. Но тем скорее этот вдох и прекращается. Это обусловлено тем, что одновременно возбуждается другая группа нейронов, активность которой, достигнув определенной величины (порога), затормаживает и выключает ЦИА. Обрыву вдоха, переходу его в выдох, способствуют также рецепторы растяжения легких. Вспомогательную роль в этом механизме играют влияния, поступающие сверху, прежде всего из пневмотаксического центра варолиева моста. Эти влияния способствуют более плавным переходам между инспираторной и экспираторной фазами и обратно. Трансформаторная модель ритмогенеза ДЦ иллюстрируется приведенной выше схемой. Согласно последней возбуждение инспираторных нейронов Ia обеспечивает вдох. Одновременно активирующаяся другая популяция инспираторных нейронов (Ib) передает свое возбуждение, когда оно достигает пороговой величины, постинспираторным нейронам (PI), которые, в свою очередь, затормаживают нейроны Ia, прекращая вдох и поддерживая некоторое время состояние выдоха. Активация нейронов Ia поддерживается и стимулами из хеморецепторов. Раздражение рецепторов растяжения легких способствует прерыванию вдоха, а ирритантных рецепторов - прерыванию выдоха. Итак, можно констатировать, что ДЦ, получая от хеморецептров информацию о химизме внутренней среды, преобразует ее в ритмический выходной сигнал (подобно трансформатору), обеспечивающий требующийся организму нормальный уровень вентиляции легких (I на рис. 32-6).

Рис. 32-6. Трансформаторная модель ритмогенеза дыхательного центра Обозначения: ХР – хеморецепторы; ИНa (Ia) - ранние инспираторные нейроны (обеспечивающие начало вдоха); ИНb (Ib) - поздние инспираторные нейроны (обеспечивающие завершение вдоха); ПИТН (PI) - постинспираторные тормозные нейроны (формирующие выдох и тормозящие вдох).
Рассмотрение нейрофизиологических механизмов работы ДЦ важно и для понимания конкретных звеньев нарушений регуляции дыхания. Расстройства регуляции системы внешнего дыхания включают в себя: 1) расстройства центральной регуляции дыхания; 2) изменения в проводниковом (бульбоспинальном) тракте; 3) нарушения проведения сигналов от мотонейронов спинного мозга к респираторным мышцам. Основные нейрофизиологические механизмы этих расстройств схематически представлены на рис. 32-7 (II – IX). Расстройства центральной регуляции вентиляции легких возникают в основном вследствие нарушений функций ДЦ.
Рис. 32-7. Нейрофизиологические механизмы нарушения регуляции дыхания
Исходя из изложенных выше представлений о структуре и функциях ДЦ, возможно выделить несколько механизмов расстройств регуляции дыхания, связанных с отклонениями в афферентной регуляции ДЦ и характеризующихся развитием гиповентиляционных и апноетических состояний. Дефицит возбуждающей афферентации (II на рис. 32-7). Дефицит импульсов от хеморецепторов приводит к так называемым периодическим формам дыхания. Периодическое дыхание характеризуется расстройством ритма дыхания. В патологии оно обычно сопровождающегося чередованием периодов дыхания и апноэ (остановки дыхания). Основные виды периодического дыхания представлены на рис. 32-8 (а, б, в).
а. Дыхание Чейна-Стокса
б. Дыхание Биота
в. Дыхание Куссмауля
Дыхание Чейна-Стокса (рис. 32-8, а) характеризуется постепенным нарастанием амплитуды дыхательных движений, сменяющегося их снижением и возникновением периода апное. Возникает при уменьшении чувствительности центрально-мозговых хеморецепторов к углекислому газу. Различают полное и неполное дыхание Чейна-Стокса. Дыхание Биота (рис. 32-8, б) характеризуется чередованием серии одинаковых по величине и высоких дыхательных движений, сменяющихся периодами апное. Возникает при воспалительных и травматических поражениях мозга, опухолях задней черепной ямки. Кроме хеморецептивной стимуляции ранних инспираторных нейронов, большое значение имеют импульсы, поступающие из нейронов ретикулярной формации и парабрахиальных ядер пневмотаксического центра Люмсдена. Наблюдается при снижении тонической импульсации, например, при нередко встречающемся в акушерской практике синдроме асфиксии новорожденных. Большое дыхание Куссмауля (рис. 32-8 в) - шумное глубокое учащенное дыхание. Возникает при диабетической коме и других отравлениях, приводящих к терминальным состояниям. Характеризуется сменой глубокого вдоха усиленным выдохом, возникающих в результате соответствующей смены активизации ИН и ЭН ДЦ и дыхательных мышц. Вследствие незрелости хеморецепторного аппарата ребенок, чаще недоношенный, может рождаться в состоянии асфиксии. Для активации ДЦ в таких случаях обычно используют дополнительные стимулирующие воздействия на кожные экстерорецепторы (похлопывание по ножкам и ягодицам ребенка, обрызгивание тела холодной водой и т.д.), ликвидируя тем самым дефицит возбуждающей афферентации через неспецифическую активацию ретикулярной формации. Уменьшение возбуждающей информации возникает при перерыве самого пневмотаксического центра (нижняя треть продолговатого мозга). Это приводит к развитию дыхания типа "апнейзиз"). Альвеолярная гиповентиляция и остановка дыхания, возникающие при угнетении ДЦ средствами для наркоза и обезболивания, также является следствием дефицита стимулирующих воздействий, необходимых для запуска генератора дыхательного ритмогенеза. Избыток возбуждающей афферентации (III на рис. 32-7). "Перевозбуждение" ДЦ может характеризоваться развитием тахипное-полипное (очень частого и поверхностного дыхания). Альвеолярная гиповентиляция при тахипное (от греч. tachys-быстрый, скорый; pnoe - дыхание) сопровождается увеличением функционального мертвого пространства. Причинами чрезмерной активации ДЦ могут быть стрессорные воздействия (приводящие к генерализованному возбуждению ЦНС), неврозы (например, приступы истерии), некоторые поражения структур среднего мозга, нарушения кровообращения, острое воспаление, механическая травма, гипоксия, сухой плеврит, умеренный ацидоз и др. Избыток афферентации, возбуждающей ДЦ, может быть рефлекторного происхождения. Тахипноэ, сопровождаемое значительным уменьшением глубины дыхания, иногда возникает при раздражении брюшины, термических или болевых воздействиях на кожные покровы. Как отмечалось ранее, в механизме развития частого поверхностного дыхания (например, при крупозной пневмонии) существенное значение имеет раздражение ирритантных и юкстакапиллярных рецепторов легких. Кашель и чихание крайне часто встречаются в жизни человека как защитная временная рефлекторная физиологическая реакция аппарата внешнего дыхания в ответ на действие внешних раздражителей (слизь, мокрота, механические пылевые частицы, химические вещества), попадающих на слизистые соответственно глотки, гортани, трахеи (особенно в месте ее бифуркации) и носовой полости (особенно на средней носовой раковине и перегородке носа). Однако длительные или постоянные приступы кашля или чихания являются патологическими реакциями, так как обычно всегда приводят к возникновению и усилению расстройств не только вентиляции легких, но и кровообращения (как в малом, так и в большом кругах кровообращения). Как кашель, так и чихание характеризуются коротким вдохом, закрытием голосовой щели, развитием сокращений экспираторных мышц, приводящих к повышению давления воздуха в дыхательных путях, легочных альвеолах и даже в плевральной полости. После открытия голосовой щели в результате форсированного выдоха воздух с большой скоростью и силой вылетает из дыхательных путей наружу. Причем, при кашле это происходит через рот, при чихании – через нос. Избыток тормозной афферентации (IV на рис. 32-7). Этот механизм угнетения ритмической активности ДЦ включается, например, при раздражении слизистой оболочки верхних дыхательных путей в условиях развития острого респираторного заболевания воспалительного характера. Интенсивное раздражение слизистой оболочки полости носа и носоглотки химическими или механическими агентами может вызывать даже рефлекторную остановку дыхания на вдохе, повышение системного кровяного давления, брадикардию и даже кратковременное прекращение сердечных сокращений. Торможение дыхания наблюдается при травмах грудной клетки, межреберной невралгии, нейромиозитах и т.д. Тормозной тригеминовагусный рефлекс Кречмера возможно полностью предотвратить анестезией слизистой оболочки верхних дыхательных путей или в эксперименте - перерезкой ветвей тройничного нерва. Хаотическая афферентация («вегетативная буря») (V на рис. 32-7) наблюдается при инфаркте миокарда, интоксикациях, перитоните и т.д. Для данной формы нарушений дыхания характерны сменяющие друг друга тормозные и возбуждающие формы афферентных воздействий. При этом на входы ДЦ поступает либо возбуждающая (через супрапонтинные структуры), либо тормозная (через постинспираторные нейроны) афферентация. Характер дыхания приобретает нестабильный, эмоционально окрашенный вид – от приступов удушья до гипервентиляционных эпизодов (диспноетическое дыхание). Нарушение афферентации с легких (VI на рис. 32-7) может отмечаться при параличе ядер блуждающего нерва, передозировке холинолитических препаратов, опухолях средостения). Уменьшение притекающих к ДЦ импульсов наблюдается при ваготомии (двухсторонняя вагосимпатическая блокада), проявляющейся возникновением т.н. вагусной одышки. Непосредственное поражение ДЦ (VII на рис. 32-7) может быть обусловлено опухолями, отеком, гипоксией головного мозга, кровоизлияниями в мозг и т.д. При разрушении бульбарной части ДЦ дыхание останавливается (развивается апноэ). При разрушении ядер ствола мозга, расположенных непосредственно над продолговатым мозгом возникает дыхание в виде гаспинга (гаспы - короткие и редкие судорожные вдохи). Гаспинг (англ. gasping – конвульсивный, спазматический, англ. gasp – ловить воздух, задыхаться) дыхание – наиболее часто встречающийся агональный тип дыхания, который характеризуется единичными, редкими, убывающими по силе вдохами («вздохами»), сменяющимися быстрыми выдохами и далее прерывающиеся остановками дыхания (рис. 32-9). Возникает после остановки дыхания в терминальную паузу умирания в результате возбуждения инспираторных нейронов ДЦ в каудальной части продолговатого мозга при ослаблении или выпадении деятельности выше расположенных структур головного мозга. Апнейстическое дыхание возникает при повреждении ядер нижней трети варолиева моста (пневмотаксического центра, ПЦ). Это дыхание еще больше замедляется и приобретает вид апнейзиса (рис. 32-9). Апнейстическое дыхание характеризуется судорожным длительным вдохом, прерывающимся коротким выходом. Это дыхание возникает на фоне еще сохраненной активности апнейстического отдела ДЦ (расположенного в верхней трети моста АЦ) и апнейстического центра. Экспериментально апнейстическое дыхание можно вызвать путем перерезки мозгового ствола в средней трети (между пневмотаксическим и апнейстическим отделами ДЦ). Апнейстическое дыхание наступает при хронических анемиях, гипоксии и интоксикации ЦНС (ботулизм, передозировка наркотиками, отравление фосфорорганическими соединениями). Нарушения эфферентных путей - прерывание путей, связывающих ДЦ с дыхательными мышцами, может приводить к грубым нарушениям деятельности дыхательных мышц (главным образом межреберных и диафрагмы), сопровождающимся развитием альвеолярной гиповентиляции (VIII на рис. 32-7). Известно, что повреждения шейного отдела спинного мозга, прерывающие связь ДЦ с мотонейронами межреберных мышц, не вызывают значительных изменений характера дыхания. Если же прерываются проводящие пути, связывающие ДЦ с диафрагмальными мотонейронами, то дыхание утрачивает автоматизм. Больной в таком случае дышит только произвольно: дыхание становится неравномерным, а при засыпании прекращается (так называемый синдром "проклятия Ундины"). Причинами развития этого синдрома могут быть сирингомиелия, рассеянный склероз, полиомиелит, травмы или нарушения кровообращения спинного мозга.
Рис. 32-9 Последствия перерезок разных участков дыхательного центра. Обозначения: К- кора, Гт – гипоталамус, АЦ – апнейстический центр, И – инспираторный отдел продолговатого мозга, Э – экспираторный отдел, С – шейный отдел спинного мозга, Th- грудной отдел; а, б, в, г, д – соответствующие уровни перерезки спинного мозга.
Миогенные расстройства дыхания (IX на рис. 32-7) возникают не только при поражениях проводящих путей спинного мозга, мотонейронов и нервов, иннервирующих респираторные мышцы, но также при расстройствах нервно-мышечной проводимости. Типичным примером такой патологии является миастения, характеризующаяся стойким снижением лабильности нервно-мышечных синапсов. Развивающиеся при этом слабость и патологическая утомляемость респираторных мышц приводят к снижению газообменной функции внешнего дыхания и могут приобрести угрожающий для жизни характер. Альвеолярная гиповентиляция и даже прекращение дыхания из-за блокады нервно-мышечных синапсов наблюдаются как осложнения в период после оперативных вмешательств, во время которых использовались миорелаксанты. Альвеолярная гиповентиляция миогенного происхождения может обнаруживаться даже у практически здоровых людей с недостаточно развитой дыхательной мускулатурой в условиях выполнения ими значительной физической нагрузки. Особенно легко утомление дыхательных мышц наступает при болезнях мышечной системы (например, при мышечной дистрофии Дюшена). Тяжелая степень альвеолярной гиповентиляции может возникать при воспалительных процессах в дыхательных мышцах, сопровождающихся мышечной слабостью и миалгией. Самостоятельное значение в возникновении альвеолярной гиповентиляции иногда имеют врожденная или приобретенная атрофия, пороки развития, опухоли и кисты диафрагмальной мышцы. Различные нарушения перечисленных выше нервных структур (ДЦ, эфферентной системы) как самостоятельно, так и при разном их сочетании приводят к развитию следующих расстройств: - характера (частоты, глубины, ритмичности) дыхания; - фаз дыхательного цикла; - просвета верхних или нижних дыхательных путей; - регуляторных рефлексов (Геринга- Брейера и др.); - защитных рефлексов (возникновения и длительности апноэ, препятствующего поступлению в легкие воздуха, содержащего раздражающие и повреждающие вещества); - оборонительных рефлексов (формирования кашля и чихания); - обонятельных рефлексов (формирования принюхивания, активизирующего РФ и другие структуры ЦНС) - устной речи; - соответствия дыхания изменению поведенческой активности организма и др.
32.5. Нарушения перфузионной способности легких (патология легочного кровотока) Движущей силой легочного кровотока (перфузии легких) является различие давления в правом желудочке и левом предсердии, а главным регулирующим механизмом – легочное сосудистое сопротивление. Патогенетическими формами, изменяющими легочный кровоток являются: - объем циркулирующей крови; - работа правого желудочка; -кровенаполнение левого предсердия; - легочное сосудистое сопротивление, - регулируемое баро- и хеморецепторами; - внутриальвеолярное давление; - действие силы тяжести (силы земного притяжения). Все названные факторы, тесно взаимосвязаны. Серьезные изменения любого из них могут стать основой возникновения патологии дыхания. Нарушения процесса перфузии в легких возникают, главным образом, при нарушениях кровотока, осуществляемого через малый круг кровообращения (99-98 %) и частично (1-2 %) - через большой круг с участием бронхиальных сосудов. Нарушения капиллярного кровотока в легких могут возникать как при гипер-, так и гипотензии сосудов малого круга кровообращения. Легочная гипертензия (АД более 20/8 мм рт.ст.) бывает либо прекапиллярной, либо посткапиллярной. Прекапиллярная форма легочной гипертензии характеризуется повышением давления (а значит сопротивления) в мелких артериальных сосудах системы легочного ствола. Причинами прекапиллярной формы гипертензии являются спазм аретериол и эмболия ветвей легочной артерии. Спазм артериол может быть вызван: 1) стрессами, эмоциональными нагрузками; 2) вдыханием холодного воздуха; 3) рефлексом Эйлера-Лильестранда (констрикторная реакция легочных сосудов, которая может возникнуть в ответ на снижение РО2 в альвеолярном воздухе); 4) гипоксией. Эмболии ветвей легочной артерии вызываются: - тромбофлебитами; -нарушениями ритма сердца; - гиперкоагуляцией крови; - полицитемией. Известно, что резкий подъем АД в легочном стволе раздражает барорецепторы и путем срабатывания рефлекса Швачка – Парина приводит к снижению системного АД, замедлению ритма сердца, увеличению крове- наполнения селезенки, скелетных мышц, уменьшению венозного возврата крови к сердцу, предотвращению отека легкого. Это еще больше нарушает работу сердца, вплоть до его остановки и гибели организма. Легочная гипертензия усиливается при: - снижении температуры воздуха, - при активизации САС, - полицитемии, - повышении вязкости крови, - при приступах кашля или хроническом кашле. Посткапиллярная форма легочной гипертензии вызывается снижением оттока крови по системе легочных вен. Характеризуется застойными явлениями в легких, возникающими и усиливающимися при сдавлении легочных вен опухолью, соединительно-тканными рубцами, а также при различных заболеваниях, сопровождающихся левожелудочковой сердечной недостаточностью (митральном стенозе, гипертонической болезни, инфаркте миокарда, кардиосклерозе и др.). Следует отметить, что посткапиллярная форма может осложняться прекапиллярной формой, а вторая – первой. Нарушение оттока крови из легочных вен (при повышении давления в них) приводит к включению рефлекса Китаева, приводящего к увеличению прекапиллярного сопротивления (вследствие сужения легочных артерий) в малом круге кровообращения, предназначенного для разгрузки последнего. Легочная гипотензия развивается при гиповолемии, вызванной кровопотерей, коллапсом, шоком, пороками сердца (со сбросом крови справа налево). Последнее, например, возникает при тетраде Фалло, когда значительная часть венозной малооксигенированной крови поступает в артерии большого круга, минуя легочные сосуды, в том числе минуя обменные капилляры легких. Это приводит к развитию хронической гипоксии и вторичных расстройств дыхания. В этих условиях, сопровождающихся шунтированием легочного кровотока, ингаляция кислорода не улучшает процесс оксигенации крови и сохраняет гипоксемию. Таким образом, эта функциональная проба является простым и надежным диагностическим тестом выявления данного вида нарушения легочного кровотока. 32.6. Нарушения вентиляционно-перфузионных Отношений
В норме величинавентиляционно - перфузионного отношения (ВПО) равна 0,8-1,0. У здоровых людей данный показатель отражает адекватность минутного объема альвеолярной вентиляции (V) минутному объему кровотока (Q) в легких, то есть V/Q = 0,8-1,0. В условиях патологии легочная вентиляция может не соответствовать легочной гемодинамике как на уровне целого легкого, так и на уровне долей, сегментов, долек или групп альвеол. Это различие усиливается при изменении сил гравитации, анатомических и биохимических особенностей отдельных функциональных легочных единиц - ацинусов (одна единица, состоящая примерно из 100 альвеолярных ходов и 2000 альвеол, включает объем легких, равный около 20 мкл), а также при изменении транспульмонального давления. В гиповентилируемых участках легких кровоток обычно уменьшается благодаря возникающей в них гипоксической и гиперкапнической вазоконстрикции. В участках со сниженным (по отношению к вентиляции) кровотоком гипокапническая бронхоконстрикция вызывает уменьшение вентиляции.
Рис. 32-10. Механизмы возникновения неравномерности вентиляции и перфузии легких
Уменьшение ВПО<0,8 наблюдается при локальной альвеолярной гиповентиляции, вызванной: - расстройствами обструктивного типа (закупорками дыхательных путей), - нарушениями эластичности легочной ткани, - деформациями грудной клетки, - легочно-плевральными сращениями, - односторонним параличом диафрагмальной мышцы, - парадоксальным или маятникообразным дыханием и т.д. Увеличение ВПО>1,0 отмечается при возрастании выведения из организма СО2, завершающегося развитием гипокапнии. Это происходит при: - сужениях, закупорке тромбами, эмболами, облитерациях и/или спазмах сосудов системы легочной артерии, - уменьшении кровотока через метаболические (обменные) капилляры, - увеличении кровотока через внутрилегочные шунтовые (артериало-венульные) сосуды. Большое значение имеет гравитационная неравномерность вентиляции и перфузии на основаниях и верхушках легких показано, что: - вентиляция на основании незначительно выше, чем на верхушке, - кровоток на основании значительно превышает верхушечный, - V/Q – на верхушке значительно выше, чем на основании, - содержание О2 в альвеолах верхушки выше, чем на основании, - содержание СО2 в альвеолах основания выше, чем на верхушке. Шунтирование может возникать и усиливаться при формировании альвеоловаскулярных и бронховаскулярных рефлексов. Регионарные нарушения альвеолярной вентиляции и кровотока в обменных капиллярах можно выявить с помощью радиоизотопных и капографических методов исследования.
32.7. Нарушения диффузии газов через альвеолярно-капиллярные мембраны
Наряду с механическими свойствами воздухоносных путей и легочной паренхимы, определяющими движение газа в альвеолы и обратно, решающим процессом для обеспечения тканевого метаболизма является газообмен через альвеолярно-капиллярную мембрану, т.е. диффузионная способность легких (скорость с которой газ проходит через эту мембрану). Движение газа через альвеолярно-капиллярную мембрану происходит путем диффузии (рис. 11). Согласно закону Фика скорость диффузии газа через мембрану (V) определяется площадью поверхности мембраны (S) и ее толщиной (L), молекулярным весом (М) и растворимостью (a) газа в мембране, а также разницей парциальных давлений по обе ее стороны DР = Р1 - Р2. Таким образом, V=(DР ´ S ´ D)/ L, где D = a/ÖМ, V – диффузионный поток, DР- разность парциальных давлений по обе стороны мембраны, D – константа диффузии, L – толщина мембраны, S - площадь мембраны Из уравнения Фика следует, что скорость диффузии газа через альвеолярно-капиллярную мембрану возрастает: 1) с увеличением площади поверхности мембраны (в норме диффузионная поверхность легких составляет 50-100 м2), растворимости и градиента давления газа по обе стороны мембраны; 2) с уменьшением толщины мембраны и молекулярного веса газа.
Факторы, влияющие на диффузионную способность легких Диффузионная способность легких возрастает:
· при увеличении размеров тела (веса, роста, площади поверхности); · с увеличением объема легких; · во время физической нагрузки; · при увеличении альвеолярного РСО2; · по мере взросления организма (до 20- летнего возраста); · в положении лежа на спине. Диффузионная способность легких снижается: · при увеличении альвеолярного РО2; · с увеличением возраста (старше 20 лет); · с увеличением толщины альвеолярно-капиллярной мембраны и молекулярного веса газа; · при большинстве заболеваний легких.
Рис. 32-11. Механизмы диффузии газов через легочную мембрану
Механизмы снижения диффузионной способности легких
Диффузионная способность легких снижается при хронических обструктивных заболеваниях легких. Ее снижение связано с уменьшением как площади поверхности альвеолярно-капиллярного контакта, так и объема капиллярной крови. Диффузионная способность легких снижается при заболеваниях, поражающих паренхиму легких и характеризующихся рестриктивными расстройствами дыхания. Ее снижение обусловлено интерстициальным отеком, фиброзом легких и деструкцией их капилляров. В результате этого увеличивается диффузионное расстояние, утрачиваются капилляры и снижается объем капиллярной крови, т.е. нарушается баланс между процессом альвеолярно-капиллярной диффузии и процессом капиллярной перфузии.
32.8. Дыхательная недостаточность.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-28; просмотров: 265; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.187.232 (0.011 с.) |