
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічні та біохімічні перетворенняСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Хімічна кінетика Розповсюдженими хімічними реакціями в промисловості є гідроліз, тобто приєднання молекул води до речовини, гідрогенізація, піроліз, полімеризація, тощо. Наприклад гідроліз крохмалю, що приводить до утворення цукрів відбувається за такою формою.
Гідрогенізація (насичення воднем) жирів:
Сатурація (насичення вуглицевим газом)
Піроліз (розклад без доступу повітря при високих температурах) в середовищі водню називають процес розщеплення великих молекул вуглеводнів на простіші. Під час піролізу можливий такий перебіг реакцій:
Полімерізація — зєднання однакових молекул в ланцюги. Наприклад, одержання із етилену Одержання синтетичного спирту гідротацією етилену
Всі ці реакції характеризуються швидкістю перебігу хімічної реакції. Швидкістю хімічної реакції називають число молекул, які реагують в одиницю часу. Для порівнювання швидкостей різних реакцій число молекул відносять до одиниці об'єму. В зв'язку з цим швидкості реакцій визначають як число молекул або молей даної речовини, що реагують в одиницю часу в одиниці об'єму. Якщо в об'ємі V знаходиться п молей речовини А, то концентрація с дорівнює
Формально швидкість реакції можна визначити як похідну концентрації реагуючої речовини за часом, взяту зі знаком "мінус", який означає, що в ході реакції концентрація реагентів спадає. Швидкість реакції можна виміряти за накопиченням продукту реакції, а оскільки при перебіганні реакції концентрація продукту збільшується, то похідна і формули швидкості виходить, що
Якщо реакція перебігає в ізохоричних умовах (V = const, , то швидкість реакції можна записати
Якщо ж при перебігу реакції змінюється об'єм системи, то для розрахунку швидкості реакції необхідно знати явний вид функції При розгляданні кінетики хімічних процесів, в результаті яких об'єм реагуючої системи практично не змінюється, швидкість реакції типу записати де С — концентрація продукту. За цією формулою визначають миттєву швидкість хімічної реакції. Миттєву швидкість реакції при ф=0 називають початковою швидкістю реакції. Визначення швидкостей реакції в початковий та довільний моменти часу виконують за тангенсом кута нахилу в даній точці
Миттєва швидкість реакції уявляє собою границю значення середньої швидкості при
При розрахунках середньої швидкості за повний час перебігу реакції
В цьому випадку треба встановити кількісну залежність швидкості реакції від часу, тобто підібрати таку формулу, яка б правильно зобразила б залежність швидкості реакції протягом всього часу. Закон дії мас є основним законом хімічної кінетики, відповідно з яким в самому загальному випадку можна погодитись, що швидкість хімічної реакції прямо пропорціональна концентраціям реагуючих (діючих) речовин в деяких степенях
де к— стала, яка зветься константою швидкості реакції;. m — число речовин, які вступають в реакцію;
П — знак добутку. Зміна концентрації основної початкової речовини та продукту реакції протягом процесу характеризується кривими, які відрізняються при простих і складних реакціях, а також для процесів, які перебігають відповідно режиму ідеального витіснення та повного змішування. Для простих процесів, які перебігають за режимом ідеального витіснення без зміни об'єму за схемою
концентрація основної початкової речовини тягом часу (рис. 4.41) від початкової
4.8.2. Кінетика мікробіологічних процесів Без мікроорганізмів неможливо існування цілого ряду харчових виробництв. Біохімічні процеси складають основу всіх бродильних виробництв, заснованих на: а) використанні дріжджів (етиловий спирт, гліцерин, хлібопекарські дріжджі, виноробство,
Рис. 4.41. Кінетика хімічних реакцій пивоваріння); б) використання бактерій (ацетоно-бутилове виробництво, виробництво оцету, молочної і масляної кислот, та інш.); в) використання плісеневих грибів (лимонна, глюконова, фумаролова, ітиколова кислоти, пеніцилін, стрептоміцин, тощо). Продукти бродильного виробництва утворюються в результаті каталітичної дії ферментів мікроорганізмів. Найбільш розповсюдженою біохімічною реакцією можна вважати спиртове бродіння (зброджування цукрів дріжджами):
В результаті якої отримують спирт та воду. Молочно-кисле бродіння спричиняється молочно-кислими бактеріями (кефір, кисле молоко, квашення капусти, огірків, тощо), а масляно-кислими бактеріями — ацетон, бутиловий спирт, тощо. Основними процесами, які характеризують життєдіяльність дріжджів, є асиміляція та дисиміляція як дві сторони спільного процесу обміну речовинами. Асиміляція не може існувати без одночасного відбування дисиміляції. Відрізняють дві форми асиміляції: дихання та бродіння. Процес дихання відбувається при наявності вільного кисню та приводить до повного окислення вуглеводів (в тому числі і спирту) з утворенням вуглекислоти та води. Бродіння характеризується неповним розподілом вуглеводів, але відрізняються за умовами подальшого перебігання процесу та за характером кінцевих продуктів. Ці відміни широко використовують в харчових виробництвах. При нестачі повітря дріжджами зброджують продукти, які знаходяться в живильному середовищі та одержують етиловий спирт і вуглекислоту. При достатньому притоку повітря в живильному середовищі спиртове бродіння припиняється, а дріжджі одержують необхідну для їх розвитку енергію шляхом аеробного дихання. Ці обставини використовують для вирощування різних рас дріжджів, необхідних для виробництва різних харчових продуктів, а також в деяких випадках як кормові добавки. Ці два технологічних процеси різного призначення вимагають різного апаратурного оформлення. Особливості біохімічних реакцій відображає форма аналітичних рівнянь хімічної кінетики. Кінетичні закономірності біохімічного каталізу встановлюють залежність швидкості ферментативної реакції від концентрації ферменту, субстрату, активаторів, інгібіторів, а також фізико-хімічних факторів: температури, тиску, іоної сили, діелектричної проникленості та ін. Виходячи з припущення, що фермент спочатку утворює фер-мент-субстратний комплекс із своїм субстратом, а потім цей комплекс розпадається із звільненням вільного ферменту та продукту реакції, то рівняння, яке враховує зміну концентрації субстрату, має вигляд
Де нескінченно великій концентрації субстрату;
тему;
Експериментально підтверджено, що між швидкістю реакції
де х — стала величина. Математичне обґрунтування гіпотези про утворення фер-мент-субстратного комплексу, виходячи із припущення про існування термодинамічної рівноваги між початковими речовинами фермент, субстрат та фермент-субстратним комплексом, було дано Л. Міхаелісом та М. Ментен. Вони розглянули таку односуб-стратну ферментативну реакцію
Відповідно з принципом збереження концентрації речовин в реакції загальна концентрація ферменту ƒ
а формула для константи рівноваги F+S+FS має вигляд к= звідкіля
Тоді для концентрації фермет-субстратного комплексу одержимо
Відповідно з кінетичною схемою та законом дії має швидкість реакції v пропорціональна концентрації фермет-субстратного комплексу, звідкіля з урахуванням рівняння для швидкості реакції одержимо
Константу та отже Тоді рівняння для початкової швидкості реакції можна записати так
Це рівняння називають рівнянням Михаеліса-Ментен і воно є одним із фундаментальних рівнянь кінетики ферментативних реакцій. Для опису біохімічних перетворень крім рівнянь Михаеліса-Ментен використовують інші кінетичні співвідношення. Найбільше розповсюдження одержали рівняння Моно і Моно-Ієрусалимського. В моделі Моно
Де
Моно. Тобто концентрація субстрату, при якій Моделі Моно-Ієрусалимського відрізняються тим, що питома швидкість росту мікроорганізмів описується рівнянням
Де Р — концентрація інгібіруючого метаболіту. Рівняння Моно-Ієрусалимського трохи вдосконалив П.І. Ніколаєв
Де кількості, в результаті освоєння якого в одиниці об'єму живильного середовища утворюється концентрація продуктів обміну, яка приводить до зменшення швидкості росту мікроорганізмів до величини, рівній половині максимальної ( Наведена модель не завжди з достатньою для практичних розрахунків точністю відображає процеси мікробіологічного синтезу. Ці моделі не враховують типу та послідовності апаратів, а також одночасного перебігання процесів ферментативного гідролізу залишків крохмалю в розвитку популяцій Мікроорганізмів, які мають місце в харчовій промисловості. Наведені кінетичні закономірності подані в формі звичайних диференціальних рівнянь першого порядку. Вони можуть бути також приведені і до інших форм рівнянь: алгебраїчним, трансцендентним та ін..
Іноді ці закономірності можуть бути записані у вигляді поліномів будь-якої степені від однієї або декількох змінних
Де у — шукана величина;
Кінетику подають у вигляді моделей із зосередженими та розподіленими параметрами. В першому випадку описують алгебраїчними рівняннями або звичайними диференціальними рівняннями в частинних похідних або кінцевими рівняннями (Множинної регресії т.ін.) Кінетику технологічного процесу можна подати у відносних (безрозмірних) координатах. Рівняння кінетики одержують експериментально постановкою дослідів або аналітично шляхом розв'язання відомих рівнянь кінетики відносно визначаємого па- раметру при умові, що всі чисельні значення констант відомі. В загальному вигляді можна сформулювати три задачі кінетичного дослідження: виявлення механізму явища, визначення впливу початкових факторів на вихідні характеристики та визначення сталих у рівняннях кінетики. Особливе значення має кінетичний аналіз біохімічних процесів, який дає можливість: а) виявити механізм даної ферментативної реакції (визначити термодинамічні характеристики фер-мент-субстратного комплексу, число стадій його перетворень, встановлення послідовності приєднання субстратів та кофакторів до ферменту, визначити спорідненість субстрату до ферменту, виявити функціональні групи активного центру); б) дати оцінку міри очищення гетерогенного ферментативного препарату; в) виявити біологічне значення клітинних структур. Крім того, вивчення механізму кінетики інгібірування ферментативних реакцій має велике практичне значення для керування біохімічними процесами. Тобто, використання кінетичного аналізу при вивченні ферментативного каталізу має теоретичне та практичне значення. При розв'язанні обернених задач кінетики визначають вхідні параметри. Які забезпечують необхідний час виконання процесу, заданого кінцевого значення параметру, інших заданих або оптимальних властивостей вихідних продуктів (консистенція, хімічний склад, зовнішній вигляд та ін.) Обернені (інверсні) задачі використовують і для визначення припустимих відхилень режимів роботи, які істотно не впливають на ефективність процесу або якість продукту. Визначення фізичних властивостей речовин кінетичних констант є оберненими задачами. Кінетичні закономірності репрезентують багатьма моделями. Для розв'язання цієї задачі звичайно приймають існуючу модель та визначають в ній сталий коефіцієнт або складають нову модель. Для використання моделі необхідно мати значення сталих, відомий метод розв'язання або повинна існувати принципова можливість перетворити математичний опис до такої форми, яка дозволяє виконати аналітичні розв'язання задачі або за допомогою обчислювальних пристроїв. Хімічні та біохімічні явища завжди супроводжуються тепло- та масообмінами. Наприклад, процес росту біомаси мікробної клітини є результатом переходу використаних клітиною компонентів поживного середовища у високоорганізовані структури клітинної
біомаси. Переміщення різних низькомолекулярних речовин в клітину, ферментативні реакції енергетичного обміну, синтез амінокислот та білкових компонентів, формування клітинних структур супроводжується витратами клітинних структур. Загальна швидкість процесу визначається швидкістю тієї реакції, константа якої має найменше значення. Переміщення компонентів проходять відповідно із закономірностями масообміну, а біохімічні перетворення — з виділенням або поглинанням теплоти. В кінетичній області найбільш повільними є хімічні перетворення, в дифузійній — швидкість дифузії реагентів в зоні реакції, а в змішаній — швидкості хімічних реакцій і дифузії в порівнянні. Контрольні запитання до 4-го розділу 1. Основні процеси, з яких складається будь-яка технологія. 2. Подрібнення та різання в технології. 3. Основні типи подрібшовачів та різальних машин. 4. Перемішування та дозування і їхнє призначення в технології. 5. Гідродинамічні процеси і їхня класифікація. 6. Осадження і відстійнення. 7. Фільтрування та устрій фільтрів. 8. Відцентрові методи розподілу гетерогенних систем. 9. Нагрівання та охолодження в технології і пристрої для їх здійснення. 10. Сушіння в технології та його значення. 11. Схема сушильної установки й основні потоки матеріалу і робочого агенту. 12. Екстрагування в технології і його застосування для виготовлення продуктів. 13. Перегонка та ректифікація в промисловості. 14. Основне рівняння теплопередачі та його аналіз. 15. Основне рівняння масопередачі та його аналіз. 16. Абсорбція та адсорбція в технології. 17. Холодильний цикл та схема холодильної машини. 18. Пдраліз, піроліз та гідрогенізація в технології. 19. Фільтрування та осадження в технології. 20. Визначте рушійні сили перебігу основних процесів в технології. 21. Міробіологічні перетворення і їхнє значення в технології. 22. Швидкість хімічних та біохімічних перетворень.
|
|||||||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 410; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.239.234 (0.019 с.) |


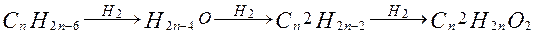


 поліетилену
поліетилену  тощо.
тощо.
 а швидкість реакції
а швидкість реакції  записується так
записується так
 — додатня.
— додатня.


 для обчислення похідної
для обчислення похідної 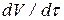 .
. можна
можна
 a (рис. 4.40). В хімічній кінетиці іноді використовують поняття середньої швидкості реакції за інтервал часу
a (рис. 4.40). В хімічній кінетиці іноді використовують поняття середньої швидкості реакції за інтервал часу  . Якщо в момент часу
. Якщо в момент часу  сонцентрація продукту реакції була рівна
сонцентрація продукту реакції була рівна  то середня швидкість реакції за інтервал часу
то середня швидкість реакції за інтервал часу визначається за виразом
визначається за виразом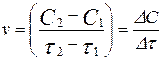
 тобто,
тобто,
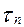 використовують формулу
використовують формулу

 — концентрація і-го реагенту;
— концентрація і-го реагенту; — порядок реакції за даною і-ою речовиною;
— порядок реакції за даною і-ою речовиною;
 зменшується про-
зменшується про- до нульової
до нульової 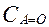 для зворотних процесів та до рівноважної
для зворотних процесів та до рівноважної  для незворотних. Відповідно концентрація продукту
для незворотних. Відповідно концентрація продукту  збільшується для зворотних процесів від нуля до концентрації
збільшується для зворотних процесів від нуля до концентрації для незворотних — до
для незворотних — до 



 — теоретична гранична початкова швидкість реакції при
— теоретична гранична початкова швидкість реакції при — константа, яка характеризує фермент та реакційну сис-
— константа, яка характеризує фермент та реакційну сис- i S— початкова та миттєва концентрації субстрату.
i S— початкова та миттєва концентрації субстрату. та концентрацією субстрату
та концентрацією субстрату 

 дорівнює сумі концентрацій вільного ферменту ƒ та зв'язаного у вигляді фермент-субстратного комплексу ƒ
дорівнює сумі концентрацій вільного ферменту ƒ та зв'язаного у вигляді фермент-субстратного комплексу ƒ 

 для реакції
для реакції



 називають константою Михаеліса, вона має розмірність концентрації (звичайно, моль/л). На початку реакції
називають константою Михаеліса, вона має розмірність концентрації (звичайно, моль/л). На початку реакції 
 .
.



 — початкова і поточна концентрації біомаси;
— початкова і поточна концентрації біомаси; — початкова і поточна концентрації поживних речовин;
— початкова і поточна концентрації поживних речовин; — максимальні та поточні швидкості росту біомаси;
— максимальні та поточні швидкості росту біомаси;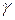 — емпіричний коефіцієнт;
— емпіричний коефіцієнт; — константа насичення
— константа насичення


 - константа, що залежна від структури популяції;
- константа, що залежна від структури популяції;
 - константа росту субстрату, чисельно рівна такій його
- константа росту субстрату, чисельно рівна такій його
 - незалежна змінна;
- незалежна змінна; - коефіцієнти при незалежних змінних.
- коефіцієнти при незалежних змінних.


