
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Корозія та антикорозійні заходиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Причини виненкнення корозії Термін корозія походить від латинського "corrosio", що означає роз'їдати, руйнувати. Цей термін характеризує як процес руйнування, так і результат. Корозія це руйнування будь-чого під впливом хімічних агентів або фізико-хімічних факторів: 1) Руйнування тканини живого виразковими шляхами або їдкими рідинами; 2) Іржавіння, руйнування поверхні виробів і споруджень під впливом хімічних чи електрохімічних процессів; 3) Змінення геологічних порід під впливом хімічних агентів і виносу речовини водою. Середовище в якому метал піддається корозії (кородує) називають корозійним або агресивним середовищем. У випадку з металами, говорячи про їхню корозію, мають на увазі небажаний процес взаємодії металу із середовищем. Фізико-хімічна сутність змін, що перетерплює метал при корозії — є окислювання металу. Будь-який корозійний процес є багатостадійним: 1) необхідне підведення окремих ії компонентів корозійного середовища до поверхні металу; 2) взаємодія середовища з металом; 3) повний чи частковий відвід продуктів від поверхні металу (в об'єм рідини, якщо середовище рідке). Спонтанно перебігає процес руйнування металів у результаті взаємодії з довкіллям, що відбувається з виділенням енергії і розсіюванням речовини. Корозійні процеси перебігають незво-ротньо у відповідності з другим началом термодинаміки. Повільне виділення теплової енергії, майже без підвищення температури чи електричної енергії з мізерно малими різницями потенціалів не дає можливості використовувати енергію, що виділяється — відбувається розсіювання енергії (ріст теплової частини ентропії). Продукти корозії, як правило, розсіюються в процесі експлуатації металевих конструкцій. Незворотні корозійні процеси наносять значну шкоду народному господарству. Міжнародний інститут корозії і захисту металів координує роботи із захисту металів, що ведуться у всіх країнах. Підраховано, що близько 20% щорічної виплавки металів витрачається в корозійних процесах. Велику шкоду приносить корозія в машинобудуванні, оскільки через корозійне руйнування якої-небудь однієї деталі може вийти з ладу машина, що призводить до значних втрат. Корозія знижує точність показань приладів і стабільність їхньої роботи. Незначна корозія електричного контакту приводить до відмовлення при його включенні. Боротьби з корозійними процесами є завданням сучасної техніки. Зміна поверхні металу в результаті корозійних процесів може бути різною в залежності від властивостей металу і корозійного середовища. На їхній розвиток значно впливає механічна напруженість металу. Найбільш небезпечною є місцева корозія, що при малій загальній корозії в окремих місцях може створити різку концентрацію механічних напруг, що в свою чергу сприяє подальшому руйнуванню металу. Всі корозійні руйнування, що виявляють- ся мікроскопічним дослідженням, небезпечні й особливо інтеркри-сталітна корозія, що послабляє зв'язок між металевими зернами; і транскристалітна корозія, що виникає під дією механічних напруг і призводить до розвитку тріщин. Найменьш небезпечна селективна корозія — результат травлення сталі при збереженні карбітних зерен (цементіт, мартенсіт) чи втрата цинку з латунью. Часто ті самі типи корозійних руйнувань металу можуть бути викликані різними процесами корозії. Корозійні процеси важко віднести тільки до якого-небудь визначеного типу, тому що вони нерідко відбуваються одночасно (атмосферна корозія). За природою гетерогенних процесів взаємодії довкілля з металами ці процеси можна розділити на два основних типи. Хімічна корозія, що розвивається під час відсутності електролітів. Вона перебігає головним чином при температурах, що виключають можливість утворення насиченої пари води, — високотемпературна чи газова корозія. Цей вид корозії може виникати і в неводних органічних середовищах. Електрохімічна корозія, що йде в електролітичому середовищі під дією внутрішніх мікро- чи макрогальванічних процесів або при зовнішній різниці потенціалів. Істотно впливає на корозійні процеси рівень зовнішніх чи внутрішніх (залишкових) напруг і їхній розподіл у металевому виробі. На корозію сталей і інших металів, особливо в контакті з грунтом (землею), можуть впливати продукти життєдіяльності мікроорганізмів, що значно прискорюють процеси корозії. Хімічній корозії піддаються деталі і вузли машин, що працюють при високих температурах, — двигуни поршневого і турбінного типу, ракетні двигуни і т.п. Хімічна спорідненість більшості металів до кисню при високих температурах майже необмежена, тому що оксиди всіх технічно важливих металів здатні розчинятися в металах. Швидкість окислювання металу залежить від швидкості власне хімічної реакції і швидкості дифузії окислювача через плівку, а тому захисна дія плівки тим вище, чим краще її суцільність і нижча дифузійна здатність. Суцільність плівки, що утвориться на поверхні металу, можна оцінити за відношенням об'єму оксиду, що утворився, або іншого якого-небудь з'єднання до об'єму витраченого на утворення цього оксиду металу. Складні теоретичні питання про розвиток оксидних і інших шарів на поверхні металів має практичне значення в технології машинобудування, тому що зміну розмірів деталей після їхнього оксидування необхідно врахувати (припуск на обробку). У металів зі змінним ступенем окислювання будова плівки по товщині неоднакова. Найкращі за стійкістю оксидні плівки служать надійним захистом від корозії. Зміна складу металу в_ результаті газової корозії. Якщо утворення оксидного шару при високій температурі супроводжується інтенсивною дифузією кисню у середину металу, то це приводить до зміни його складу за рахунок окислювання легуючих компонентів. Особливо це помітно на конструкційних сталях, у поверхневих шарах, у яких відбувається втрата міцності, особливо для тонкостінних виробів. Взаємодія сталей із середовищами, що окисляють, можна представити у виді таких рівнянь:
Останній випадок — найбільш небезпечний, тому що водень, розчиняючи в сталі створює підвищену крихкість металу. При тонкостінних конструкціях цей вплив газової корозії на зниження міцності особливо помітно.
(де R — органічні радикали). Хімічна корозія в неводних середовищах: Ці процеси характерні для експлуатації хіміко-технологічного устаткування. Незважаючи на складність їхнього розвитку, вони уявляють собою звичайні гетерогенні хімічні реакції: Розрив ковалентних зв'язків і перехід їх в іонні легше відбувається при підвищених температурах. Особливо легко йде перебудова зв'язків в присутності залишків води. Остання обставина має місце при корозії живильної апаратури двигунів внутрішнього згоряння (плунжерні пари, форсунки), що працюють на паливі з домішками сірчистих з'єднань. Раніше електрохімічну корозію називали гальванічною корозією, тому що руйнування металу відбувається під дією виникаючих гальванічноюпар. Розглянемо різні випадки виникнення корозійних гальванічних пар: 1. Контакт з електролітом двох різних металів у випадку сполучення в одному вузлі або деталі металів різної активності в даному середовищі, чи у випадку застосування сплаву евтектичного типу з двох металів різної активності. 2. Контакт металу і його з'єднання, що володіє металоподібними чи напівпровідниковими властивостями. У будь-якому випадку вільний метал має негативний електричний заряд, а з'єднання — позитивний заряд, тому що в ньому частина електронів провідності зв'язана. 3. Різні концентрації електролітів повітря, розчиненого в рідкому електроліті. 4. Різний рівень механічних напруг в одній і тій же деталі. Механізм електрохімічної корозії, зумовлений різницею потенціалів пасивних (катодних) і активних (анодних) ділянок, зводиться до роботи гальванічного елемента, однак результат корозійних руйнувань може бути різний. На механізм низькотемпературної корозії впливає багато різних причин: змінна температура і вологість повітря, змінний склад газового й електролітного середовища і навіть бактеріальна флора, наприклад при ґрунтовій корозії, тому що деякі види бактерій сприяють окислюванню заліза. Сам процес взаємодії металів з електролітним середовищем може відбуватися з водневої, чи з кисневою диполяризацією в залежності від рН середовища. Різні концентрації електроліту можуть викликати корозію, створюючи пари навіть з однаковими металами. Різний вміст кисню також приводить до утворення гальванічної пари — менш окислений і більш окислений метал. Прикладом може служити корозія металу під краплею води (крапкова корозія, що переходить у піттінг); Поверхневі шари води містять більше кисню, ніж внутрішні, і тому середня частина змоченого металу виявляється більш активною (анод), чим зовнішня (катод). Після висихання краплі в її центрі з'являється досить глибока пляма іржі. Якщо взяти досить тонку (0,2...0,1 мм) пластинку, наприклад сталі, то можна одер- жати наскрізний отвір. Такі процеси часто спостерігаються при атмосферній чи ґрунтовій корозії. Корозійні пари можуть виникати при дії зовнішніх чи внутрішніх механічних напруг (залишкових напруг, наприклад при зварюванні). Якщо пластинку сталі, чи дюралю титанового сплаву зігнути й у напруженому стані занурити в корозійне середовище, то на розтягнутому шарі (зовнішній стороні) через відносно короткий час виникнуть тріщини, а внутрішній стиснутий шар буде залишатися без змін. Розтяжні зусилля особливо небезпечні, тому що в цьому випадку метал підвищує свою активність. Якщо зігнути пружно пластинку термічно обробити і пружні деформації перейдуть у пластичні (явище релаксації), то різниці потенціалів не виникає. Таким чином, при виготовленні деталей і вузлів машин для заняття залишкових напруг завжди варто термічно обробляти вироби, якщо ці вироби призначені для роботи в сильно корелючих середовищах. Захист металів від корозії Захист металів від корозійного руйнування складається з цілого комплексу заходів щодо збільшення працездатності і надійності машин і конструкцій у данному середовищі. Частина цих заходів закладається ще в процесі проектування, частина — у процесі виготовлення машин або конструкцій, а інші заходи повинні бути вжиті в процесі експлуатації. Створення раціональних конструкцій. Вибір матеріалів і їхнього сполучення для даного виробу, звичайно, диктується технічною й економічною доцільністю, але повинно забезпечувати їх корозійну стійкість. Конструктор повинний перетбачити раціональні форми частин машини, що припускають швидке очищення від бруду; машина не повинна мати місць скупчення вологи, що є збудником корозії. Обробка навколишнього середовища. Для різних видів корозійних процесів обробка середовища набирає різні форми. Сюди можна віднести вилучення чи зниження концентрації речовин, що викликають чи прискорюють корозійні процеси, а також уведення сповільнювачів чи інгібіторів корозії. Так, наприклад, високотемпературна газова корозія відбувається головним чином за рахунок кисню чи повітря інших середовищ, що окисляють. Вилучити кисень з них не можна, тому що це порушить роботу машини (двигунів) чи конструкцій (оболонки, площини і т.д.). Тому обробка зводиться тільки до вилучення каталізуючих речовин, наявність яких приводить до порушення стійких оксидних шарів, що пасивують метал. Прикладом для першого випадку обробки середовища може служити вилучення з'єднань ванадію, що містяться іноді в сірчистих мазутах. Ванадій, окисляючи до На стійкість оксидних шарів шкідливо впливає наявність галогенів, що створюють леткі з'єднання. Поглинання галогенів, зміна складу окисного середовища (без галогенів) значно підвищує стійкість металевих поверхонь. До обробки середовища можна повною мірою віднести і загальні заходи щодо збереження навколишнього середовища, що вимагають очищення промислових і вихлопних газів, тому що збільшення змісту в повітрі
Електрохімічна корозія залежить від складу електроліту, і регулювання рН і зміст іонів СІ, що істотно впливають на швидкість корозії. Кисень, розчинений в електролітах (наприклад, живильна вода парових казанів), також форсує корозію з кисневою деполярізацією, і зниження його концентрації приводить до стабілізації поверхні металу. Кисень, що міститься в живильній воді, можна поглинути, пропускаючи воду через фільтри з металевої стружки. Окислювання стружки, яку завжди легко замінити у фільтрі, охороняє стінки казана. У приладобудівній практиці при герметизації схем звичайно заміняють повітря на гелій чи аргон високої чистоти, що взагалі виключає корозію. Якщо є можливість, то створюється вакуум Створення ізолюючих плівок на металах. Для різних умов корозії на поверхні металів створюються ізолюючі плівки. їхня стійкість залежить від температури і корозійного середовища. Захисні шари від високотемпературної корозії можуть бути створені з тугоплавких з'єднань, що мають низьку дифузійну проникненість для агента корозії (ПРО, N, галогени). Для підвищення корозійної стійкості металів і сплавів їх легують поверхово чи об'ємно іншими металами. Жаростійке облегування здійснюють одночасно з одержанням того чи іншого конструкційного металу. Уводяться такі легуючі компоненти, що збільшують жароміцність і, крім того, мають високу дифузійну здатність в даному металі, сплаві і, виходячи на поверхню, утворюють стійкі оксидні шари. Так, наприклад, хром і нікель у нержавіючих сталях, дифундуючи до поверхні, утворюють оксидний шар, що містить шпінель Прикладом такого типу захисних плівок може служити сіліціюваний та молібденування: на поверхню молібдену дифузійним шляхом наноситься шар кремнію, що утворює з молібденом з'єднання Лакування — нанесенняя високомолекулярних з'єднань, розчинених у леткому розчиннику на поверхні металу. Після випару розчинника на металі залишається полімерний шар, що не пропускає окислювач і має електроізоляційні властивості. Лаки виготовляються з природних смол (шелак) чи із синтетичних полімерів (фенолальдегідів, гліфталеві, силіконові т. ін.). При випаровуванні розчинника можуть утворюватися шпари в лаковому покритті, і тому найчастіше вживаються багатошарові покриття, імовірність утворення наскрізних шпар в яких значно менше. Фарбування металевих поверхонь супроводжується утворенням полімеру безпосередньо на поверхні металу в процесі нанесення фарби і її тужавіння. Олійна фарба уявляє собою суміш (оліфа) і пігменту — барвника. При нанесенні фарби тонким шаром на зачищену до блиску поверхні металу олія швидка окисляється киснем повітря і тужавіє, утворюючи на поверхні металу щільну плівку, що і захищає метал від корозії. Для збільшення корозієстійкості до чорних металів в процесі їх виготовлення додають легуючі елементи, хром, нікель, ванадій, титан та ін. Ці леговані сталі дуже дорогі і їх використовують в основному для агресивних середовищ. Контрольні запитання до 5 розділу 1. Класифікація та призначення чорних металів. 2. Виготовлення чавуну. 3. Виготовлення сталі. 4. Устрій домнової печі. 5. Устрій конвертера та мартенової печі. 6. Класифікація та властивості кольорових металів. 7. Виготовлення міді. 8. Виготовлення алюмінію. 9. Виготовлення титану. 10. Виготовлння магнію. 11. Корозія металів. 12. Антикорозійних захід. 13. Обробка сталевих виливків. 14. Сплави кольорових металів.
|
||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 747; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.242.223 (0.009 с.) |



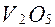 у процесі горіння мазуту, діє як каталізатор при руйнуванні металевих поверхонь
у процесі горіння мазуту, діє як каталізатор при руйнуванні металевих поверхонь 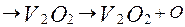 навіть при вмісті його в мазутах
навіть при вмісті його в мазутах 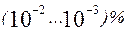 Зв'язування ванадію в міцні з'єднання зі ступенем окислювання +5 усуває його шкідливий вплив ("ванадієва корозія").
Зв'язування ванадію в міцні з'єднання зі ступенем окислювання +5 усуває його шкідливий вплив ("ванадієва корозія"). оксидів азоту й іншіх газів не тільки згубно діє на навколишню природу, але і форсує руйнування металевих конструкцій у результаті атмосферної корозії, особливо у великих містах і поблизу промислових підприємств.
оксидів азоту й іншіх газів не тільки згубно діє на навколишню природу, але і форсує руйнування металевих конструкцій у результаті атмосферної корозії, особливо у великих містах і поблизу промислових підприємств.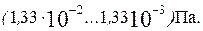 При необхідності встоновлення приладового пристрою в атмосфері і неможливості герметизації його ставлять поглиначі, що сорбірують вологу і діоксид вуглецю з повітря і тим самим знижують можливість появи корозійного шару.
При необхідності встоновлення приладового пристрою в атмосфері і неможливості герметизації його ставлять поглиначі, що сорбірують вологу і діоксид вуглецю з повітря і тим самим знижують можливість появи корозійного шару. і частково шпінель
і частково шпінель  Оксидний шар такого складу виявляється більш стійкий, чим просто оксид
Оксидний шар такого складу виявляється більш стійкий, чим просто оксид  що утворюється на поверхні чистого хрому. Поверхневе легування уявляє собою насичення поверхні даного сплаву металом, що має міцний оксидний шар, — алітування, хромування, сіліціювання і т. і. Воно здійснюється дифузійно з газової фази, що містить пару або леткі з'днання легуючого компонента, нанесення шару цього металу вакуумним чи плазмовим напилюванням, або навіть наплавлення, але обов'язково з наступною термообробкою виробу. При нанесенні на поверхню даного металу легуючого компонента можливе утворення між ними інтерметалідів.
що утворюється на поверхні чистого хрому. Поверхневе легування уявляє собою насичення поверхні даного сплаву металом, що має міцний оксидний шар, — алітування, хромування, сіліціювання і т. і. Воно здійснюється дифузійно з газової фази, що містить пару або леткі з'днання легуючого компонента, нанесення шару цього металу вакуумним чи плазмовим напилюванням, або навіть наплавлення, але обов'язково з наступною термообробкою виробу. При нанесенні на поверхню даного металу легуючого компонента можливе утворення між ними інтерметалідів.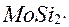 Захисні шари від низькотемпературної корозії можуть оути органічні, неорганічні чи металеві. При консервації виробів застосовується змащення оліями, що неокислюються, (вуглеводи стійкі до окислювання). Олії наносяться при підвищеній температурі (поліпшення змочування, зниження в'язкості) і, застигаючим, утворюють шар, що захищає метал від електронного середовища і повітря. Особливо стійкий такий захист при додаванні до складу змащення інгібіторів. Незручність консервування змащенням складається в необхідності вилучення олії з поверхні металу при наступних операціях (знежирення).
Захисні шари від низькотемпературної корозії можуть оути органічні, неорганічні чи металеві. При консервації виробів застосовується змащення оліями, що неокислюються, (вуглеводи стійкі до окислювання). Олії наносяться при підвищеній температурі (поліпшення змочування, зниження в'язкості) і, застигаючим, утворюють шар, що захищає метал від електронного середовища і повітря. Особливо стійкий такий захист при додаванні до складу змащення інгібіторів. Незручність консервування змащенням складається в необхідності вилучення олії з поверхні металу при наступних операціях (знежирення).


