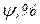Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Технологія кольорових металівСодержание книги
Поиск на нашем сайте Класифікація кольорових металів Кольорові метали: мідь, алюміній, магній, титан, свинець, цинк, олово та ін. незважаючи на їх відносно високу вартість, широко застосовуються в промисловості. Однак у тих випадках, коли це можливо, кольорові метали замінюють чорними чи неметалевими матеріалами — пластмасами, тощо. Мідь за застосуванням в промисловості займає одне з перших місць серед кольорових металів. Високі пластичність, електропровідність, теплопровідність і підвищена корозійна стійкість — найцінніші властивості міді. Внаслідок високої електропровідності мідь — прекрасний метал для електромашинобудування, виготовлення кабелів і проводки для передачі електроенергії. Мідь є основою в сплавах, що широко застосовуються в машинобудуванні. Алюміній — легкий метал, має високу пластичність, високу електропровідність і на повітрі стійкий проти корозії (на поверхні алюмінію є цільна оксидна плівка, що перешкоджає подальшій корозії). Його застосовують для виготовлення електро- проводів, посуду, для захисту інших металів і сплавів від окислення. В машинобудівництві чистий алюміній використовують рідко через незначну міцність. Він є основою для одержання багатьох сплавів, які широко застосовуються у літакобудуванні, авто-, ва-гоно- і приладобудуванні, тощо. Магній — дуже легкий метал. Основним недоліком магнію є його незначна хімічна стійкість. Чистий магній як конструкційний матеріал не застосовується. Він застосовується як основа для дуже легких конструкційних сплавів. Титан і його сплави мають високі антикорозійні властивості при значній щільності. Широко застосовуються в машинобудуванні (літако- і суднобудування, ракетобудування, хімічна і атомна промисловість). Промислове виробництво титану почалося в 1946 р. і швидко зростає. Технологія міді Сировина. Мідні руди поділяються на дві основні групи: сульфідні, у яких мідь зв'язана із сіркою в складі сульфідних мінералів, і окисленні, де мідь входить до складу оксидів. Зустрічається самородна мідь (99,9% Си); однак промислові руди із самородною міддю дуже рідкі (лише близько 5% усіх світових родовищ міді) і промислове значення їх невелике. На сульфідні руди приходиться близько 80% усіх світових запасів міді. Найбільш розповсюджений у сульфідних рудах халькопірит (мідний колчедан)
Середній вміст міді в промислових рудах (1...2)%, мінімальний — 0,5%; руди, що містять 3% міді і більше, вважаються багатими. До складу порожньої породи входять барит, кварц, кальцит і різні алюмосилікати. На території країн СНД основні родовища мідних руд знаходяться на Південному Уралі, в Казахстані, Закавказзі та Узбекистані, на Таймирі. Сьогодні до 80% усієї міді одержують піроме-талургійним способом, тобто виплавляють із сульфідного мідного концентрату (продукту збагачення руди флотацією). Близько 20% міді одержують з руд гідрометалургійними способом, при якому руда обробляється розчинником, що переводить мідь у розчин. З розчину мідь осаджують електролізом чи хімічним способом як і при пірометалургійному способі. Мідні концентрати піддають окисному випаленню і потім проплавляють у полум'яних відбивних чи електричних печах. Іноді концентрати вишматовують, тобто брикетують, спікають, потім плавлять у шахтних печах. У результаті плавки одержують два розплави, що не змішуються; на поду печі — штейн, поверх нього — шлак, в який переходить вся порожня порода й більша частина заліза в окисленому стані. Таким чином, в основі піромета-лургійного способу лежить поділ рідких фаз. Штейн — складний сульфідний розплав, що містить (10...60)% Си, (15...50)% Fe і близько 25% S(CuS + FeS складає в штейні (80...90)%, а також домішки сульфідів інших металів (нікелю, свинцю, цинку) благородних металів і шлаку — (4...5)%. Переробка штейнів здійснюється в конверторах, де через рідкий штейн продувають повітря, в результаті чого сірка вигоряє, а залізо шлакується. Продуктами цієї переробки є чорнова мідь і конверторний шлак. Цей процес називають бесемеруванням штейнів. Чорнова мідь містить (98,5...99,5)% міді і до 1,5% різних домішок, головним чином, заліза, сірки і кисню, а також нікелю, кобальту і багатьох інших металів, у тому числі срібла і золота. Вона піддається вогневому й електролітичному рафінуванню. Окремими складовими технології міді є флотація, обпалювання. Флотація. Насамперед мідну руду піддають збагаченню способом флотації з метою вилучення більшої частини порожньої породи й одержання мідного концентрату. Для флотації руду дроблять і подрібнюють на кульових млинах. До подрібненої до зерен розміром зерен (0,05...0,5) мм руди додають маслянисті синтетичні речовини, мінеральні і рослинні олії, при цьому крупинки сульфідної міді покриваються масляною плівкою, що сприяє наступному вилученню їх від порожньої породи. Підготовлена руда з бункера надходить у камеру флотаційної машини (рис. 5.19), яка наповнюється водою через трубу 5. По трубі 8 у машину безупинно надходить повітря, що через отвори у дні 1 і тканину, що покриває дно, надходить у ванну. Пухирці повітря прилипають до часток рудних мінералів, що погано змочуються, і виносять їх на поверхню, утворюючи шар піни 3. Піну випускають через злив 4 і сушать. У результаті одержують мідний концентрат, що утримує звичайно (15...20)% Си. Частки порожньої породи добре змочуються водою й осідають у нижній частині 7 машини, відкіля видаляються через отвір 6.
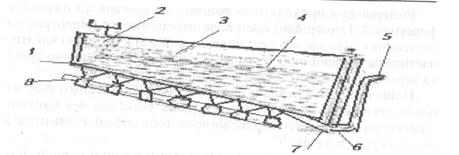
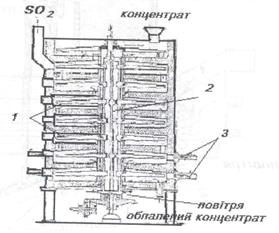
Рис. 5.19. Флотаційна машина Концентрати обпалюють з метою окислення заліза, зменшення змісту сірки і вилучення миш'яку, сурми й інших домішок, щоб при плавці одержати багатий міддю штейн. Обпалюють концентрат в багатоподових печах з механічним перегинанням чи у печах "киплячого шару". Багатоподова піч має форму циліндра діаметром (6...7) м і висотою (9... 10) м. Робочий простір печі розділений по висоті перекриттями із шамотної цегли; у результаті утворюється кілька (7...12) внутрішніх подів і один зовнішній. На рис. 5.20 наведено схему семиподової випалювальної печі (верхній під призначено для сушіння концентрату). По осі печі проходить порожній обертовий сталевий вал 2, до якого на рівнях кожного відділення прикріплено перегрібані l із гребками Повітря для випалу надходить у піч через вал і перегрібачі. Рис. 5.20. Випалювальна піч.
Розігрів печі проводять за допомогою газових чи нафтових форсунок 3. Перегрібачі поступово переміщують концентрат до пересипних отворів, що розташовані біля вала, через які він зсипається на перший ряд, а там від середини перегрібана до краю та через отвір попадає на другий ряд і т.д. Найвища температура в печі (650...800) °С підтримується на передостанньому поді внаслідок горіння сульфідів без витрати палива; на нижньому поді недогарок (обпалений концентрат) охолоджується до 600 °С. Гази, приходячи з пода на під через пересипні отвори, назустріч концентрату, що пересипається, збіднюються киснем та збагачуються сірчистим газом
При випаленні мідних концентратів вилучається від 30 до 75 % сірки в залежності від складу концентрату, його подрібненості й інших причин.
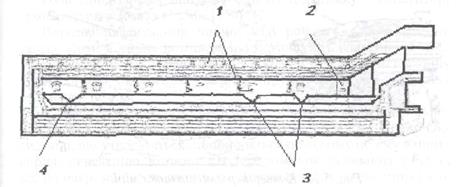
В останні роки почали застосовувати більш продуктивне випалення концентратів у "киплячому шарі". На рис. 5.21 наведено схему печі такого випалення. Концентрат через отвір 8 подають у піч, а повітря вдмухують через отвір 7, повітряну камеру 5 і насадки 4. Регулюванням тиску повітря досягають, щоб зерна чи окатиші концентрату не лягали шаром на під 6, а утримувалися в потоці повітря, утворюючи шар, подібний киплячій в'язкій рідині. Цей шар називають киплячим шаром. Таке "кипіння" в багато разів прискорює окислення в порівнянні з випаленням у багатоподових печах, де зерна концентрату час від часу лише перегрібаються. Недогарок самопливом пересипається через поріг З і викидається з печі на плавку. Обпалені дрібні зерна і пил виносяться з газами в циклони 1 і звідти по трубах 2 зсипаються вниз. Плавлення міді у відбивних печах. Схему печі для плавки наведена на рис. 5.22. Шихта завантажується через отвори І у зводі, що розташовані над обома бічними сторонами печі, і зсипається відкосами біля стін. На відкосах переважно і плавиться шихта і стікає у ванну по поду печі. На відміну від мартенівської і рафінувальної печей для міді, з яких метал випускається після кожної плавки, у відбивних печах шихту плавлять безупинно до зносу зводу. Стінки в них захищаються відкосами із шихти, а під — більш-менш товстим шаром штейну, що постійно на ньому зберігається. Штейн час від часу випускають у ківш, пробиваючи шпури (льотки) З, 4, що потім забивають глиною. Шлак безупинно сходить через поріг у вікно 2.
Рис. 5.22. Відбивна піч для плавки міді Сучасна відбивна піч має довжину робочого простору (32...36) м і ширину (7...8) м. Останнім часом нижню частину печі і звід викладають з більш стійких хромомагнезитових і магнезитових цеглин, причому звід роблять підвісним. Відбивні печі нагрівають мазутом, вугільним пилом чи природним газом. Гази, що відходять, очищають від пилу, що потім надходить в оббіг (тобто знову в піч), а гази використовують для обігріву парових казанів, що знаходяться якнайближче до печі. Головні реакції при плавці відбуваються між сульфідами
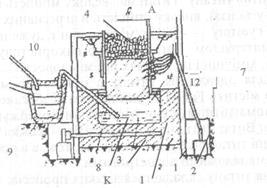
Сульфід штейну, а силікат заліза — шлаку. Флюсом звичайно служить кремениста золотовмісна руда, причому золото майже цілком витягається в штейн. Продування мідних штейнів. Чорнову мідь одержують зі штейнів у конверторах. Майже на всіх заводах працюють гори-
Рис. 5.23. Конвертер для виплавки міді: а — загальний вигляд, б —розріз зонтальні конвертери. На рис. 5.23, а. наведено загальний вид такого конвертора, а на рис. 5.23, б. — його розріз. Конвертор установлюють на роликах 4 і за допомогою механізмів нахиляють для зливу шлаку чи чорнової міді. Штейн заливають ковшами через горловину 1. У вогнестійкій магнезитовій кладці 2 є фурми 5, через які під тиском (0,08...0,12) МПА подається повітря. Штейн продувають повітрям у присутності кварцового флюсу, при цьому сульфід заліза (II) інтенсивно горить, утворюючи оксид заліза й оксид сірки (IV) (сірчистий газ):
Оксид заліза (II) шлакується з флюсом
а сірчистий газ виводиться по газопроводу на очищення від пилу і на виробництво сірчаної кислоти. Шлак зливається з конвертора в ковші, а потім надходить у відбивну піч для витягу міді. Після вигоряння і шлакування заліза в конверторі залишається майже чистий сульфід міді
Оксид міді (І) реагує із сульфідом міді (І), у результаті чого виходить мідь:
Тривалість бесемерування мідних штейнів складає в середньому (10...15) годин, але може доходити і до двох діб при штейнах бідних міддю. Окислення сірки і заліза забезпечує підтримку в конверторі температури в межах (1250... 1350) °С. Вогневе рафінування чорної міді роблять для видалення заліза, сірки й інших домішок, що погіршують властивості міді. Операція вогневого рафінування складається з розплавлення чорнової міді, окислення домішок, вилучення розчинених газів і розкислення міді. У відбивній печі розплавлена на поду чорнова мідь окислюється повітрям, що вдмухується в неї через залізні труби. Оксид міді, що утворюється, поширюється по всьому об'єму ванни і сприяє окисленню домішок. Оксиди домішок спливають у шлак, що по нагромадженні скочують. Для вилучення розчинених газів і відновлення оксиду міді після скочування шлаків у ванну зану- рюють сирі дерев'яні жердини і засипають шар дрібного деревного вугілля. Сире дерево викликає бурхливу реакцію утворення пари води, що сприяє перемішуванню міді і вилученню S02 і інших газів (це називається дражнінням міді). Деревним вугіллям забезпечується відновлення міді з оксиду (розкислення). Якщо конверторна і рафінувальна дільниці на одному заводі, то в піч занурюють рідку конверторну мідь. Вмісткість сучасних рафінувальних печей досягає (250...400) т міді. Для використання теплоти газів, що відходять, у рафінувальних печах також ставлять парові казани. Тривалість рафінування при завантаженні в піч чушкової міді складає (16...26) годин, а при заливанні міді — (10...14) годин. Електролітичне рафінування міді здійснюють з метою одержання найчистішої міді (99,99% Си і вище) для електротехнічної промисловості і побічного витягу золота і срібла, селена, телуру, тощо, які майже завжди містяться в конверторній міді і при вогневому рафінуванні цілком залишаються в ній. Зараз електролізом рафінують близько 95% міді, що виплавляється в нашій країні. При електролітичному рафінуванні використовують мідь у вигляді плит-анодів, відлитих після вогневого рафінування. їх завантажують в електролітичні ванни, заповнені водяним розчином мідного купоросу із сірчаною кислотою (близько 200 г/л), підключають до позитивного полюсу. При увімкненні струму мідь з анодів розчиняється і стільки ж міді з розчину наростає щільним шаром на катодах. Для перемішування і сталості температури з одного кінця у ванну безупинно притікає електроліт, підігрітий до (50...55) °С, а з іншого стікає через жолоб у бак. Частина домішок (цинк, нікель, залізо й ін.) теж розчиняються з аноду, забруднюючи електроліт. Інші нерозчинні домішки, у їхньому числі срібло, золото, селен, телур у вигляді твердих часток, збираються на дні ванни, утворюючи шлам, що періодично випускають, фільтрують і відправляють на переробку для витягу всіх цінних складових частин. Вартість електролітичного рафінування окупається рідкими металами, що випадають у шлам. Щільність струму при рафінуванні (100..200) А на 1 м2катодів, напруга — (0,3...0,35) В; середній вихід шламу — (0,2...0,5)% від ваги анодів. Тривалість розчинення анодів до змін їх — у середньому (20...ЗО) діб. Витрат електроенергії на тонну катодної міді — (700... 1100) МДж. Катоди після промивання переплавляють в електричних чи відбивних печах і відливають заготівки для прокату; у цих же печах одержують сплави на основі міді. Товарна мідь випускається десяти марок (ДСТУ 864-66) від МОО зі змістом міді не менш 99,99% до М4 (99,0%). Технологія алюмінію За поширеністю в природі алюміній займає перше місце серед металів; його вміст у земній корі складає 7,45%. У чистому вигляді алюміній не зустрічається внаслідок своєї високої хімічної активності. Він знаходиться в складі, головним чином, алюмосилікатних гірських порід. Рудами алюмінію можуть бути лише породи, багаті глиноземом Глинозем одержують трьома способами: лужним, кислотним і електротермічним. Найбільше поширення отримав лужний спосіб К.І.Байера, розроблений у Росії і який застосовується для переробки високосортних бокситів з невеликою кількістю ((5...6)%) кремнезему. За цим способом боксит після подрібнення і розмелу вилуговують концентрованим розчином їдкого натру в автоклавах (сталевих герметичних посудинах) при температурі 250 °С і тиску (2,5...3,0) МПа. Автоклави обігрівають перегрітою парою. Гідроксид алюмінію з бокситів за таких умов швидко і досить повно розчиняється з утворенням алюмінату натрію:
Кремнезем, що міститься в бокситі також розчиняється їдким натром з утворенням силікату натрію Тому, чим більше кремнезему в бокситі, тим менше витяг глинозему в розчині. Розклад ашомінатного розчину для одержання кристалічного гідроксиду алюмінію називають викручуванням. Викручування робиться в баках, куди для прискорення процесу вводять невелику кількість гідроксиду, що грає роль затравлення (центрів кристалізації). Реакція гідролізу йде в розведених водою розчинах при повільному перемішуванні пульпи:
Тривалість викручування (75...90) годин. Кристалічний гідроксид після промивання фільтрують і для повного зневодження обпалюють (кальцинують) у трубчастих обертових печах довжиною до 70 м при поступовому нагріванні до 1200 °С. Отриманий глинозем А.А.Яковкіна для бокситів з підвищеним вмістом кремнезему руду і вапняк після подрібнення змішують із содою (1200...1300) °С в барабанних обертових печах. У результаті виходять окатиші спеку, що містять метаалюмінат натрію
Далі алюмінат натрію вилуговують водою. Отриманий алюмінатний розчин відфільтровують, потім підігрівають до 80 °С та в баках з мішалками продувають трубними газами. При цьому оксид вуглецю (IV) з газів реагує з їдким натром з утворенням розчину соди:
що сприяє реакції гідролізу алюмінату натрію й одержанню гідроксиду алюмінію за цією реакцією. Цей процес називають карбонацією. Розчин соди йде на вилуговування чи випаровування для одержання соди, а з гідроксиду одержують глинозем способом кальцинації. Для одержання глинозему з нефеліну його спікають тільки з вапняком, сода тут не потрібна, оскільки в нефеліні її міститься до 20% Схема одержання глинозему зі спеку аналогічна розглянутій. Вапняно-кременистий шлам, що випадає при вилуговуванні спеку'нефеліну, використовують для виробництва цементу. Після карбонізації в розчинах міститься багато оксидів натрію і калію; їх використовують для одержання поташу і соди. Електроліз глинозему. Одержання алюмінію здійснюється при електролізі глинозему, розчиненого в кріоліті відновлення з оксидів, які застосовуються при одержанні інших металів, неприйнятні для одержання алюмінію, тому що він з вуглецем утворює карбід Рис. 5.24. Електролізна ванна для вилучення алюмінію
Електролізна ванна (рис. 5.24) має сталевий кожух, який всередині викладено шамотною цеглою. Подина і стіни ванни складені з вуглецевих блоків, до яких підведені катодні шини. Вуглецеві аноди в сучасних ваннах самообпікаються. За мірою згоряння вони опускаються і нарощуються зверху за рахунок рідкої анодної маси, з якої в міру нагрівання відбувається вилучення летких газів і коксування (випалення) анодної маси. Струм до анодів підводиться штирями. У розплаві кріоліту і глинозему кількість останнього підтримується більш менш постійним ((8...9)%); збиток глинозему від електролізу періодично поповнюється завантаженням його нових порцій. У ході процесу температура розплаву підтримується в межах (939...950) °С теплотою, що виділяється при проходженні струму через електроліт. Потенціал електролітичної дисоціації глинозему (1,7В) менше, ніж кріоліту (3,7В). Глинозем дисоціює на іони:
Іони алюмінію переносять струм до катоду й осаджуються на ньому. Іони кисню розряджаються на аноді. Кисень, що виділяється, спалює вуглець аноду з утворенням Напруга струму у ванні за звичай — (4...4,3) В, сила струму до 140000А. Для одержання 1 кг алюмінію витрачається {60...70) МДж електроенергії і близько 2 кг глинозему. Рідкий алюміній, що накопичується на подині ванни, періодично (кожні 1...2) доби відбирають сифоном чи вакуум-ковшем. Електролітичний алюміній піддається наступному рафінуванню шляхом додаткового електролітичного процесу, при якому анодом є вихідний рідкий алюміній, а катодом — рідкий рафінований алюміній. До вихідного рідкого алюмінію додають 25%
Технологія магнію і титану Виробництво магнію. У чистому виді магній в природі не зустрічається внаслідок своєї високої хімічної активності. У виді з'єднань магній широко розповсюджений у природі, причому знаходиться не тільки у твердих породах, а й також у морській воді та у воді солених озер. Як руди для виробництва магнію звичайно використовують магнезит, що містить карбонат магнію
Магнезит і доломіт піддають механічному збагаченню і випаленню. Випалення проводиться при температурах (850...900) °С. При таких температурах відбувається дисоціація карбонатів:
Оксид магнію MgO зветься каустичним магнезитом. Існують електролітичний і термічний способи одержання магнію. За електролітичним способом спочатку одержують безводний хлорид магнію MgCl, що потім піддають його електролізу з метою одержання магнію. Хлорид магнію з бішофіту і карналіту одержують шляхом їх зневодження при повільному нагріванні в трубчастих печах (100...180) °С. Хлорид магнію одержують обробкою каустичного магнію при температурі (800...900) °С газоподібним хлором у присутності вуглецю в електричній шахтній печі:
Електроліз хлориду магнію роблять у щільно закритих електролітичних ваннах (рис. 5.25). Як при електролізі глинозему, електричний струм тут використовується для електрохімічного процесу і для нагрівання ванни; робоча температура процесу близько 700 °С; напруга струму — (6...7) В, сила струму (30000...70000)А.
5.25. Схема електролізера Аноди виготовляють із графіту. Катоди — зі сталі у формі пластин; вони розташовані у ванні вертикально і паралельно один до одного. Вогнетривка перегородка відокремлює хлор від магнію. При електролізі на анодах виділяється газоподібний хлор, що пухирцями спливає на поверхню і по хлоропроводах виводиться яття ттоттальтттого використання; біля катодів виділяється магній. Густина електроліту збільшуєтьсяvдобавленням Рафінування електролітичного магнію виробляється або переплавленням його разом із флюсами, що рафінують, (суміш хлористих солей лужних і лужноземельних металів), або сублімацією у вакуумі під тиском (10...20)Па при температурі 600 °С. Таким способом одержують магній високої чистоти (до 99,99% Mg). Термічні способи одержання магнію. Ці способи одержали широке поширення внаслідок своєї простоти. Суть термічних способів складається у відновленні оксиду магнію нафтовим коксом у герметичній дуговій електропечі при температурі (1900...2000) °С. Магній, що випаровується, швидко охолоджується. Таким способом одержують чистий магній (99,97% Mg) при втраті електроенергії близько 75000 МДж на тонну металу. Відновлюють оксид магнію також кремнієм у вакуумі (залишковий тиск 10 Па) при температурі 1160 °С. Виробництво титану. Титан має велику міцність (майже вдвічі більшу, ніж у заліза), високу стійкість в агресивних середовищах та невелику густину — 4500 Рудами для одержання титану є рутил, що містить Вилучення титану складається з таких процесів: 1. Одержання в електричній шахтній печі тетрахлориду титану 2. Одержання губчастого титану (титанової губки) відновленням тетрахлориду титану при взаємодії з магнієм у нейтральній атмосфері (аргон чи гелій) при температурі в зоні реакції (950... 1000) °С; 3. Одержання злитків титану в електричних дугових печах під вакуумом. Для цього губку пресують з метою одержання з неї електродів. Такий електрод подається у верхню частину печі і є одним полюсом постійного струму. Іншим полюсом служить мідна во-доохолоджувана виливниця. За мірою плавлення електроду, що витрачається, з губки і затвердіння титану біля холодних стінок днище виливниці опускається до одержання злитку встановленої довжини. Сила струму при плавці — до 5400А, напруга — близь- ко 30 В. Чистота титану одержуваного переплавленням губки, складає (99,6...99,7)%. Основні властивості металів наведено в табл. 5.1. Таблиця, 5.1. Властивості металів
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 438; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.015 с.) |

 . За ним йде халькозин (мідний блиск)
. За ним йде халькозин (мідний блиск)  борнит
борнит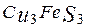 і рідше ковелін CuS. У таких рудах звичайним мінералом є малахіт
і рідше ковелін CuS. У таких рудах звичайним мінералом є малахіт
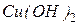 іноді куприт
іноді куприт  тенорит (мелаконіт) CuO, азурит
тенорит (мелаконіт) CuO, азурит
 . З верхнього пода вони відходять у газопровід при температурі (320...400) С, а потім направляються в пилоуловлювачі і на виробництво сірчаної кислоти. Основні реакції при випалі міді такі:
. З верхнього пода вони відходять у газопровід при температурі (320...400) С, а потім направляються в пилоуловлювачі і на виробництво сірчаної кислоти. Основні реакції при випалі міді такі:


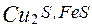 і оксидами
і оксидами 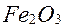 і
і  що складають основну масу недогарку і флюсу. Для утворення шлаку потрібна температура близько 1100 °С, а для утворення штейну — (800...900) °С, тому тепловий режим печі визначається в першу чергу умовами шлакоутворення. Основні реакції плавки такі:
що складають основну масу недогарку і флюсу. Для утворення шлаку потрібна температура близько 1100 °С, а для утворення штейну — (800...900) °С, тому тепловий режим печі визначається в першу чергу умовами шлакоутворення. Основні реакції плавки такі:



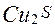 і сульфід заліза FeS складають основну масу
і сульфід заліза FeS складають основну масу
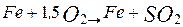

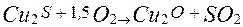
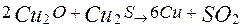
 що лежать на поверхні землі. До таких порід відносяться боксити, нефеліни, алуніти і каоліни (глини). Найважливіша алюмінієва руда — боксити — складається з гідроксидів алюмінію і заліза, кремнезему, поєднань кальцію, магнію, тощо. Зараз як руду застосовують нефеліни і алуніти. Крупні родовища бокситів знаходяться в Росії на Уралі, у Санкт-Петербургській області, в Алтайському і Красноярському краях і ін. регіонах. Нефелін
що лежать на поверхні землі. До таких порід відносяться боксити, нефеліни, алуніти і каоліни (глини). Найважливіша алюмінієва руда — боксити — складається з гідроксидів алюмінію і заліза, кремнезему, поєднань кальцію, магнію, тощо. Зараз як руду застосовують нефеліни і алуніти. Крупні родовища бокситів знаходяться в Росії на Уралі, у Санкт-Петербургській області, в Алтайському і Красноярському краях і ін. регіонах. Нефелін 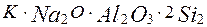 входить до складу апатитонефелінових порід (на Кольському півострові). Бироо-ництво алюмінію складається з двох основних процесів: одержання глинозему з руди й електролізу глинозему.
входить до складу апатитонефелінових порід (на Кольському півострові). Бироо-ництво алюмінію складається з двох основних процесів: одержання глинозему з руди й електролізу глинозему.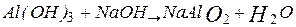
 який реагує з алюмінатом натрію і водою, в результаті чого виходить натрієвий
який реагує з алюмінатом натрію і водою, в результаті чого виходить натрієвий 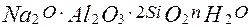 алюмосилікат що випадає в осадок.
алюмосилікат що випадає в осадок.
 та спікають при температурі
та спікають при температурі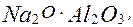 а також нерозчинний у воді двокальцієвий силікат
а також нерозчинний у воді двокальцієвий силікат 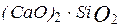 метаферит натрію
метаферит натрію та ін. з'єднання.
та ін. з'єднання.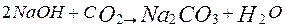
 Способи
Способи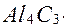


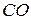 і
і  . Електроліт зверху і з боків ізольований твердою скоринкою. Що зменшує тепловтрати і випаровування електроліту.
. Електроліт зверху і з боків ізольований твердою скоринкою. Що зменшує тепловтрати і випаровування електроліту.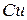 , щоб збільшити густину сплаву до 3,5
, щоб збільшити густину сплаву до 3,5 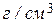 сплав розташовується на подині ванни, що є анодом. Поверх металу, що рафінується, знаходиться електроліт, що складається із суміші солей
сплав розташовується на подині ванни, що є анодом. Поверх металу, що рафінується, знаходиться електроліт, що складається із суміші солей і Na(17%) та має густину 2700
і Na(17%) та має густину 2700 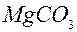 доломіт, що містить подвійний карбонат магнію і кальцію
доломіт, що містить подвійний карбонат магнію і кальцію  карналіт, що містить подвійний хлорид магнію і калію
карналіт, що містить подвійний хлорид магнію і калію  і бішофіт — шестиводний хлорид магію
і бішофіт — шестиводний хлорид магію що одержується з морської води і води деяких озер шляхом випаровування і кристалізації.
що одержується з морської води і води деяких озер шляхом випаровування і кристалізації.


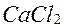 так щоб він перевищував густину магнію, тому останній спливає на іш-верхню електроліту, звідкіля за нагромадженням витягується за допомогою вакуумних ковшів. Витрата електроенергії на тонну магнію складає (55000...60000) МДж.
так щоб він перевищував густину магнію, тому останній спливає на іш-верхню електроліту, звідкіля за нагромадженням витягується за допомогою вакуумних ковшів. Витрата електроенергії на тонну магнію складає (55000...60000) МДж. тому він є дуже цінним конструкційним матеріалом. Титан широко використовується в літакобудуванні, хімічній і ін. галузях промисловості.
тому він є дуже цінним конструкційним матеріалом. Титан широко використовується в літакобудуванні, хімічній і ін. галузях промисловості.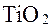 і ільменіт, що містить
і ільменіт, що містить  Руди піддають збагаченню (мокрому чи електромагнітному), в результаті чого одержують титанові концентрати. Витяг титану з концентратів — важка річ, тому що цри нагріванні титан реагує з киснем і азотом, а в розплавленому стані — з усіма відомими вогнетривами.
Руди піддають збагаченню (мокрому чи електромагнітному), в результаті чого одержують титанові концентрати. Витяг титану з концентратів — важка річ, тому що цри нагріванні титан реагує з киснем і азотом, а в розплавленому стані — з усіма відомими вогнетривами.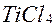 при нагріванні брикетів із суміші титанових концентратів технічного оксиду титану
при нагріванні брикетів із суміші титанових концентратів технічного оксиду титану 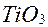 з вугіллям у струмі хлору; тетрахлорид титану після конденсації пари виходить у вигляді забрудненої червонуватої рідини, що очищується дистиляцією;
з вугіллям у струмі хлору; тетрахлорид титану після конденсації пари виходить у вигляді забрудненої червонуватої рідини, що очищується дистиляцією;
 %
%
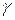 ,МС м/м
,МС м/м

 ,%
,%