
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Матеріальний баланс повітряної сушаркиСодержание книги
Поиск на нашем сайте
Звичайно сушарки розраховують, виходячи із заданої кількості вологого матеріалу та його початкової і кінцевої вологості. Для витрат сухого повітря при визначенних витрат висушеного матеріалу, витрати видаляємої вологи і на висушування складають матеріальний баланс: а) за абсолютно сухою речовиною: якщо немає втрат матеріалу, кількість абсолютної сухої речовини в ньому до і після висушування лишається незмінною; якщо ж
звідки маси вологого матеріалу
або маси висушеного матеріалу
б) за вологою в матеріалі; кількість вологи W, яку вилучають під час висушування, дорівнює різниці мас вологого і висушеного матеріалу
Підставивши в останнє рівняння попереднє дістанемо
Матеріальний баланс за масою в сушаці можна подати і так
Звідки визначають витрати повітря на 1 кг вологи
або простіше
Рівняння енергетичного балансу дозволяють визначити затрати енергії на вилучення вологи із висушуємого матеріалу. На поверхні вологого матеріалу під час випаровування вологи утворюється пограничний пароповітряний шар, який перебуватиме у стані рівноваги з вологим матеріалом. Різниця парціальних тисків водяної пари над поверхнею матеріалу Кількість пари, що продифундувала, визначиться за законом випаровування з вільної поверхні
F— поверхня випаровування;
Порядок аналітичного розрахунку сушарки такий: 1. Визначають стан повітря перед калорифером. Для цього за відомою його початковою температурою 2. Визначають стан повітря після калорифера, тобто перед сушильною камерою. Для цього треба вибрати температуру 3. Визначають стан повітря після сушильної камери, вибравши температуру, відпрацьованого повіттря 4. Обчислюють поправку на реальну сушарку. 5. Одержані значення начити параметри для повітря, що виходить з сушарки, а весь розрахунок повторити до одержання тотожності. 6. Розраховують питомі витрати сухого повітря, витрати теплоти в калорифері і додаткові витрати теплоти в сушильній камері. З усього описаного випливає, що аналітичний розрахунок повітряної сушарки громіздкий, незручний, потребує кількох повторних обчислень. Аналітичний розрахунок не багато в чому поступається перед графічним методом, а похибки, що мають місце в результаті графічного розрахунку не виходять за межі звичайниих технічних розрахунків. Розрахунок повітряної сушарки за 1-х діаграмою. Розрахувати повіряну сушарку — це означає визначити питомі і загальні втрати теплоти і повітря на висушування, а також значення інших парамерів, необхідних для розрахунку калорифера, сушильної камери й витяжного пристрою (вентилятора). Побудова процесу сушіння в 1-х діаграмі дає можливість встановити характер обміну теплотою і вологою, а також визначити проміжні і кінцеві параметри повітря. Теоретична сушарка. Процес, що відбувається в теоретичній сушарці, на діаграмі (див. додаток 6) зображають так. За відомою початковою температурою повітря Оскільки в теоретичній сушарці теплообмін відбувається при сталій ентальпії повітря, то спускаючись з точки В лінії сталої ентальпії Знаючи параметри повітря на вході і виході, легко обчислити: питомі витрати сухого повітря на випарювання 1 кг вологи — за рівнянням 4.41, а питомі витрати теплоти в калорифері — за рівнянням:
і цього рівняння випливає, що в теоретичній сушарці тепло витрачається на: випаровування втрату з відпрацьованим повітрям
вологи. Причому втрати теплати будуть тим меншими, чим нижча температура відпрацьованого повітря Кристалізація Кристалізацією називають процес вилучення речовини з розчину, розплаву або пари у вигляді кристалів. У промисловості переважно мають справу з кристалізацією з розчинів. Кристалічна будова твердої фази найстійкіша, оскільки структурні елементи (атоми, іони або молекули), утворюючи кристалічні решітки, розташовуються найбільш компактно і мають мінімум вільної енергії. Тому аморфні речовини поступово кристалізуються (наприклад, кристалізація сахарози в карамелі та інших кондитерських масах під час тривалого зберігання). Зовні кристали являють собою багатогранники різної форми, з певною симетрією. Саме властивість симетрії і покладено в основу класифікації кристалів. У випадку масової кристалізації (за умов промислового виробництва) кристали однієї й тієї самої речовини відрізняються між собою розмірами і зовнішнім виглядом (габітусом). Проте кути між відповідними гранями у всіх кристалів цієї речовини лишаються однаковими. Ця властивість, пов'язана з особливостями внутрішньої будови, називається законом сталості кутів (закон Гюї). Деякі речовини мають кілька кристалічних форм, стійких у певних інтервалах тиску і температури (явище поліморфізму). Перехід з однієї кристалічної форми в іншу супроводжується тепловим ефектом у зв'язку з перебудовою кристалічних решіток. Багато речовин кристалізується з включенням у кристалічні решітки молекул води, утворюючи так звані кристалогідрати. Кристалографія, спираючись на симетрію, зводить усю різноманітність форм кристалів до 230 груп, які, в свою чергу, об'єднуються в 7 кристалічних систем (сингоній): триклинну, моноклин-ну, ромбічну, тригональну, тетрагональну, гексагональну і кубічну. Наприклад, кристали поширеної — сахарози — відносять до моноклинної сингонії. Вони характеризуються трьома кристалографічними осями з нерівними відрізками, причому дві осі розташовані під прямими кутами, а третя — похило ( У промисловості за допомогою кристалізації одержують речовини (сіль, цукор, глюкозу, лактозу) у чистому і зручному для використання вигляді. Щоб дістати надчисті речовини, вдаються до багаторазової перекристалізації (наприклад, при виробництві цукру). Крім чистоти, важливою характеристикою є розмір.кристалів та їх однорідність. Звичайно прагнуть одержати крупнокри-сталічний однорідний продукт, що добре фільтрується і сушиться. У процесі виготовлення карамелі вживають усіх заходів, щоб запобігти кристалізації (зцукрюванню) — додають крохмальну патоку, інвертний цукор та інші антикристалізатори. Кристалізація — небажане явище і під час зберігання багатьох кондитерських мас. А при виробництві кристалічного ірису, навпаки, прагнуть прискорити процес кристалізації. У виробництві мармеладу і пастили цей процес регулюють так, щоб утворилася тоненька кристалічна кірочка, яка надає виробам товарного вигляду. Процес кристалізації використовують також під час згущування виморожуванням термонестійких рідких продуктів. При цьому зберігаються їх поживні властивості. Зворотний кристалізації процес переходу твердої фази в рідкий стан, коли молекули твердої речовини розподіляються між молекулами розчинника, називають розчиненням. Розчинення супроводжує процес кристалізації в промислових умовах при коливаннях температури і концентрації. Поряд з цим він має самостійне значення у більшості виробництв, де використовують цукор, сіль та інші розчинні продукти. Процеси кристалізації і розчинення не є суворо зворотними. Часто за однакових значень рушійної сили (різниці концентрацій) розчинення відбувається значно швидше, ніж кристалізація. Зазначимо, що процес кристалізації набагато складніший. Кристалізація, як і будь-який фізико-хімічний процес, характеризується статикою, кінетикою і динамікою. Статика кристалізації визначає умови рівноваги між кристалами і розчином, з якого вони утворювались, а також зв'язок між початковими і кінцевими параметрами процесу. Кінетика встановлює величину швидкості переходу речовини з однієї фази в іншу при заданих умовах. Динаміка кристалізації визначає характер зміни параметрів системи в часі при зміні керованих параметрів (температури, концентрації). На основі статики складають матеріальні і теплові баланси, потрібні для розрахунку виходу кристалічного продукту, а також витрати теплоти. Кінетичний розрахунок застосовують для вибору конструкції та визначення розмірів кристалізатора. Динамічні характеристики кристалізаторів потрібні для автоматичного керування і оптимізацїі процесу. Фізичні основи процесу. Кристалізація відбувається в результаті обмеженої розчинності речовин. Якщо в розчинник ввести достатню кількість кристалів розчинної речовини, то процес розчинення через деякий час припиниться і встановиться динамічна рівновага між розчином, що утворився, і твердою фазою, яка не розчинилася. Такий розчин називають насиченим, а його концентрацію — розчинністю. Розчин, концентрація якого менша від рівноважної, називають ненасиченим, а більша—перенасиченим. Як ненасичені, так і насичені розчини перебувають у сталому стані і можуть зберігатись у незмінному вигляді необмежений час. При цьому в насиченому розчині міститься стала максимально можлива за даних умов кількість розчиненої речовини. На відміну від них, перенасичений розчин нестійкий. Надлишкова (порівняно з рівноважною) кількість розчиненої речовини в ньому може випасти в осад у вигляді кристалів, і розчин перетвориться на насичений. Отже, процес кристалізації — це перехід несталого перенасиченого розчину в сталий насичений. Перевищення концентрації перенасиченого розчину С над Розчинністю Co називають перенасиченням (П=С – Со), а їх відношення — коефіцієнтом перенасичення а=С/Со Розчинність Со що характеризує стан динамічної рівноваги між кристалами і розчином, залежить від властивостей системи, температури і наявності домішок.
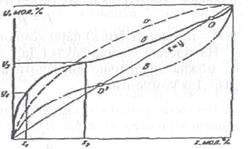
Перегонка і ректифікація За допомогою процесу перегонки багатокомпонентну рідку суміш розподіляють на фракції, що містять компоненти суміші в концентрованому вигляді. Ректифікацією називають процес багатократної перегонки, за допомогою якого з рідкої суміші вилучають незначні кількості небажаних домішок. Переганяють і ректифікують суміші, що складаються з компонентів, які відрізняються своєю леткістю. Під час випаровування рідкої суміші окремі компоненти переходять у пароподібний стан інтенсивніше, завдяки чому їх вміст у паровій фазі більший, ніж у рідкій. Діаграми рівноваги. Якщо на горизонтальній осі х координат відкладати вміст компонента А від 0 до 100% в бінарній рідкій суміші А + В, а на вертикальній осі у — вміст цього компонента в паровій фазі, що утворюється під час кипіння рідкої суміші різного складу, то одержаний графік і буде діаграмою, або кривою рівноваги. За допомогою цієї кривої визначають вміст компонента А (а отже, і компонента В) у рідкій і паровій фазах, що перебувають у рівновазі. На осях координат кривих рівноваги відкладають вміст легколеткого компонента, позначаючи його в рідкій фазі через х, а у паровій — через у. Відношення х до у для будь-якої точки кривої рівноваги називають коефіцієнтом випаровування А = у/х. Графік характерних кривих рівноваги для різних бінарних сумішей подано на рис. 4.32. Крива а відповідає суміші, в якій знаходиться легко-леткий незалежно від складу суміші компоненті, вміст якого в фазах відкладено на осях х і у. Коефіцієнт випаровування його завжди більший від одиниці
Крива б відповідає суміші, в якій компонент А до певної концентрації його в суміші легколеткий (цю концентрацію позначають точкою О), а при вищій концентрації—важколегкий (к < 1). Точку О, так само, як і відповідну їй суміш називають азеотропними (для азеотропної суміші (к = 1). Криві рівноваги широко використовують у розрахунках процесів перегонки бінарних сумішей. Розраховуючи процеси ректифікації, користуються величинами коефіцієнтів А випаровування домішок — відношенням вмісту домішки у паровій фазі до її вмісту в рідкій за умов рівноваги. При незначному вмісті домішки її коефіцієнт випаровування залежить від вмісту двох інших компонентів у рідкій суміші і не залежить від вмісту в суміші самої домішки. Криві коефіцієнтів випаровування для характерних домішок, що супроводжують суміші етилового спирту з водою, подано на рис. 4.33.
Рис. 4.32. Криві рівноваги різних бінарних сумішей
Рис. 4.33. Криві коефіцієнтів випаровування домішок етилового спірту: 1 — діетиловий спирт; 2 — ацетальдегід; 3 — метилацетат; 4 — н.маслянип альдегід; 5 — етилацетат; 6 — метанол Класифікація сумішей. У бінарних сумішах виділяють їх основні групи: ідеальні, реальні, взаємно нерозчинних рідин і обмежено взаємно розчинних рідин. Ідеальні суміші підлягають законам Рауля і Дальтона. За законами Рауля, парціальний тиск р компонента над сумішшю пропорційний його молярній частці в ній х. Для компонента А
Де За законом Дальтона, загальний тиск пари над сумішшю дорівнює сумі парціальних тисків її компонентів
Де На підставі законів Рауля і Дальтона, знаючи склад рідкої фази, можна аналітично визначити вміст компонентів у паровій фазі. Для компонента
Характерну форму кривої рівноваги для ідеальної суміші було показано на рис. 4.32 (крива а). Реальні суміші не підлягають закону Рауля. Діаграми х -у для таких сумішей будують за експериментальними даними. Типовою реальною сумішшю є суміш етилового спирту з водою (крива б на рис. 4.32). Відхилення від закону Рауля в реальних сумішах призводить до того, що при незмінній температурі певному складу суміші може відповідати певний тиск пари над сумішшю Суміші взаємно нерозчинних рідин відрізняються тим, що тиск пари над сумішшю дорівнює сумі пружностей пари компонентів. Через це температури кипіння таких сумішей завжди нижчі від температур кипіння окремих компонентів за цього ж зовнішнього тиску. Суміші обмежено розчинних одна в одній рідин відрізняються тим, що у певних пропорціях вони взаєморозчинні і поводять себе як ідеальні або реальні суміші. У випадку порушення вказаних пропорцій утворюються дві взаємно нерозчинні рідкі фази: розчин і компонент, що є у надлишку. Одноразовим випаровуванням (простою перегонкою) вихідну суміш можна розділити на кілька фракцій, частина з яких міститиме більшу кількість легколеткого, ніж його було у вихідній суміші, інша частина — меншу. Якщо випаровувати суміш (криву рівноваги її зображено лінією б на рис. 4.32, що містить після відведення і конденсації пари, яка утвориться, одержимо рідину (дистилят) з вування вихідної суміші вміст легколеткого компонента в ній, так само як і у дистиляті, поступово зменшуватиметься. Нехай кінцевий вміст його у випаровуваній рідині буде
Відводячи дистилят у міру зміни вмісту в ньому легколеткого компонента в різні ємності, можна одержати фракції з різними значеннями у. Дефлегмація. Якщо пару, що утворюється при одноразовому випаровуванні суміші, частково конденсувати у спеціальному теплообміннику, то у першу чергу конденсуватиметься важко-киплячий компонент. Лишок пари на виході з теплообмінника міститиме більше легколеткого компонента, ніж пара на вході в теплообмінник. Концентрація легколеткого кохмпонента в парі зростатиме за рахунок її часткової конденсації (так званої дефлегмації). Конденсат, що утворюється в теплообміннику, називають флегмою, а теплообмінник — дефлегматором. Спрямовуючи решту пари, що лишилась після дефлегмації, в конденсатор, одержують дистилят, вміст легколеткого компонента в якому більший, ніж у дистиляті, що його одержують простою перегонкою тієї самої суміші без дефлегмації. Принципи безперервної перегонки в апаратах сучасного типу. У сучасних колонних апаратах для перегонки (рис. 4.34) між дефлегматором і випарником є пристрій для контакту флегми з парою, яка йде з випарника. Оскільки при частковій конденсації пари в дефлегматорі / флегма завжди містить більше легколеткого компонента, ніж початкова суміш, то між парою, що піднімається з випарника, і флегмою відбувається масообмін. При цьому легколеткий компонент переходить з рідкої в парову фазу, а важколеткий — у зворотному напрямку, тобто система наближається до стану фазової рівноваги. Завдяки процесу масо-
обміну пара надходить у дефлегматор збагаченою легколетким компонентом. Дистилят і флегма також збагачуються ним, а отже, підвищується вміст легколеткого компонента у парі, що надходить у дефлегматор, і т.д. Дистилят і флегма містять тим більше легколеткого компонента, чим більша площа і кращі умови контакту між парою і флегмою. У дефлегматорі можна конденсувати всю пару, яка в нього надходить, розділяючи потім конденсат на флегму і дистилят. У цьому випадку в дефлегматорі не спостерігатиметься ефекту дефлегмації — підвищення вмісту легколеткого компонента у парі за рахунок її часткової конденсації, хоча збережеться основний процес масообміну на контактних пристроях, який супроводжується переходом легколеткого компонента з флегми у парову фазу. У колонному апараті початкову сумішМ можна безперервно подавати в нижню 4 (кубову) частину апарата, а кубовий залишок К безперервно відводити. Це так звана концентраційна колона 3. В ній можна одержувати дистилят зі значним вмістом легколеткого компонента, хоча частина його потрапляє і в кубовий залишок. Щоб уникнути цього, апарати для перегонки обладнують так званою витяжною частиною, яка знаходиться нижче від точки введення вихідної суміші. Щоб забезпечити добрий контакт пари з флегмою і початковою сумішшю, апарати обладнують спеціальними контактними пристроями. На рис. 4.34, б зображено колонний апарат для перегонки з концентраційною З і видобувною 2 частинами, обладнаний так званим тарілчастими контактними пристроями 5 (тарілками). Початкова суміш, стікаючи разом з флегмою у кубкову частину 1, звільняється від легколеткого компонента за допомогою пари, що піднімається з кубової частини апарата, внаслідок чого кубовий залишок містить мінімальну кількість легколеткого компонента. У концентраційній частині пара, перебуваючи у контакті з флегмою, поступово рухаючись від тарілки живлення дефлегматора 4, збагачується лег-Іколетким компонентом і після дефлегмації і остаточної конденсації перетворюється на висококонцентрований дистилят. Сорбція Сорбцією називається процес поглинання певним тілом газів, пари або розчинених речовин з навколишнього середовища. Тіло, що поглинає речовину, називають сорбентом. Типові для сорбції процеси — абсорбція і адсорбція. Абсорбція — поглинання речовини, що супроводжується наступною її дифузією в глибину тіла і утворенням розчину. Поглинаючу речовину у цьому процесі називають абсорбентом. Нею звичайно є рідина. Адсорбція — це поглинання речовини поверхнею твердого поглинача — адсорбента. Якщо під час сорбції відбувається хімічна взаємодія між речовиною, що поглинається, і сорбентом, то такий процес називають хемосорбцією. Якщо ж поглинання супроводжується конденсацією пари в порах поглинача, таке явище називають молекулярною конденсацією. Процес сорбції зворотний. Виділення речовин під час зворотного процесу називають десорбцією. Сорбційні процеси дуже поширені у виробництві спирту, цукру, крохмалю, вина, ядерного палива. Абсорбцію застосовують у виробництві цукру (для очищання соку і сиропу), крохмалю (для одержання екстрагенту—розчину сірчистої кислоти), у консервному виробництві (для одержання розчинів, що забезпечують зберігання плодів і овочів), вина, спирту та інших продуктів. В усіх зазначених випадках абсорбентом є вода. У процесі абсорбції беруть участь дві фази: газоподібна — суміш компонента, який поглинається, з інертним носієм і рідка — абсорбент, що вибірково поглинає компонент, який переходить у рідкий розчин. До границі розділення фаз і від границі розділення вглиб абсорбента речовина, що поглинається, переноситься за допомогою конвективної дифузії, оскільки за виробничих умов обидві фази звичайно рухливі. Підвищення швидкості руху фаз збільшує швидкість перенесення речовини у кожній з фаз, внаслідок чого зростає загальна швидкість абсорбції. Швидкість абсорбції прямо пропорційна також площі контакту фаз і тиску, оскільки із зростанням тиску розчинність газів у рідині також зростає. Підвищення температури знижує швидкість абсорбції, оскільки погіршується розчинність газів у рідині. Рівновага в процесі абсорбції. Рушійною силою процесу абсорбції є різниця концентрацій речовин, що поглинається, у газі у і в розчині х. Процес припиниться, якщо концентрації зрівноважаться або коли парціальний тиск газу, шо поглинається, нал розчином досягне значення рівноважного Основним законом, що характеризує рівновагу в системі газ-рідина, є закон Генрі, за яким при незмінній температурі розчинність газу в рідині прямо пропорційна парціальному тиску р цього газу над розчином
Де х — концентрація в абсорбенті газу, що поглинається, кмолъ/кмолъ;
Парціальний тиск газу в суміші виражається залежністю
де у— концентрація в газовій суміші газу, що поглинається, кмолъ/кмолъ; Р — загальний тиск у суміші. З рівнянь (4.46) і (4.47) витікає
Де
Рис. 4.35. Крива абсорбційної рівноваги
Рис. 4.36. Схема протитечійного абчорбційного апарата У загальному випадку залежність між концентраціями у і х кривою рівноваги. Будують її за звичай за експериментальними даними. Матеріальний баланс абсорбції. У разі безперервного процесу в апараті, протитечія створює найбільшу середню рушійну силу (рис. 4.35). Концентрація в газі компонента, що поглинається, змінюється від Витрати інертного газу G і абсорбента L (кмоль/с) у процесі не змінюються. Якщо під час абсорбції не втрачається і речовина, яку поглинають, то кількість цієї речовини, що входить в абсорбер з газом
або
З рівняння (4.49) витікає
(4.49) Абсорцію здійснюють в насадочних та тарілчастих колонах. Тарілчасті колони дорожчі від насадочних, гідравлічний опір в них вищий, а ефективність розподілу вища. У більшості процесів всіх технологій має місце адсорбція з розчинів. Наприклад, у цукровому, лікеро-горілчаному, спиртовому, крохмале-патоковому виробництвах адсорбцію використовують для очищення і знебарвлювання продуктів або для очищання води, що надходить у виробництво, або вже використаної. У спиртовому і лікеро-горілчаному виробництвах адсорбцію застосовують для уловлювання пари і зменшення її витрат. Адсорбція розподіляється на фізичну, хемосорбцію, капілярну конденсацію. Загальним для всіх видів адсорбції лишається те, що її зумовлюють сили тяжіння між атомами і молекулами. Кількість речовини, поглинутої масовою або об'ємною одиницею поглинача залежить від природи його і речовини, яка поглинається, її концентрації в парогазовій суміші або розчині, що оточують адсорбент, температури і, в разі поглинання з газоподібного середовища, тиску. Процес адсорбції, як і будь-який інший масообмінний процес, перебігає в напрямі встановлення рівноваги між фазами. При незмінній температурі для даної пари адсорбент-адсорбтив за рівноважних умов має місце точно визначена залежність концен- трації адсорбтиву в адсорбенті ньому газі (розчині) С
Цю залежність, що виражає статику процесу, називають рівнянням ізотерми адсорбції. У найзагальнішому випадку рівноважна концентрація тим вища, чим більшими будуть молекулярна маса газу, що поглинається, тиск у парогазовій фазі і нижчою температура. У процесі адсорбції звичайно виділяється значна кількість теплоти, і, якщо її не відводити, температура шару адсорбента підвищиться, що негативно позначиться на його активності. Процес адсорбції зворотний. У виробничих умовах зворотний процес (десорбція) нерозривно зв'язаний з прямим процесом. Процесу десорбції активно сприяє підвищення температури і зниження тиску в середовищі, що оточує адсорбент. До адсорбентів промислових адсорберів належать: активоване вугілля (деревне, кам'яне, кісткове), силікагель, алюмогель, цеоліти, глини. Активоване вугілля одержують в результаті сухої перегонки відповідної сировини (деревини, тирси, кісточок з фруктів, кісток тварин відходів шкіри та інших матеріалів) з наступним вилученням смолистих речовин з шпар цих речовин. Питома поверхня активованого вугілля (600...700) гляді гранул розміром (1...7) мм або порошків з частинок розміром (25... 250) мкм. Силікагель (зневоджений гель кремнієвої кислоти) відрізняється від активованого вугілля однорідністю шпар рівномірним їх розподілом по об'єму частинки і здатністю витримувати високі температури. Питома поверхня його (300...750) Розміри зерен — (0,2...7) мм. Алюмогель (суміш нормального гідрату окису алюмінію з полігідратами) широко використовують для висушування газів, питома поверхня його (200...600) Глини (інфузорна земля, трепел) із меншою питомою поверхнею шпар, ніж в усіх згаданих раніше матеріалів — (200...400) Проте через низьку вартість і значне поширення в природі знаходять застосування в промисловості. Матеріальний баланс процесу адсорбції виражають рівнянням, аналогічним рівнянню (4.49) для процесу абсорбції, оскільки в обох процесах можна вважати незмінними кількості інертного газу G у кожній фазі, а також не рахуватися з втратами розподіленої в фазах речовини, що поглинається. Кінетика процесу адсорбції також має багато спільного з процесом екстракції в системі "тверде тіло — рідина". Процес складається з двох основних стадій: перенесення речовини всередині твердого тіла за законами молекулярної дифузії і масообміну на поверхні твердого тіла за законами конвективної дифузії. Процес адсорбції у промислових умовах може відбуватись періодично і безперервно. У першому випадку зернистий шар адсорбенту нерухомий, а газоподібна (рідка) фаза з речовиною, яку треба поглинати, фільтрується крізь шар. На початку процесу ад-сорбтив поглинається першими за рухом суцільного середовища шарами адсорбента. На певній висоті шару концентрація речовини, що поглинається, в газі впаде практично до нуля, потім фронт руху газу, на якому концентрація переходить від істотно більшої від нуля до нульової, буде повільно просуватися по висоті шару. Слідом за цим шаром, на певній відстані від нього, рухатиметься фронт суцільного середовища з концентрацією адсорбтива, що дорівнює початковій Со а весь шар адсорбента за цим фронтом оуде повністю насиченим і не поглинатиме більше адсорбтива. Щоб процес адсорбції відбувався безперервно, адсорбент повинен рухатись назустріч потоку газу (рідини). Це можливо у тому випадку, коли частинки адсорбента після їх повного насичення безперервно регенеруватимуться, охолоджуватимуться, а потім знову надходитимуть у робочу ділянку шару, де відбувається процес адсорбції. Екстрагування Екстрагуванням називають вилучення з твердої або рідкої складної речовини одного чи кількох її компонентів за допомогою розчинника з вибірковою розчинністю. Під вибірковою розчинністю розуміють здатність рідини розчиняти лише той компонент (компоненти), які треба добути. У процесі екстракції, як і в інших масообмінних процесах, беруть участь три речовини (дві розподіляючі і третя розподіляєма): перша, з якої добувають цільовий компонент; друга (розчинник), за допомогою якої добувають цільовий компонент (компоненти), так званий екстрагент; третя, яка переходить з одної фази в другу, так звана екстрагована речовина. Апарат, в якому відбувається екстракція, називають екстрактором. Залежно від фазового стану першої розподільної речовини процес поділяють на: екстракцію в системі "тверде тіло — рідина", коли ця перша розподільна речовина тверде тіло, і екстракцію в системі "рідина — рідина", коли вона рідка. У технології мають місце обидва види екстракції, проте значного поширення набула екстракція в системі "тверде тіло — рідина". В ряді виробництв екстракція є одним з основних технологічних процесів. Це добування цукру з буряків, олії з насіння соняшників, бавовнику, сої, ефірної олії, екстрагування ферментів з культур плісеневих грибів. Важливу роль процес екстракції в системі тверде тіло — рідина відіграє у виробництві вина, пива, крохмалю, лікеро-горілчаних виробів, розчинної кави і чаю. Рідинну екстракцію застосовують у виробництвах, пов'язаних з одержанням спирту, вина, олії, бензолу, ацетону, оцтової кислоти, тощо. У найзагальнішому вигляді процес екстракції складається з чотирьох стадій: 1) проникнення розчинника в шпари частинок рослинної сировини; 2) розчинення цільового компонента (компонентів); 3) перенесення екстрагованої речовини всередині частинки сировини до поверхні поділу фаз; 4) перенесення екстрагованої речовини в рідкій фазі від поверхні поділу фаз і розподіл її у всій масі екстрагенту. Під час екстрагування розчинних речовин з тканини сировини звичайно не всі чотири стадії
|
||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 418; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.233.198 (0.016 с.) |

 і
і  — маси вологого матеріалу до і після сушіння, кг/год, a
— маси вологого матеріалу до і після сушіння, кг/год, a  і
і  — вологості матеріалу до і після сушіння, % до загальної маси, то баланс за сухою речовиною буде
— вологості матеріалу до і після сушіння, % до загальної маси, то баланс за сухою речовиною буде (4.37)
(4.37) (4.38)
(4.38) (4.39)
(4.39) , (4.40)
, (4.40)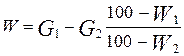 або
або


 (4.41)
(4.41) і в навколишньому середовищі
і в навколишньому середовищі  , є рушійною силою процесу переходу вологи з поверхневої плівки в навколишнє середовище
, є рушійною силою процесу переходу вологи з поверхневої плівки в навколишнє середовище 
 (4.42)
(4.42) — тривалість процесу.
— тривалість процесу. в таблицях для насиченої водяної пари знаходять його тиск при насиченні
в таблицях для насиченої водяної пари знаходять його тиск при насиченні  . Розраховують вологовміст х при відомій відносності повітря
. Розраховують вологовміст х при відомій відносності повітря  . Знаходять ентальпію водяної пари
. Знаходять ентальпію водяної пари  , а потім — ентальпію повітря
, а потім — ентальпію повітря  .
. і відносну вологість
і відносну вологість  . Ці параметри вибирають, виходячи з умов технології сушіння конкретного матеріалу.
. Ці параметри вибирають, виходячи з умов технології сушіння конкретного матеріалу. і відносну вологість
і відносну вологість 
 i
i  підставляють у відповідні рівняння. У результаті обчислень має бути тотожність. Якщо її немає, треба вибрати нові значення для
підставляють у відповідні рівняння. У результаті обчислень має бути тотожність. Якщо її немає, треба вибрати нові значення для  та ентальпію
та ентальпію  = const до перетину кривої заданої температури повітря на виході з сушарки з ізотермою
= const до перетину кривої заданої температури повітря на виході з сушарки з ізотермою  і ентальпії
і ентальпії 
 кДж/кг вологи;
кДж/кг вологи;
 °)
°)

 (4.43)
(4.43) —пружність (тиск) пари компонента А.
—пружність (тиск) пари компонента А. , (4.44)
, (4.44) —пружність (тиск) пари компонента В.
—пружність (тиск) пари компонента В. (4.45)
(4.45) більший (або менший), ніж пружність пари за цієї температури будь-якого з компонентів, узятих у чистому вигляді. Природно, що максимуму (мінімуму) на кривій тисків відповідає мінімум (максимум) на кривій температур (крива тисків—це функція тиску пари над сумішшю від її складу, а крива температур — це функція температури кипіння суміші від її складу).
більший (або менший), ніж пружність пари за цієї температури будь-якого з компонентів, узятих у чистому вигляді. Природно, що максимуму (мінімуму) на кривій тисків відповідає мінімум (максимум) на кривій температур (крива тисків—це функція тиску пари над сумішшю від її складу, а крива температур — це функція температури кипіння суміші від її складу). % пегколеткого компонента. У міру випаро-
% пегколеткого компонента. У міру випаро- що відповідає дистиляту
що відповідає дистиляту  У результаті вихідна суміш буде поділеною на дві фракції з легколеткими компонентами
У результаті вихідна суміш буде поділеною на дві фракції з легколеткими компонентами
 .
. (4.46)
(4.46) — коефіцієнт пропорційності (за Генрі).
— коефіцієнт пропорційності (за Генрі). (4.47)
(4.47) (4.48)
(4.48) — константа фазової рівноваги.
— константа фазової рівноваги.

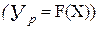 графічно виражається кривою лінією (4), яку називають
графічно виражається кривою лінією (4), яку називають а у рідкій фазі—від
а у рідкій фазі—від  кмоль/кмоль.
кмоль/кмоль.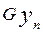 і абсорбентом
і абсорбентом дорівнюватиме кількості речовини, яка виходить з апарата з газом
дорівнюватиме кількості речовини, яка виходить з апарата з газом і абсорбентом
і абсорбентом 
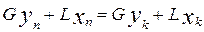
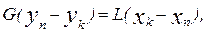 (4.49)
(4.49)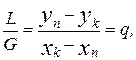
 від концентрації в навколиш-
від концентрації в навколиш-
 використовують його у ви-
використовують його у ви-


