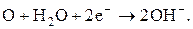Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основні відомості про види корозіїСодержание книги Поиск на нашем сайте
Корозією називається руйнування металів і сплавів у результаті хімічної та електрохімічної дії навколишнього середовища. Хімічна корозія відбувається при дії на метал сухих газів і рідких неелектролітів (бензин, масло тощо). Прикладом хімічної корозії може бути утворення окалини при нагріванні сталі. Електрохімічна корозія виникає при дії на метал рідких електролітів — водних розчинів солей, кислот, лугів, а також вологого ґрунту та повітря, коли в присутності іонів виникає тонкий шар електроліту. Процес електрохімічної корозії умовно показано на рис. 14.1. Якщо два метали з різними електродними потенціалами з'єднати провідником і занурити в електроліт, то утворюється гальванічний елемент і атоми металу з більш від'ємним потенціалом (анод) будуть переходити в розчин у вигляді іонів Ме+. Електрони е- з анода по зовнішньому колу будуть перетікати на катод.
Рисунок 14.1 - Схема електрохімічної корозії Якщо електрони не відводяться з катода і накопичуватимуться на ньому, то подальше розчинення металу на аноді стане неможливим. Виникає поляризація катода, яка істотно загальмовує корозію. Але в електроліті поряд із катодом завжди є іони водню Н+ або молекули кисню О2. Іони водню приєднують електрони з катода і переходять спочатку в атомарний, а потім у молекулярний стан, виділяючись на катоді у вигляді бульбашок газу:
Виникає воднева деполяризація. Коли в електроді утворюється кисень (атмосферна корозія), він у присутності води також приєднує електрони з катода та утворює іони гідроксиду
Це киснева деполяризація. Оскільки технічні метали й особливо сплави мають гетерогенну структуру, їх поверхня в електроліті складається з безлічі маленьких, коротко замкнених через метал гальванічних пар (мікроелементів). Різні ділянки поверхні сплаву мають різні потенціали. При цьому анодні ділянки з більш від'ємними потенціалами руйнуються. Для оцінки корозійної активності далі наведені стандартні електродні потенціали деяких металів:
Електрохімічна корозія — найрозповсюдженіший вид руйнування металів і сплавів. За однофазної структури корозія рівномірна, а в неоднорідних сплавах вона має місцевий характер (точкова, плямова, виразкова та ін.). Осередок місцевої корозії — концентратори напружень. Особливо небезпечна міжкристалічна корозія, що розповсюджується в глибину металу по межах зерен і порушує зв'язок між зернами. До несподіваних руйнувань або до утворення тріщин призводить також корозія під напруженням. Захист від корозії заснований на гальмівних анодних і катодних процесах. У першому випадку використовують явище пасивації, що виникає при утворенні тонких міцних оксидних плівок на металі. Наприклад, сталь пасивується введенням у неї не менше як 13% хрому. Катодні процеси можуть загальмовуватись уведенням у замкнуте корозійне середовище інгібіторів корозії. Для захисту від корозії широко використовують металічні й неметалічні покриття. Перші можуть бути катодними чи анодними. Катодні покриття, наприклад олов'яні на сталі, у випадку порушення їх суцільності можуть прискорювати процес корозії металу, що захищається. Анодні покриття (цинкові на сталі), навпаки, виконують електрохімічний захист виробу навіть за їх відсутності на окремих ділянках поверхні. Катодний захист полягає в приєднанні до конструкції, що захищається, анода — протектора з більш від'ємним потенціалом. Цей вид захисту використовується для металоконструкцій, які працюють у морській воді або під землею. Як анод при захисті металевих виробів застосовують сплави магнію, цинку або алюмінію. Знижують швидкість корозії всі фактори, що зменшують хімічну і структурну неоднорідність сплаву й підвищують його термодинамічну стійкість. Тому сплави в однорідному стані стійкіші, ніж багатофазні. Для оцінки протікання корозії металів і сплавів використовують різні методи досліджень. Швидкість корозії, яка вимірюється в грамах на метр квадратний за годину, визначають ваговим або об'ємним методами. У першому випадку зразки зважують до й після досліджень на корозію, а в другому — визначають об'єм водню, що виділився за обумовлений час корозії зразка. Оскільки цей об'єм пропорційний масі розчиненого металу, то за реакцією можна розрахувати швидкість корозії. Наприклад, при корозії з водневою деполяризацією виділенням 1 мл водню відповідає розчиненню 0,79 мг алюмінію або 1,08 мг магнію. Схильність сплавів до міжкристалічної корозії визначають випробуванням зразків у відповідних електролітах до наступного аналізу мікрошліфів із цих зразків. Корозійне розтріскування оцінюють за часом до руйнування зразків під дією електролітів і розтягуючих напружень. Аналогічно за кількістю циклів до руйнування визначають корозійну втомленість. Швидкість корозії за об'ємом виділеного водню визначають за допомогою простого приладу (рис. 14.2), який складається з перевернутої градуйованої бюретки 1, встановленої на штативі 2. Нижня частина бюретки закінчується воронкою 3 з гачком 4 для закріплення зразка 5. Під воронку ставлять склянку 6 з корозійним середовищем. Після відкриття крана 7 у бюретку подається корозійна рідина до нульової поділки. Об'єм водню, що виділився за певний час, вимірюється за поділками бюретки. Порядок виконання роботи Студенти діляться на ланки, кожна з яких одержує прилад, корозійне середовище і зразок. Отримавши завдання, студенті повинні: 1) підготувати зразки для дослідження: зачистити їх поверхні наждачним папером, визначити розміри, знежирити спиртом і закріпити на нитці всередині воронки; 2) установити склянку з електролітом на основу штатива та глибоко занурити в розчин воронку приладу; 3) відкрити кран бюретки 1, доповнивши електролітом до нульової поділки бюретки, закрити його. З цього моменту через певні проміжки часу (наприклад, через 5 хв) почати відраховувати об'єм виділеного водню. Результати вимірювань занести до табл. 14.1; 4) за отриманими даними побудувати графіки залежності об'єму водню від часу і розрахувати швидкість корозії; 5) зробити висновки за виконаною роботою.
Рисунок 14.2 - Схема приладу для дослідження корозії сплавів Таблиця 14.1 - Об’єм виділеного водню, см3
Запитання для самоперевірки 1. Сутність корозії металів. 2. Чим відрізняється електрохімічна корозія від хімічної? 3. Схарактеризуйте механізм електрохімічної корозії. 4. Види корозії за характером руйнування та за умовами процесу. 5. Укажіть причини міжкристалічної корозії. 6. Дайте визначення швидкості корозії та опишіть методику її визначення. 7. Схарактеризуйте сутність об'ємного методу визначення корозії. 8. Основні методи корозійних досліджень. 9. Основні способи захисту металів від корозії. Література: [1, с. 291; 3, с. 196; 4, с. 259]. Література 1. Лахтин Ю.М., Леонтьева В.П. Материаловедение. – М.: Машино-строение, 1990. - 528 с. 2. Материаловедение / Под общ. ред. Б.Н. Арзамасова. - М.: Машино-строение, 1986. - 384 с. 3. Геллер Ю.А., Рахштадт А.Г. Метария. - М.: Металлургия, 1989. - 488 с. 4. Масленников Ф.И. Лабораторный практикум по металловедению. - М.: Машгиз, 1961. - 258 с.
|
||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 258; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.12.133 (0.008 с.) |