
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: Методи добування та хімічні властивості алканівСодержание книги
Поиск на нашем сайте Техніка безпеки 1. Дослід 2 виконувати у витяжній шафі в захисних окулярах при опущеному захисному склі. 2. При попаданні фільтрату (дослід 2) на шкіру, уражене місце промити великою кількістю води та нейтралізувати 1 %-им розчином оцтової кислоти, оскільки фільт-рат має лужне середовище. Контрольні запитання та завдання
1. Які елементи входять до складу більшості органічних речовин? 2. На яких реакціях грунтується якісний аналіз органічних речовин? 3. Як визначають карбон та гідроген в органічних сполуках? 4. Як визначають сірку в органічних сполуках? 5. Як визначають нітроген в органічних сполуках? 6. Як визначають галогени в органічних сполуках?
Лабораторна робота №2
Тема: Методи добування та хімічні властивості алканів Мета роботи: Вивчити методи добування та хімічні властивості алканів, провести відповідні досліди. Тривалість виконання: 4 год.
Теоретична частина
Насичені вуглеводні (алкани) об’єднані в гомологічний ряд загальної формули СnH2n+2, містять sp3-гібридизований атом карбону. Усі ковалентні зв’язки у алканах – σ-зв’язки. Алкани мало реакційноздатні сполуки, вступають в реакції заміщення гідрогену та реакції розщеплення молекули з руйнуванням С–С-зв’язків. Для алканів найхарактерніші реакції замі-щення, що відбуваються за радикальним ланцюговим механізмом (гало-генування, нітрування, сульфохлорування та ін.). Для проходженя цих реакцій потрібно опромінення або нагрівання. Не всі реакції заміщення є селективними. Наприклад, бромування відбувається селективно, а при хлоруванні утворюється суміш усіх можливих продуктів заміщення. Алкани окиснюються важко, як правило, при високих температурах. Це екзотермічний і малокерований процес, тому окиснення проводять киснем повітря при невисоких температурах (150 оС) при наявності каталізатора, утворюються гідропероксиди і продукти подальшого їх розкладу. Розчини перманганату калію алкани не окиснюють. Слід пам’ятати, що суміш метану з повітрям у співвідношенні 1:10 вибухонебезпечна. Алкани поширені серед природних сполук (нафта, газ та ін.), тому основні промислові методи добування алканів – це виділення у вигляді сумішей. Лабораторні методи добування алканів (реакція Вюрца, електроліз солей карбонових кислот (реакція Кольбе), декарбоксилювання карбонових кислот, гідрування алкенів та ін.) дозволяють отримати індивідуальні алкани [1, с.203-228]. Експериментальна частина
Дослід 1. Добування метану (Дослід проводити у витяжній шафі в захисних окулярах при опущеному захисному склі.) Для проведення досліду збирають прилад, який зображений на рис.2. Пробірку 1 на 1/5 заповнюють сумішшю, яка складається з однієї частини безводного ацетату натрію та двох частин твердого лугу. Далі пробірку за-
Спостереження:
Рівняння реакції:
Дослід 2. Відношення газоподібних алканів до бромної води Газ, який виділяється у досліді 1, пропускають у пробірку з бромною водою.
Спостереження:
Дослід 3. Відношення газоподібних алканів до розчину перман-ганату калію Газ, який виділяється у досліді 1, пропускають у пробірку з 0,5 %-им розчином перманганату калію.
Спостереження: Дослід 4. Відношення рідких алканів до бромної води До 2 мл розчину бромної води додають 1 мл рідкого алкану (наприк-лад, гексану) суміш енергійно струшують.
Спостереження:
Дослід 5. Відношення рідких алканів до розчину перманганату калію До 2 мл 0,5%-го розчину перманганату калію додають 1 мл рідкого насиченого вуглеводню (наприклад, гексану), суміш енергійно струшують.
Спостереження:
Дослід 6. Взаємодія метану з киснем Товстостінну пляшку об’ємом 250 мл заповнюють із газометрів методом витіснення сумішшю рівних кількостей метану та кисню. Пляшку обгортають рушником і закривають корком. Перевертають пляшку в горизонтальне положення, відкривають корок і підносять до отвору палаючу скіпку.
Спостереження:
Рівняння реакції:
Висновок:
Техніка безпеки
1. Дослід з твердим лугом проводити у витяжній шафі в захисних окулярах при опу-щеному захисному склі. Твердий луг брати шпателем або пінцетом. При попаданні лугу на шкіру промити уражене місце великою кількістю води та нейтралізувати 1 %-им розчином оцтової кислоти 2. Досліди з бромною водою проводити у витяжній шафі. При попаданні бромної во-ди на шкіру уражене місце промити водним розчином аміаку. Після проведення дос-ліду реакційну суміш вилити у спеціальний посуд, що стоїть у витяжній шафі. 3. Дослід 6 виконує лаборант.
Контрольні запитання та завдання 1. Що таке sp3 – гібридизація? Яку гібридизацію мають атоми вуглецю в алканах? 2. Наведіть механізм взаємодії 2-метилпентану з бромом. 3. Запропонуйте методи добування 2,3-диметилгексану, застосовуючи реакції Вюрца, Кольбе, Дюма. 4. Які реакції характерні для насичених вуглеводнів? 5. Наведіть рівняння реакцій хлорування, нітрування, сульфохлорування алканів на прикладі 2-метилбутану. 6. Які продукти утворяться при дії оксигену на 2-метилбутан при температурі 150оС (у присутності каталізатора)?
Лабораторна робота №3
Теоретична частина
Алкени містять подвійний зв’язок, що складається із s- та p-зв’язків. Присутність у алкенах p-зв’язку зумовлює їх високу реакційну здатність у реакціях приєднання та окиснення. Реакції приєднання в залежності від умов можуть відбуватися за іонним та радикальним механізмами. Алкени легко окиснюються різними окисниками з утворенням різних продуктів окиснення: оксидів, гліколей, альдегідів та кетонів, карбонових кислот, ненасичених спиртів. Важливою реакцією алкенів є полімеризація, на основі якої отримують високомолекулярні сполуки. Алкени в лабораторії добувають дегідрогалогенуванням галогенопохідних та дегідратацією спиртів (реакції відщеплення). [1, с.229-253].
Експериментальна частина Дослід 1. Добування етилену. У пробірці готують 5-6 мл суміші, що складається з однієї частини етилового спирту та трьох частин концентрованої сірчаної кислоти, кидають шматочки невипаленої порцеляни (центри кипіння). Пробірку закривають пробкою з газовідвідною трубкою, закріплюють під невеликим
Дослід 2. Взаємодія етилену з бромною водою Газ, який виділяється в досліді 1, пропускають в окрему пробірку з бромною водою. Спостереження:
Рівняння реакції: Дослід 3. Взаємодія етилену з розчином перманганату калію Газ, який виділяється в досліді 1, пропускають в окрему пробірку з 0,5 %-им розчином перманганату калію.
Спостереження:
Рівняння реакції:
Дослід 4. Відношення рідких ненасичених вуглеводнів до бромної води До 2-3 мл бромної води додають 2 мл рідкого ненасиченого вуглево-дню, суміш енергійно струшують.
Спостереження:
Рівняння реакції:
Дослід 5. Відношення рідких ненасичених вуглеводнів до розчину перманганату калію До 1-2 мл розчину перманганату калію додають 1 мл рідкого ненаси-ченого вуглеводню, суміш енергійно струшують.
Спостереження:
Рівняння реакції:
Дослід 6. Горіння етилену Етилен із газометра збирають у циліндр. Зібраний етилен запалюють.
Спостереження:
Рівняння реакції:
Дослід 7. Полімеризація стирену У суху пробірку наливають 3-5 мл стирену (стиролу) і додають кілька кристаликів пероксиду бензоїлу, або 0,5 мл сірчаної кислоти. Нагрівають пробірку на водяній бані протягом 30-40 хвилин. Спостереження:
Рівняння реакції:
Дослід 8. Деполімеризація полістирену Пробірку з полістиреном закривають пробкою з газовідвідною труб-кою, і закріплюють у штативі (рис.4). Кінець газовідвідної трубки опуска-ють у суху пробірку, яку охолоджують в бані з холодною водою.
Спостереження:
Рівняння реакцій:
Висновок:
Техніка безпеки
1. Досліди проводити у захисних окулярах у витяжній шафі, опустивши захисне скло. 2. При попаданні сірчаної кислоти на шкіру уражене місце промити великою кількістю води і нейтралізувати 1%-им розчином гідрокарбонату натрію. 3. З бромною водою працювати тільки у витяжній шафі. При попаданні бромної води на шкіру обробити уражене місце розчином аміаку. Після проведення досліду суміш з пробірки вилити у спеціальний посуд, що знаходиться у витяжній шафі. 4. З пероксидом бензоїлу працювати в окулярах, у витяжній шафі. Речовину не пере-грівати, можливий розклад з вибухом. Суміш стирену та пероксиду бензоїлу нагрі-вати на водяній бані. 5. Дослід 6 виконує лаборант.
Контрольні запитання та завдання
1. Наведіть якісні реакції на подвійний зв’язок. 2 Наведіть методи добування етиленових вуглеводнів (на прикладі 2-бутену). 3. За яким правилом відбуваються реакції приєднання до несиметричних етиленових вуглеводнів (наприклад, до 2-метилпропену)? 4. Визначте структуру алкену, якщо при озонілізі він утворює ацетон та 2-метил-пропаналь? 5. Дайте визначення реакцій полімеризації. 6. Наведіть радикальний механізм реакцій полімеризації пропілену, стирену. Лабораторна робота №4
Теоретична частина
Алкіни містять потрійний зв’язок, який складається із одного σ- та двох p- зв’язків, що зумовлює їхню високу реакційну здатність. Для алкінів характерні реакції відновлення, окиснення, електрофільного та нуклеофільного приєднання. Атоми гідрогену біля карбону потрійного зв’язку легко заміщуються на метал (ацетилен є прикладом С-Н кислоти). Пояснюється це збільшенням електронегативності атома карбону в стані гібридизації sp. Алкіни в лабораторних умовах отримують із дигало-генопохідних або алкілуванням ацетилену. Ацетилен добувають із карбіду кальцію. [1, 268-280].
Експериментальна частина
Дослід 1. Добування ацетилену з карбіду кальцію Збирають прилад (рис.5), що складається з колби, насадки Вюрца і крапельної лійки. Відвідну трубку насадки Вюрца з’єднують з промивною склянкою.
Дослід 2. Приєднання брому до ацетилену В пробірку наливають бромну воду і пропускають ацетилен, отрима-ний в досліді 1.
Спостереження:
Рівняння реакції:
Дослід 3. Окиснення ацетилену Через розчин перманганату калію пропускають ацетилен, отриманий в досліді 1.
Спостереження:
Рівняння реакції:
Дослід 4. Утворення ацетиленіду срібла У пробірці готують 3-4 мл амонійного розчину гідроксиду срібла, додаючи по краплях розчин аміаку до 1 %-го розчину нітрату срібла. Через одержаний розчин пропускають ацетилен. Утворюється сірий осад ацети-леніду срібла. Його відфільтровують та висушують при нагріванні. Обережно! У сухому вигляді ацетиленід срібла вибухає від удару, при нагріванні. Спостереження:
Рівняння реакції:
Дослід 5. Утворення ацетиленіду міді Техніка безпеки
1. Всі досліди проводити у витяжній шафі. 2. При попаданні бромної води на шкіру уражене місце промити аміачним розчином. 3. Висушування ацетиленіду срібла проводити у захисних окулярах у витяжній шафі з опущеним захисним склом, оскільки висушений продукт вибухає.
Контрольні запитання та завдання
1. Запропонуйте метод добування пропіну із ацетилену. 2. За допомогою яких якісних реакцій можна відрізнити 1-бутин від 2-бутину? 3. За якими якісними реакціями можна відрізнити метилацетилен від метилетилену? Наведіть рівняння реакцій. 4. Наведіть рівняння реакцій взаємодії етилацетилену з воднем, бромом, амідом натрію, водою в умовах реакції Кучерова. 5. Які речовини утворюються при окисненні 1-пентину? Лабораторна робота № 5
Тема: Хімічні властивості алкілгалогенідів
Мета роботи: Вивчити хімічні властивості алкілгалогенідів, провести відповідні хімічні досліди. Тривалість виконання: 4 год.
Теоретична частина
Найважливішою властивістю алкілгалогенідів є рухливість атома га-логену, характерними реакціями для них є реакції нуклеофільного замі-щення (SN) та відщеплення (елімінування, Е). В залежності від будови галогенопохідного реакції заміщення можуть відбуватися за механізмом SN1 (третинні галогенопохідні) або SN2 (переважно первинні галогенопо-хідні). При гідролізі (реакція SN) дигалогенопохідних та тригалогенопо-хідних утворюються відповідно альдегіди (кетони) і кислоти. В реакціях елімінування відбувається відщеплення галогеноводнів (згідно правила Зайцева) і утворення відповідних алкенів [1, с.281-308].
Експериментальна частина
Дослід 1. Заміщення галогену на гідроксил дією лугу До 0,5 мл хлороформу в пробірці додають 2 мл 10 %-го розчину гідроксиду натрію та обережно нагрівають суміш до початку кипіння, безперервно збовтуючи. Суміш охолоджують, зливають частину водного шару в іншу пробірку. До злитого розчину додають азотної кислоти до кислої реакції та доливають кілька крапель розчину нітрату срібла. Спостереження:
Рівняння реакції:
Дослід 2. Дія спиртового розчину лугу на етилбромід (Дослід проводити у витяжній шафі!)
виділяється, пропускають в окремі пробірки з бромною водою та 0,5 %-им розчином перманганату калію (досліди 3 та 4). Спостереження:
Рівняння реакції:
Дослід 3. Взаємодія продукту реакції з бромною водою Газ, який виділяється в досліді 2 пропускають в пробірку з бромною водою. (Дослід проводити у витяжній шафі!) Спостереження:
Рівняння реакції:
Дослід 4. Взаємодія продукту реакції з розчином перманганату калію Газ, який виділяється в досліді 2, пропускають в пробірку з розчи-ном перманганату калію. Спостереження:
Рівняння реакції:
Дослід 5. Взаємодія продукту реакції з нітратом срібла Після припинення нагрівання пробірки в досліді 2 розчин в пробірці підкислюють азотною кислотою і додають краплю нітрату срібла.
Спостереження:
Рівняння реакції:
Висновок: Техніка безпеки
1. Нагрівати суміш хлороформу з розчином лугу потрібно безперевно струшуючи. Отвір пробірки направляти в бік від себе і студентів, які працюють поряд. 2. При попаданні розчину лугу на шкіру промити уражене місце великою кількістю води та нейтралізувати 1 %-им розчином оцтової кислоти. 4. При попаданні кислоти на шкіру уражене місце промити великою кількістю води та нейтралізувати 1 %-им розчином гідрокарбонату натрію. 3. Дослід з бромною водою проводити у витяжній шафі. При попаданні бромної води на шкіру промити уражене місце розчином аміаку. Контрольні запитання та завдання
1. Як одержати 2,2-дибромопропан із первинного пропілброміду? 2. Яка речовина утворюється при гідролізі 2,2-дибромопентану? 3. Як змінюється активність алкілгалогенідів зі збільшенням розгалуженості вуглецевого ланцюга? 4. Наведіть механізм взаємодії 2-бромо-2-метилбутану та 2-бромобутану з водним розчином NaOH. Лабораторна робота №6 Теоретична частина
Властивості спиртів пов’язані з наявністю в молекулі функціональ-ної групи - ОН. Спирти проявляють слабкокислотні властивості. Взаємо-дія етилового спирту з натрієм (дослід 2) підтверджує ці властивості. Цей дослід дає змогу зробити також висновок про те, що спирти є слабшими кислотами, ніж вода. Двохатомні та трьохатомні спирти є сильнішими кислотами і тому можуть утворювати солі з основами. Спирти окисню-ються до карбонільних сполук (первинні спирти можна окиснити до кис-лот). Для спиртів також характерні реакції нуклеофільного заміщення. Слід звернути увагу на те, що гідроксильна група заміщується тільки після протонування (через проміжне утворення оксонієвої солі). Для первинних спиртів реалізується механізм SN2, а для третинних - SN1. Утворення спир-тами оксонієвих солей свідчить про те, що спирти здатні проявляти також властивості основ. Спирти за рахунок неподіленої пари електронів атома оксигену групи ОН можуть бути нуклеофілами (прикладом такої реакцій-ної здатності є реакція естерифікації). [1, c.309-356].
Експериментальна частина
Дослід 1. Виявлення води у спирті У пробірку наливають 1 мл етилового спирту і додають декілька кристаликів безводного сульфату міді. Які відбуваються зміни?
Спостереження:
Рівняння реакції:
Дослід 2. Відношення спиртів до індикаторів У дві пробірки поміщають по 3 краплі води і додають в одну пробір-ку кілька краплин етилового спирту в іншу - ізоамілового. Перевіряють се-редовище за допомогою індикатора (універсальний індикатор, фенолфта-леїн). Спостереження:
Дослід 3. Утворення етилату натрію та його гідроліз У пробірку наливають 2 мл етанолу, додають шматочок очищеного металічного натрію і закривають пробкою з газовідвідною трубкою. Після повного розчинення металічного натрію утворений алкоголят розкладають водою. Додають у розчин фенолфталеїн і спостерігають за зміною кольору.
Спостереження:
Рівняння реакцій:
Дослід 4. Окиснення етанолу перманганатом калію Наливають в пробірку 1 мл етанолу, додають 1 мл розчину перман-ганату калію і нагрівають. Альдегід, що утворюється, розпізнають за ха-рактерним запахом.
Спостереження:
Рівняння реакції:
Дослід 5. Утворення гліколяту та гліцерату міді У три окремі пробірки наливають по 2 мл 10 %-го розчину лугу і додають кілька крапель розчину сульфату міді. Утворюється осад гідрок-сиду міді (II). До отриманого осаду додають в першу пробірку кілька кра-пель етилового спирту, в другу – етиленгліколю і в третю – гліцерину. Реакційну суміш в пробірках енергійно струшують.
Спостереження:
Рівняння реакцій:
Дослід 6. Утворення ізопентилацетату (ізоамілацетату) Змішують у пробірці 2 мл концентрованої оцтової кислоти, 2 мл ізоамілового спирту та 0,5 мл концентрованої сірчаної кислоти, кидають шматочки невипаленої порцеляни (центри кипіння). Суміш перемішують та обережно нагрівають, весь час струшуючи. Продукт реакції виливають у пробірку з холодною водою. Ізоамілацетат спливає на поверхню води, пахне грушевою есенцією.
Спостереження:
Рівняння реакції: Висновок:
Техніка безпеки
1. Для досліду 3 потрібно взяти суху пробірку (усі реагенти отримують у лаборанта). Додавати воду до реакційної суміші лише тоді, коли весь натрій прореагує. 2. При попаданні розчину лугу на шкіру уражене місце промити великою кількістю води та нейтралізувати 1 %-им розчином оцтової кислоти. 3. Нагрівати суміш оцтової кислоти, ізоамілового спирту та концентрованої сірчаної кислоти безперевно струшуючи. Отвір пробірки направляти в бік від себе і студен-тів, які працюють поряд. Після виконання цього досліду реакційну суміш з залишка-ми ізоамілацетату вилити у спеціально відведений посуд (в раковину не виливати)! 4. При попаданні кислоти на шкіру уражене місце промити великою кількістю води та нейтралізувати 1 %-им розчином гідрокарбонату натрію. Контрольні запитання та завдання
1. Отримайте за допомогою реакції Гріньяра пропіловий, ізобутиловий, трет. бути-ловий спирти. 2. Напишіть приклади реакцій естерифікації. Наведіть механізм реакції. 3. Охарактеризуйте хімічні властивості алілового та пропаргілового спиртів. 4. Наведіть відмінності у реакційній здатності одноатомних та трьохатомних спиртів. 5. Наведіть механізм дегідратації 2-бутанолу. 6. Наведіть механізм пінакон-пінаколінового перегрупування.
Лабораторна робота №7
Теоретична частина
Найбільш характерні для альдегідів і кетонів реакції нуклеофільного приєднання. Висока реакційна здатність альдегідів і кетонів у цих реакціях
на d+ на атомі карбону у функціональній групі залежить від радикалів, з якими він зв,язаний. Альдегіди більш реакційно здатні, ніж кетони, оскільки в кетонах відбувається компенсація часткового позитивного заряду на карбонільному атомі карбону за рахунок двох алкільних груп, які проявляють позитивний індукційний ефект (електронодонорні групи). Для карбонільній групі можливі реакції нуклеофільного приєднання спиртів, HCN, NaHSO3, реактивів Гріньяра. Приєднання азотистих основ (наприклад, аміаку, гідразину, гідроксиламіну, амінів) відбувається з подальшим відщепленням води. Альдегіди на відміну від кетонів легко окиснюються, що використовується в якісних реакціях (реакція срібного дзеркала, взаємодія з реактивом Фелінга). При вивченні властивостей карбонільних сполук необхідно виділити реакції за участю гідрогену біля атома карбону в α-положенні (альдольна конденсація) [1, с.361-392].
Експериментальна частина
Дослід 1. Добування ацетальдегіду У пробірку наливають 1 мл етанолу, 3 мл хромової суміші, кидають шматочок невипаленої порцеляни (центри кипіння). Закривають пробірку корком з газовідвідною трубкою і обережно нагрівають. Кінець газовідвід-ної трубки опускають в пробірку з 2 мл води.
Спостереження:
Рівняння реакції:
Дослід 2. Реакція альдегідів з фуксинсульфітною кислотою У пробірку до 1 мл фуксинсульфітної кислоти додають кілька кра-пель формаліну.
Спостереження:
Рівняння реакції:
Дослід 3. Реакція срібного дзеркала У чисту пробірку наливають 2 мл водного розчину лугу і обережно нагрівають (доводять до кипіння). Потім цей розчин виливать, у пробірку поміщають 2-3 мл 1 %-го розчину AgNO3 і додають краплями 5 %-ий розчин аміаку, щоб осад, який утворився спочатку, зник. До утвореного амонійного розчину гідроксиду срібла додають 1 мл формаліну. Пробірку обережно підігрівають. Спостереження:
Рівняння реакції:
Дослід 4. Реакція відновлення реактива Фелінга Готують реактив Фелінга, змішуючи рівні об’єми розчину сульфату міді (розчин 1) та лужного розчину сегнетової солі (розчин 2). Розчин стає яскраво синього кольору. У пробірку з 2-3 мл свіжоприготованого реакти-ву Фелінга додають 0,5-1 мл розчину формальдегіду. Реакційну суміш обе-режно нагрівають.
Спостереження:
Рівняння реакції:
Дослід 5. Утворення гідросульфітних сполук Наливають в пробірку 2-3 мл насиченого розчину гідросульфіту нат-рію, додають такий же об’єм ацетону, енергійно збовтують суміш, охоло-джуючи її.
Спостереження:
Рівняння реакції: Висновок:
Техніка безпеки
1. Пробірку з хромовою сумішшю нагрівати обережно (дослід 1), щоб рідина не вихлюпнула з пробірки. При попаданні суміші на шкіру, промити уражене місце великою кількістю води та нейтралізувати 1 %-им розчином гідрокарбонату натрію. 2. При промиванні пробірки (дослід 3) розчином лугу, слідкувати, щоб отвір пробірки був спрямований в безпечну зону, і рідина при нагріванні не вихлюпнула з про-бірки. При попаданні розчину лугу на шкіру, уражене місце промити великою кіль-кістю води та нейтралізувати 1 %-ним розчином оцтової кислоти. 3. Після проведення реакції срібного дзеркала (дослід 3) суміш вилити у спеціальний посуд. Пробірку здати лаборанту.
Контрольні запитання та завдання
1. Напишіть рівняння реакції окиснення ізопропілового спирту розчином KМnO4. 2. Напишіть рівняння реакції срібного дзеркала для 3-метилбутаналю. 3. Поясніть зміну забарвлення розчину в пробірці при нагріванні суміші альдегіду та реактиву Фелінга. 4. Які карбонільні сполуки реагують з фуксинсульфітною кислотою? 5. Наведіть рівняння реакції утворення гідросульфітного похідного для ізомасляного альдегіду. 6. Наведіть рівняння реакцій утворення оксиму та гідразону ацетону. 7. Напишіть рівняння реакції альдольної конденсації на прикладі бутаналю. 8. Які альдегіди вступають в реакцію Канніццаро?
Лабораторна робота № 8
Теоретична частина Для карбонових кислот характерні хімічні перетворення за участю
в a- положенні (реакція Гелля-Фольгарда-Зелінського). Реакції по карбо-ксильній групі відбуваються як з розривом О-Н зв’язку (кислотні власти-вості), так і С-ОН зв’язку (утворення похідних карбонових кислот – гало-генангідридів, ангідридів, амідів, естерів). Для карбонових кислот та їх
характерні реакції ацилювання - заміна на кислотний залишок Ацилююча активність карбонових кислот та їх похідних зростає зі збільшенням значення
Взаємні перетворення між функціональними похідними карбонових кислот можна представити такою схемою.
Серед лабораторних методів добування карбонових кислот слід звернути увагу на методи добування за допомогою малонового та ацетооцтового естерів [1, с.393-422]. Експериментальна частина
Дослід 1. Утворення солей карбонових кислот Наливають у пробірку 2 мл 2 %-го розчину ацетату натрію і додають 2 мл 2 %-го розчину хлориду заліза (ІІІ). Яке забарвлення розчину?
Спостереження:
Рівняння реакції:
Дослід 2. Добування вільних вищих жирних кислот До 2-3 мл свіжоприготованого водного розчину мила додають 1-2 мл 5 %-го розчину соляної кислоти.
Спостереження:
Рівняння реакції:
Дослід 3. Утворення нерозчинних солей вищих жирних кислот У пробірку до 3 мл водного розчину мила додають кілька крапель 10 %-го розчину хлориду кальцію.
Спостереження:
Рівняння реакції:
Дослід 4. Гідроліз мила У суху пробірку наливають 1 мл спиртового розчину мила, додають кілька крапель розчину фенолфталеїну. До одержаної суміші обережно до-дають дистильовану воду так, щоб шари не змішувались.
Спостереження:
Рівняння реакції:
Дослід 5. Окиснення мурашиної кислоти У пробірку, промиту розчином лугу, наливають 2-3 мл 1 % -го розчину нітрату срібла та додають по краплях 5 %-й розчин аміаку до повного розчинення осаду. До отриманого амонійного розчину оксиду срібла доливають 1 мл розчину мурашиної кислоти, суміш обережно наг-рівають. Спостереження:
Рівняння реакції:
Дослід 6. Взаємодія олеїнової кислоти з бромом У пробірку наливають 1 мл олеїнової кислоти і додають 2 мл бром-ної води, струшують. Спостереження:
Рівняння реакції: Дослід 7. Взаємодія олеїнової кислоти з перманганатом калію У пробірку наливають 1 мл олеїнової кислоти і додають 2 мл 0,1 %-го розчину перманганату калію, струшують.
Спостереження:
Рівняння реакції: Дослід 8. Кето-енольна таутомерія ацетооцтового естеру У пробірку наливають 2 мл води, додають 1-2 краплі ацетооцтового естеру та кілька краплин розчину хлориду заліза (ІІІ). Поступово розчин забарвлюється. У який колір? Далі додають кілька крапель бромної води. Забарвлення зникає. Чому? Через деякий час забарвлення знову з’являє-ться. Спостереження:
Рівняння реакції: Висновок:
Техніка безпеки
1. Досліди з бромною водою проводити у витяжній шафі. При попаданні бромної води на шкіру уражене місце промити розчином аміаку. 2. При попаданні лугу на шкіру уражене місце промити великою кількістю води та нейтралізувати 1 %-им розчином оцтової кислоти. 3. Після досліду 5 суміш вилити у спеціальний посуд.
Контрольні запитання та завдання
1. Охарактеризуйте хімічні властивості оцтової кислоти та її похідних. 2. Порівняйте кислотні властивості мурашиної, оцтової та трихлороцтової кислот. 3. Наведіть методи добування карбонових кислот на прикладі масляної кислоти. 4. Порівняйте активність в реакціях ацетилювання наступних речовин: ангідрид оцтової кислоти, ацетилхлорид, оцтова кислота, етилацетат. Наведіть пояснення. 5. Наведіть реакції добування вищих жирних кислот із природних жирів. 6. Поясніть поведінку мила в жорсткій воді. 7. Що відбувається на границі розділу шарів води та спиртового розчину мила? 8. Наведіть реакції за допомогою яких можна відрізнити α-, β-, та γ- гідроксикислоти. 9. Застосування ацетооцтового естеру в органічному синтезі. Лабораторна робота № 9 Тема: Методи добування та властивості амінів та α-амінокислот Мета роботи: Вивчення методів добування та хімічних властивостей амінівта α-амінокислот. Тривалість виконаня: 4 год.
Теоретична частина
Аміни розглядають як похідні аміаку, в якому атоми гідрогену частково або повністю заміщені на вуглеводневі радикали. В залежності від кількості заміщених атомів гідрогену аміни поділяються на: первинні (R-NH2), вторинні (R-NH-R) та третинні (R3N). Подібно аміаку аміни проявляють властивості основ завдяки наявності неподіленої пари електронів на атомі нітрогену. При дії кислот відбувається приєднання протона з утворенням позитивно зарядженого заміщеного амонійного катіона:
Аліфатичні аміни сильніші основи ніж аміак, оскільки алкільні групи проявляють позитивний індукційний ефект (є електронодонорними групами) і збільшують електронну густину на атомі нітрогену: СН3
α - Амінокислоти проявляють властивості притаманні як амінам так і карбоновим кислотам, в твердому стані перебувають у вигляді цвіттер-іона
Із залишків α - амінокислот L-ряду побудовані білки [1, с.423-442,479-493]. Експериментальна частина Дослід 1. Добування метиламіну із ацетаміду (Дослід проводять у витяжній шафі!) У пробірці готують суміш, що складається з рівних частин (по 0,5 г) ацетаміду, хлорного вапна, негашеного вапна. До суміші додають кілька краплин води, щоб тверді речовини лише просякли водою. Пробірку зак-ривають пробкою з газовідвідною трубкою, закріплюють під невеликим нахилом у штативі (рис.7). Кінець газовідвідної трубки опускають у про-бірку з 3 мл дистильованої води. Пробірку з дистильованою водою охолод-жують льодом. Обережно 10-15 хв нагрівають реакційну суміш. (Отрима-ний розчин метиламіну у дистильованій воді зберігають для наступних дослідів).
Дослід 2. Властивості метиламіну як основи а) Краплю водного розчину метиламіну, добутого в досліді 1, скля-ною паличкою наносять на універсальний індикаторний папір.
Спостереження:
б) У пробірку поміщають 2 краплі водного розчину метиламіну,
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 820; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.017 с.) |

 Рис.2.
Рис.2.
 Рис.3
Рис.3
 Рис.4.
Рис.4.
 Рис.5
Рис.5
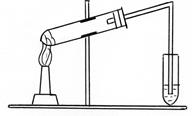 Рис.6
Рис.6


 ,
,
 ( ацил) атома металу або активного атома гідрогену в сполуках, що їх містять (спирти, алкоголяти, вода, амоніак, аміни). За допомогою реакцій ацилювання карбонові кислоти можна перетворити на їхні функціональні похідні, здійснити перетворення між останніми та отримати знову карбонові кислоти.
( ацил) атома металу або активного атома гідрогену в сполуках, що їх містять (спирти, алкоголяти, вода, амоніак, аміни). За допомогою реакцій ацилювання карбонові кислоти можна перетворити на їхні функціональні похідні, здійснити перетворення між останніми та отримати знову карбонові кислоти. на вуглецевому атомі карбоксильної групи, що залежить від індукційного (-І) та мезомерного (+М) ефектів Х. Чим сильніший -І-ефект та слабший +М-ефект, тим більш вагомішим стає
на вуглецевому атомі карбоксильної групи, що залежить від індукційного (-І) та мезомерного (+М) ефектів Х. Чим сильніший -І-ефект та слабший +М-ефект, тим більш вагомішим стає 



 NH2. Первинні та вторинні аміни здатні заміщувати атоми гідрогену на алкільні групи (реакції алкілування) та ацильні (реакції ацилювання). При дії нітритної кислоти на первинні аміни утворюються не стійкі солі діазонію, які розкладаються з виділенням азоту та утворенням переважно відповідного спирту.
NH2. Первинні та вторинні аміни здатні заміщувати атоми гідрогену на алкільні групи (реакції алкілування) та ацильні (реакції ацилювання). При дії нітритної кислоти на первинні аміни утворюються не стійкі солі діазонію, які розкладаються з виділенням азоту та утворенням переважно відповідного спирту. .
. .
. Рис.7
Рис.7



