
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рівняння Бернуллі та його наслідки.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Рівняння Бернуллі— рівняння гідродинаміки, яке визначає зв'язок між швидкістю течії v, тиском p та висотою h певної точки в ідеальній рідині.
p — статичний тиск; Рівняння Бернуллі можна сформулювати так: в стаціонарному потоці ідеальної нестискуваної рідини сума статичного, динамічного і гідростатичного тисків є сталою на довільному поперечному перерізі потоку. Для трубки течії, яка розміщена горизонтально (
де Із рівняння Бернуллі для горизонтальної трубки течії видно, що при течії рідини в горизонтальній трубці, що має різні перерізи, швидкість рідини більша в місцях звуження трубки, а тиск більший в місцях, де площа поперечного перерізу трубки більша. Рівняння Бернуллі є наслідком закону збереження енергії. Якщо рідина не ідеальна, то її механічна енергія розсіюється і тиск вздовж трубопроводу, яким тече така рідина, спадає. Рівняння Бернуллі широко застосовують для розв'язання багатьох гідравлічних задач у нафтогазовій справі. Наслідки з рівняння Бернуллі 1.Якщо потік горизонтальний, то рівняння набуває вигляду:
Звідси видно, що там, де швидкість потоку більша, тиск менший і навпаки. Зокрема в трубці змінного перерізу, коли рідина переходить з ширшої частини трубки у вужчу, збільшення швидкості супроводжується зменшенням тиску.
Ця різниця тисків визначає прискорюючи силу, що діє на одиницю площі потоку рідини. 2. Значне зниження тиску в швидких струминах рідин або газів використовують для побудови водоструминних, ртутних або масляних насосів, інжекторів, пульверизаторів тощо. 3.Трубка Піто – прилад для вимірювання швидкості потоку рідини або газу. Прилад має дві трубки – одну з отвором проти потоку і другу з отвором, паралельним потоку. Застосовуючи рівняння Бернуллі для положень частинок потоку в отворах трубок, дістанемо:
Складову 46. Розділ фізики, в якому вивчаються будова, фізичні властивості і агрегатні стани речовини на основі їхньої мікроскопічної (молекулярної) будови, називається молекулярною фізикою. В основі молекулярної фізики лежать підтверджені теоретично і експериментально положення, що речовини складається з молекул або атомів, які перебувають у безперервному русі і взаємодіють між собою. Основні положення МКТ речовини: · 1. Будь-які речовини мають дискретну (переривчасту) будову. Вони складаються з найдрібніших частинок молекул і атомів. Підтвердженням дискретності є прокатка, кування металу, отримання 1974 року фотографії окремих молекул і атомів, розчинність речовин тощо. Молекули - найменші частинки, які мають хімічні властивості речовини. Молекули складаються з більш простих частинок - атомів хімічних елементів. У природі є 92 хімічні елементи. Разом із штучними наразі налічується 105 елементів. Речовину, яка побудована з атомів лише одного виду, називають елементом (водень, кисень, азот тощо). Кожен елемент має свій номер Z в таблиці Менделєєва. Число Z визначає кількість протонів у ядрах атомів і електронів, що рухаються в атомі навколо ядра. · 2. Молекули знаходяться в стані неперервного хаотичного (невпорядкованого) руху, що називається тепловим і у загальному випадку є сукупністю поступального, обертального і коливального рухів. Під час нагрівання речовини швидкість теплового руху і кінетична енергія його частинок збільшуються, а під час охолодження зменшуються. Ступінь нагрітості тіла характеризує його температура, яка є мірою середньої кінетичної енергії хаотичного поступального руху молекул цього тіла. · 3. Молекули взаємодіють одна з одною із силами електромагнітної природи, причому на великих відстанях вони притягуються, а на малих - відштовхуються. Сили притягання і відштовхування між молекулами діють постійно. Вуглецева одиниця, уніфікована атомна одиниця маси, складова маси атома ізотопу вуглецю 12 C. В. е. була запропонована в 1959 Міжнародним союзом теоретичної і прикладної хімії (IUPAC), прийнята в 1960 Міжнародним союзом теоретичної і прикладної фізики (IUPAP) і затверджена на конгресі IUPAC в 1961. В. е. рівна (1,66043 ± 0,00031)×10 -24 р 47. Моль — одиниця кількості речовини в системі СІ. Позначається моль, Mol. Інша назва — грам-молекула. Кількість речовини, що містить число Авогадро ( За формальним означенням моль — це кількість речовини, виражена в грамах, що чисельно дорівнює її молекулярній масі і відзначається тим, що одному молю будь-якої речовини відповідає однакова кількість молекул. А саме, 1 моль містить стільки молекул (атомів, йонів, інших структурних елементів речовини), скільки атомів у 0,012 кг вуглецю 12С, тобто дорівнює сталій Авоґадро. Позначення «Моль» введене у 1893 році Вільгельмом Оствальдом і походить від слова «молекула». Прості молекули, наприклад молекули більшості газів, складаються з двох-трьох атомів. А у деяких газів, таких як гелій і неон, – взагалі з одного. Однак існують і такі, які мають у своєму складі тисячі атомів, з'єднаних один з одним в складній послідовності. Часто буває, що молекули містять кілька однакових атомів. Наприклад, молекула води складається з двох атомів водню і одного – кисню. Молекула чистого природного каучуку, з якого отримують гуму, складається приблизно з 75 000 атомів вуглецю і 100 000 атомів водню. Так що, як бачите, молекули різних речовин сильно відрізняються за своєю величиною.Так, розмір молекули води вимірюється мільярдними частками сантиметри. Молекула гуми в тисячі разів більше. Форма молекул може бути так же самій різною: одні з них згорнуті в клубочок, нагадує футбольний м'яч, а інші представляють собою довгі нитки. Практично неможливо наочно уявити собі справжні розміри молекул. 48. Температура – скалярна фізична величина, яка окреслює здатність макроскопічної системи (тіла), що знаходиться в стані термодинамічної рівноваги, до теплопередачі- фіз. величина, що характеризує ступінь нагрівання тіла – це відображення інтенсивності руху молекул. Температура характеризує ступінь нагрітості тіла. Поняття температури може бути введено на основі різних підходів: як величина, пропорційна середній кінетичній енергії частинок тіла, як розподіл частинок тіла за рівнями енергії або за швидкостями, за ступенем іонізації, за спектральною густиною випромінювання та ін. Такі температури часто називають відповідно температурами збудження, кінематичною, іонізаційною, радіаційною. Газовий термометр, прилад для виміру температури, дія якого заснована на залежності тиску або об'єму ідеального газу від температури. Найчастіше застосовують Р. т. постійного об'єму,який є заповненим газом балоном 1 незмінного об'єму, сполучений тонкою трубкою 2 з пристроєм 3 для виміру тиску. У такому Р. т. зміна температури газу в балоні пропорційно зміні тиску. Р. т. вимірюють температури в інтервалі від ~2К до 1300 К. Градус Цельсія (°C) — одиниця виміру температури, подібна до Кельвіна. Широко використовується в побуті. За нуль за шкалою Цельсія приймалася точка плавлення льоду, а за 100 градусів — точка кипіння води при стандартному атмосферному тиску. 49. Шкала Цельсія, шкала температур, в основу якої покладено температури замерзання (0 ° С) і кипіння (100 ° С) води. Інтервал між цими двома значеннями розділений на 100 градусів. Назва шкали (по імені її винахідника Андерса Цельсія) було офіційно закріплено в 1948 р., замінивши собою колишню назву «стоградусной». Градуси Цельсія переводяться в градуси Фаренгейта допомогою множення на 1,8 і додавання 32. Абсолю́тна температу́рна шкала́, шкала́ Ке́львіна — температурна шкала, в якій початковою точкою є абсолютний нуль, а одиницею температури — градус, що дорівнює градусові за шкалою Цельсія. Співвідношення між Т (температурою за абсолютною шкалою) і t (температурою за шкалою Цельсія) виражається формулою: Т = t + 273.16 °C Одиницею температури в абсолютній температурній шкалі є Кельвін. Рівняння Клапейрона Рівняння Клапейрона- Мендєлєєва – це рівняння стану ідеального газу для його довільної маси. Воно звучить так: при сталій кількості речовини ідеального газу добуток його тиску на об’єм прямо пропорційний абсолютній температурі.
Це рівняння було виведене Клапейроном. В – питома газова стала, яка залежить від роду газу і його кількості. Мендєлєєв надав рівнянню більш зручного для користування вигляду, скориставшись законом Авогадро. Завдяки цьому стала в рівнянні газового стану, розрахована на 1 моль речовини, буде дорівнювати: R=8,31 Дж/моль*К – універсальна газова стала. Звідси рівняння стану, розрахованого на 1 моль газу: pV=RT – рівняння Клапейрона-Мендєлєєва. Для будь-якої маси m газу рівняння Клапейрона-Мендєлєєва записується так:
Де μ – маса, яку має моль газу.
Ізотермічний процес. Якщо в рівнянні вважати Т - const, права частина рівняння буде величиною сталою: pV= const. Закон Бойля—Маріотта, або рівняння стану ідеального газу при ізотермічному процесі, означає: добуток тиску даної маси газу на об'єм, що його займає газ за сталої температури, є величиною сталою Графічно залежність між тиском і об'ємом газу за сталої температури зображають гіперболою. Ці криві називають ізотермами (кривими однакових температур). Чим вища температура, за якої відбувається процес, тим вище розташована ізотерма (Т1 <Т2< Т3).
тобто за незмінної маси газу і сталого тиску об'єм газу прямо пропорційний абсолютній температурі. Перехід газу з одного стану в інший за сталого тиску називають ізобарним процесом. Графічно такий процес в координатних осях V, Т зображується прямою, продовження якої проходить через початок координат,— ізобарою. Кут її нахилу а до осі температур залежить від тиску газу: чим більший тиск, тим менший кут нахилу Ізохорний процес. Розглянемо випадок, коли об'єм V газу залишається сталим. З рівняння Клапейрона випливає, що за цих умов сталим буде відношення тиску газу до його температури:
тобто за сталого об'єму тиск газу прямо пропорційний його абсолютній температурі Перехід газу з одного стану в інший за сталого об'єму називають ізохорним процесом. Графік цього процесу в координатах р, Т — пряма лінія, продовження якої проходить через початок координат; її називають ізохорою. Кут нахилу а ізохори до осі температур тим більший, чим менший об'єм газу.
α = 0,003661 К-1 53. закон Шарля. Ізохорний процес відбувається при сталому об’ємі газу (V=const). при V=const р/ V=const.- це рівняння називається рівнянням ізохорного процесу. Рівняння ізохорного процесу записують у вигляді р=р0(1+βt), де p0 і p –т иски при 0˚С і t˚C; β – термічний коефіцієнт тиску (β=0,003661). Рівняння показує, що в ізохоричному процесі тиск газу перебуває в лінійній залежності від температури. Температуру, при якій тиск газу дорівнює нулю, називають абсолютним нулем. Закон Дюлонга та Пті. Зако́н Дюлонга — Пті визначає питому теплоємність твердого тіла за формулою
Закон Дюлонга—Пті справедливий при температурах вищих за температуру Дебая. Питома теплоємність – характеристика речовини, яка вказує кількість теплоти, необхідної для нагрівання одиниці маси речовини на 1градус C, або ж кількість теплоти, що виділяється при охолодженні одиниці маси речовини. Відкритий закон був у 1819році. Фізична природа Для того, щоб підвищити температуру потрібно збільшити кінетичну енергію руху кожного із атомів твердого тіла. Однак, внаслідок сильної взаємодії атомів між собою, збільшення кінетичної енергії потребує рівного за величиною збільшення потенціальної енергії. Тому теплоємність твердого тіла вдвічі більша за теплоємність ідеального газу. Закон Дюлонга—Пті можна переписати для теплоємності твердого тіла у вигляді:
де С — теплоємність, Теплоємність – це фізична величина, яка визначається кількістю теплоти, яку потрібно надати тілу для підвищення його температури на один градус. Для справедливості закону Дюлонга-Пті необхідно, щоб енергії теплового руху вистачало для збудження всіх можливих типів коливань у твердому тілі. При низьких температурах деякі з коливань не збуджуються. Це явище зумовлене законами квантової статистики (в даному випадку — статистики Бозе-Ейнштейна). Тому при низьких температурах закон Дюлонга-Пті не діє. Як було встановлено П.Л. Дюлонгом і А.Г. Пті, молярна теплоємкість твердих одноатомних тіл майже однакова і дорівнює:
де R= 8,31 Закон Дюлонга і Пті є дійсним для твердих одноатомних тіл для достатньо високих температур. Для більшості тіл такою високою температурою є вже кімнатна температура. Для деяких тіл з малою атомною масою, наприклад, берилію, бора, вуглецю (структури алмазу), молярну теплоємкість можна визначити і при високих температурах за законом Дюлонга і Пті. Навпаки, при охолоджені, для всіх тіл закон Дюлонга і Пті не дає точне визначення молярної теплоємкості, тобто, є відходження від закону. Барометрична формула Барометри́чна фо́рмула— формула, за якою визначають залежність тиску або густини газу від висоти. Ця залежність зумовлена дією поля тяжіння Землі і тепловим рухом молекул газу (повітря). Припускаючи, що газ є ідеальним газом сталої температури, і вважаючи поле тяжіння Землі однорідним, отримують барометричну формулу такого вигляду:
де p0 — тиск на нульовому рівні (на рівні вибою в газових свердловинах, біля поверхні Землі або на рівні моря), Па; p — тиск на висоті h, м над цією поверхнею, Па; m — маса молекули (для повітря дорівнює масі молекули азоту), кг; g — прискорення вільного падіння, м/с2; k — стала Больцмана, Дж/К; T — абсолютна температура повітря, К. Барометрична формула є наближеною: при виведенні її не враховано залежності g i T від висоти, відхилення газу від ідеального газу тощо. Нею можна користуватися для визначення атмосферного тиску до висоти 11 км (з поправками на зміну температури). За уточненою барометричною формулою градуюють альтиметри, висотоміри. Зміну тиску нерухомого стовпа газу у свердловині розраховують за уточненою барометричною формулою Лапласа-Бабіне:
де p(z) — тиск газу на глибині z, м, Па; p0 — тиск газу на гирлі свердловини, Па; Γ — відносна густина газу (до повітря); Tс — середня температура газу, К; zΓ — середній коефіцієнт стисливості газу при середньому тиску і середній температурі газу. Барометричну формулу з певним обмеженням можна використати для визначення розподілу кількості колоїдних частинок по висоті рідинної або газової дисперсної системи, на які діє поле тяжіння. Барометрична формула є окремим випадком розподілу Больцмана.
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1400; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.196.68 (0.011 с.) |

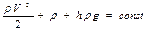
 - динамічний тиск; hρg - гідростатичний тиск.
- динамічний тиск; hρg - гідростатичний тиск. ), рівняння Бернуллі має такий вигляд:
), рівняння Бернуллі має такий вигляд: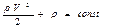 ,
, називається повним тиском.
називається повним тиском.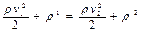

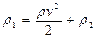
 називають динамічним тиском, а
називають динамічним тиском, а 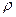 - статистичним.
- статистичним. ) структурних формульних одиниць. Формульні одиниці — реальні частки, такі як атоми, молекули, іони, радикали.
) структурних формульних одиниць. Формульні одиниці — реальні частки, такі як атоми, молекули, іони, радикали. або p2V2=BТ2.
або p2V2=BТ2.
 Якщо в газі відбуваються якісь процеси, то звичайно змінюються всі три його параметри: р, V і Т
Якщо в газі відбуваються якісь процеси, то звичайно змінюються всі три його параметри: р, V і Т Ізобарний процес. Нехай тепер газ знаходиться в умовах, коли сталим є його тиск р. З рівняння Клапейрона випливає, що в цьому випадку сталим буде відношення об'єму газу до його температури
Ізобарний процес. Нехай тепер газ знаходиться в умовах, коли сталим є його тиск р. З рівняння Клапейрона випливає, що в цьому випадку сталим буде відношення об'єму газу до його температури = const,
= const,
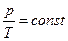
 52.Ізобарний процес відбувається в системі при сталому тиску (р=const). Такий процес можна здійснити, коли газ, наприклад, міститься в циліндрі з рухомим поршнем.зміна температури такого газу в такому циліндрі зумовлює переміщення поршня, тобто зміну об’єму. Тиск при цьому залишається сталим. При р=const V/T=const - ізобарного процесу (закон Гей-Люссака). Закон Гей-Люссака записують у вигляді V=V0(1+αt), де V0– об’єм газу при 0˚С; V- об’єм газу при температурі t˚C; α- коефіцієнт об’ємного розширення газу. Придосить низьких тисках величина α є однаковою для різних газів.
52.Ізобарний процес відбувається в системі при сталому тиску (р=const). Такий процес можна здійснити, коли газ, наприклад, міститься в циліндрі з рухомим поршнем.зміна температури такого газу в такому циліндрі зумовлює переміщення поршня, тобто зміну об’єму. Тиск при цьому залишається сталим. При р=const V/T=const - ізобарного процесу (закон Гей-Люссака). Закон Гей-Люссака записують у вигляді V=V0(1+αt), де V0– об’єм газу при 0˚С; V- об’єм газу при температурі t˚C; α- коефіцієнт об’ємного розширення газу. Придосить низьких тисках величина α є однаковою для різних газів.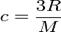 де c — питома теплоємність, R — універсальна газова стала, M — молярна маса.
де c — питома теплоємність, R — універсальна газова стала, M — молярна маса. ,
, — стала Больцмана, N — число атомів у кристалі.
— стала Больцмана, N — число атомів у кристалі.
 – універсальна газова стала.
– універсальна газова стала.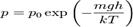 ,
, ,
,


