
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет степени превращения исходных веществ, выхода продукта и равновесного состава химической реакцииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Для расчета равновесного состава была введена универсальная величина – химическая переменная или глубина превращения ξ (кси), равная отношению изменения количества вещества данного реагента или продукта реакции к его стехиометрическому коэффициенту в уравнении химической реакции:
где знак “+” используется для продуктов реакции, а знак “ – “ для исходных веществ. Равновесное количество вещества для каждого участника реакции выразим через глубину превращения:
Подставив полученное выражение в уравнение, связывающее термодинамическую Ka =
Решив это уравнение относительно химической переменной ξ, можно рассчитать: равновесные количества вещества каждого участника реакции, равновесные концентрации реагентов, степень превращения исходных веществ и выход продуктов реакции. Пример: Определим равновесную глубину превращения ξ в реакции 2CO + S2 = 2COS при температуре 500 К и давлении 101,013 кПа., при условии, что исходные вещества взяты в стехиометрических количествах. Константа равновесия Решение: Выразим равновесный состав через химическую переменную ξ и найдем область допустимых значений (ОДЗ) ξ из условия, число молей вещества всегда положительная величина:
Выразим практическую константу Kn через глубину превращения ξ:
Выразим сумму молей газообразных веществ в равновесии через глубину превращения ξ:
Найдем разность стехиометрических коэффициентов в уравнении реакции:
Подставим Kn,
=
Полученное кубическое уравнение
решаем точно, отбирая корни в соответствии с областью допустимых значений ξ, или приближенно (методом подбора или графически), что для практических расчетов вполне допустимо. Используя метод приближенных вычислений, получим при
Пример: Определим равновесную глубину превращения ξ в реакции 2CO + S2 = 2COS при температуре 500 К и давлении 101,013 кПа., при условии, что исходный состав содержал 0,2 моля СО и 2 моля газообразной серы. Константа равновесия Решение: Выразим равновесный состав через химическую переменную ξ и найдем область допустимых значений (ОДЗ) ξ:
Выразим практическую константу Kn через глубину превращения ξ:
Выразим сумму молей газообразных веществ в равновесии через глубину превращения ξ:
Найдем разность стехиометрических коэффициентов в уравнении реакции:
Подставим Kn,
=
Полученное кубическое уравнение
решаем приближенно и получаем при
Пример: Определим степень превращения исходных веществ в реакции
2CO + S2 = 2COS
при условиях предыдущих примеров. Решение: Степень превращения β i – это отношение количества прореагировавшего вещества к его начальному количеству:
При условии примера, в котором исходные вещества взяты в стехиометрических количествах, с β β
При условии примера, в котором исходный состав содержал 0,2 моля СО и 2 моля газообразной серы, с
β β Пример: Определим состав равновесной смеси в % (мол.) для реакции
2CO + S2 = 2COS
при условиях предыдущих примеров. Решение: Мольная доля вещества в смеси равна:
или в % (мол):
При условии примера, в котором исходные вещества взяты в стехиометрических количествах, с
При условии примера, в котором исходный состав содержал 0,2 моля СО и 2 моля газообразной серы, с
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 454; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.188.23 (0.01 с.) |

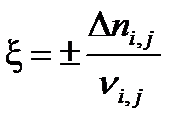 ,
,
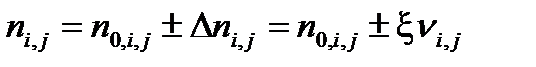
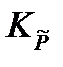 и практическую Kn константы равновесия, получим
и практическую Kn константы равновесия, получим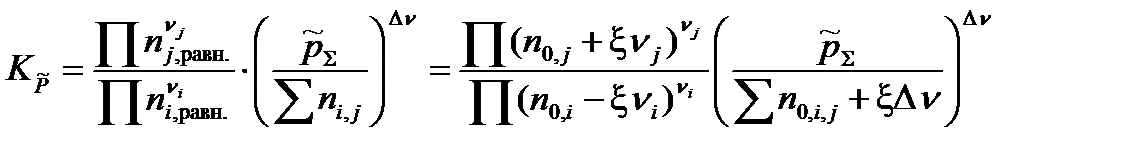
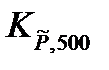 = 3,56·1011.
= 3,56·1011. , моль
, моль
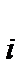 , моль
, моль
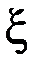
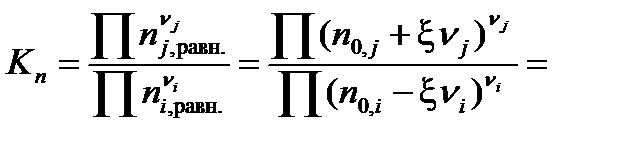
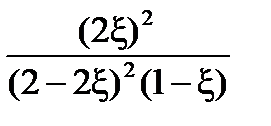
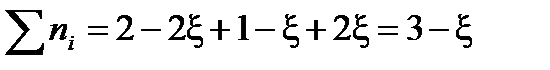
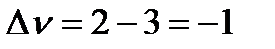
 и
и 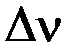 в уравнение, связывающее термодинамическую константу
в уравнение, связывающее термодинамическую константу 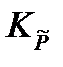 с практической константой Kn
с практической константой Kn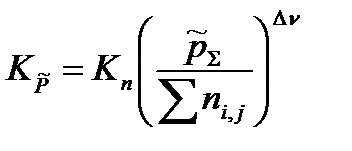
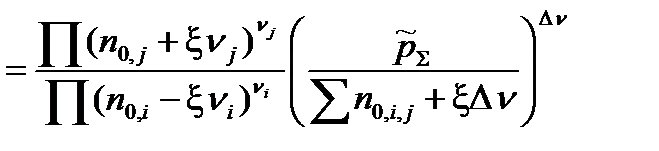 =
=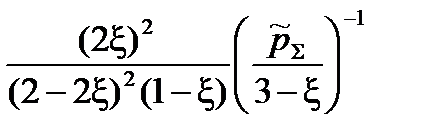 =
= 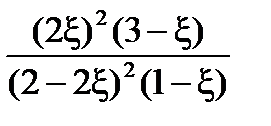
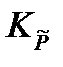 =
= 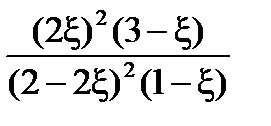
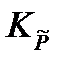 = 3,56·1011
= 3,56·1011 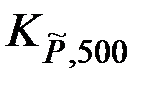 = 3,56·1011.
= 3,56·1011. , моль
, моль
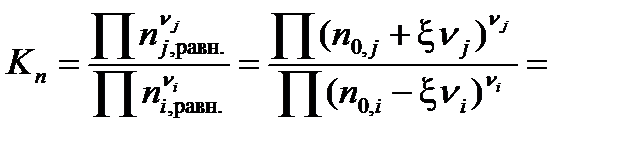
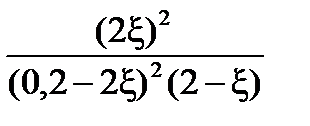
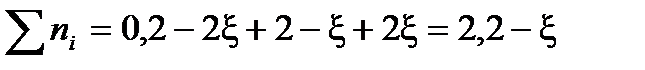
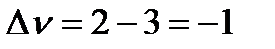
 с практической константой Kn
с практической константой Kn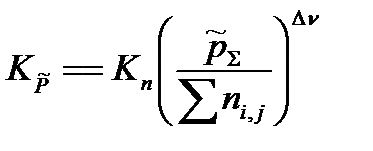
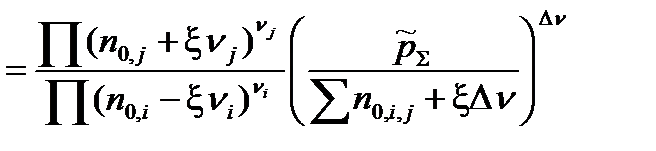 =
=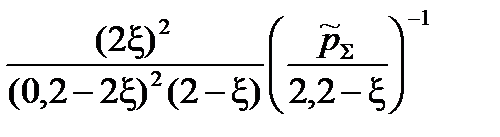 =
= 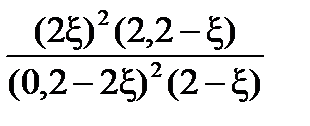
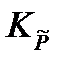 =
= 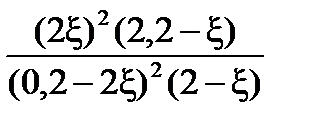
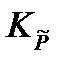 = 3,56·1011
= 3,56·1011 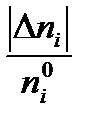 =
= 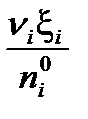
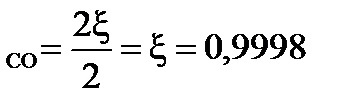 = 99,98 %
= 99,98 %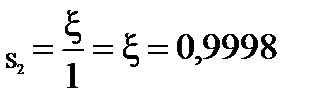 =99,98 %
=99,98 %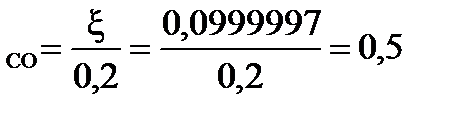 000 = 50,00 %
000 = 50,00 %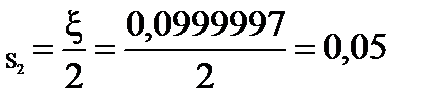 00 = 5,00 %
00 = 5,00 %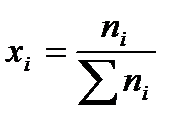
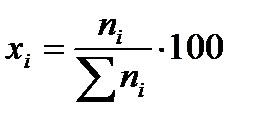
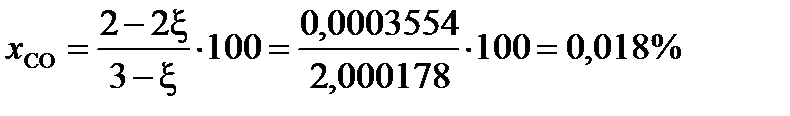 (мол.)
(мол.)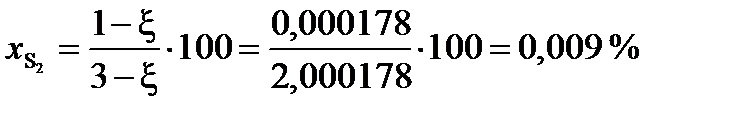 (мол.)
(мол.)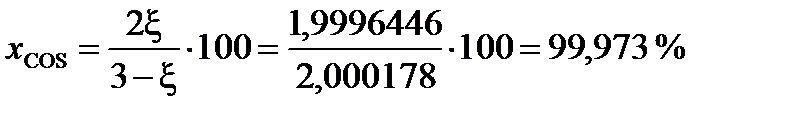 (мол.)
(мол.)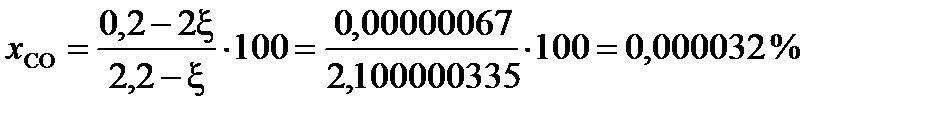 (мол.)
(мол.)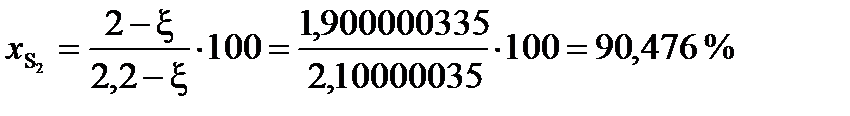 (мол.)
(мол.)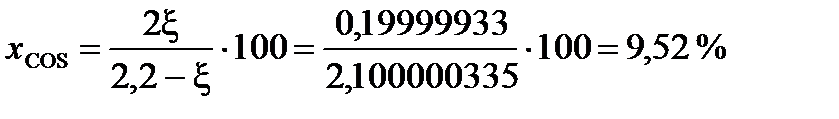 (мол.)
(мол.)


