Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Идеальные и неидеальные растворыСодержание книги
Поиск на нашем сайте
Растворомназывают гомогенную систему переменного состава, состоящую как минимум из двух компонентов. Различают газообразные, жидкие и твердые растворы. Растворы бывают с неограниченной и ограниченной растворимостью компонентов друг в друге. При описании жидких растворов различают растворитель и растворенное вещество. Растворителем считают то вещество, которое в чистом виде находится в том же агрегатном состоянии, что и раствор. Если в чистом виде компоненты и раствор находятся в одинаковом агрегатном состоянии, то растворителем считают то вещество, которого больше. Обычно свойства растворителя обозначают подстрочным индексом «1», а растворенного вещества - индексом «2». По характеру взаимодействия компонентов раствора различают идеальные и неидеальные растворы. В идеальных растворах, состоящих из двух неограниченно растворимых друг в друге компонентов А и В, энергия взаимодействия двух различных частиц (ЕА-В) такая же, как и двух одинаковых (ЕА-А и ЕВ-В):
ЕА-В =
Образование идеальных растворов происходит атермически (без теплового эффекта, теплота смешения Δ mixH = 0) и без изменения объема (Δ mixV = 0). Изменение энтропии при образовании идеальных растворов такое же, как при смешении идеальных газов:
Δ mixS = - R (x А ln x А + x В ln x В). (2.13)
Идеальные жидкие растворы описываются законом Рауля:
где Для идеальных растворов закон Рауля выполняется для всех компонентов при всех температурах и концентрациях. Химический потенциал компонента идеального раствора:
Идеальные растворы образуются из веществ, очень близких по своим свойствам (изотопы, оптические изомеры, гомологи). В большинстве случаев при смешении жидких компонентов образуются неидеальные растворы. Большинство реальных растворов являются неидеальными. В таких растворах энергия взаимодействия разнородных частиц отличается от энергии взаимодействия одинаковых частиц:
ЕА-В
Образование неидеальных растворов сопровождается тепловым эффектом(Δ mixH Для неидеальных растворов уравнение Рауля неприменимо ( Различают неидеальные растворы с положительными и отрицательными отклонениями от идеальности (от закона Рауля). При положительных отклонениях от идеальности энергия взаимодействия разнородных частиц в растворе меньше энергии взаимодействия одинаковых частиц:
ЕА-В
Такие растворы образуются, как правило, с поглощением тепла (Δ mixH Для систем с положительными отклонениями от закона Рауля общее давление насыщенного пара над неидеальным раствором больше, чем над идеальным раствором p При отрицательных отклонениях от закона Рауля энергия взаимодействия разнородных частиц в растворе больше энергии взаимодействия одинаковых частиц:
ЕА-В
Образование такого раствора сопровождается выделением тепла (Δ mixH Для систем с отрицательными отклонениями от закона Рауля общее давление насыщенного пара над неидеальным раствором меньше, чем над идеальным раствором p Для описания свойств неидеальных растворов вводят понятие активности i -го компонента в растворе Активность компонента в растворе – это величина, прямо пропорциональная концентрации, которая используется вместо концентрации в уравнениях, выведенных для идеальных растворов, так чтобы эти уравнения выполнялись и для неидеальных растворов. Т.е.
где Коэффициент активности характеризует отклонение свойств компонента неидеального раствора от свойств компонента идеального раствора. Коэффициент активности зависит от концентрации компонента в растворе. Значение и обозначение коэффициента активности зависит от того, в каких единицах выражается концентрация компонента. Если концентрация выражена в мольных долях, то коэффициент активности обозначается Химический потенциал компонента неидеального раствора выражается уравнением:
Для неидеального раствора используется уравнение, аналогичное закону Рауля:
где Пример: Вычислим по закону Рауля давление водяного пара над водным раствором C12H22O11 (m =1,101 моль/кг Н2О) при 75˚С. Давление насыщенного водяного пара над чистой водой при 75˚С p 0,1 = 38,548 кПа. Рассчитаем активность и коэффициент активности воды, если экспериментально измеренное давление водяного пара над раствором p =37,954 кПа. Решение: Мольная доля воды
где Поскольку моляльность раствора - это количество молей растворенного вещества в 1000 граммах растворителя, запишем
Отсюда
Давление водяного пара над водным раствором C12H22O11 рассчитаем по закону Рауля (2.14):
Можно видеть, что Рассчитаем активность воды из уравнения (2.21):
Найдем коэффициент активности воды по уравнению (2.19):
Для разбавленного водного раствора C12H22O11 наблюдаются незначительные положительные отклонения от идеальности.
Жидкие растворы обладают некоторыми свойствами, не зависящими от природы растворенного вещества, а определяющимися только числом частиц растворенного вещества в растворе. Такие свойства называются коллигативными. К таким свойствам относятся понижение температуры замерзания (или плавления) и повышение температуры кипения раствора по сравнению с чистым растворителем и осмотическое давление. Для идеальных растворов справедливы уравнения:
где
При диссоциации или ассоциации растворенного вещества число частиц в растворе изменяется. Это изменение можно учесть, введя в уравнения изотонический коэффициент Вант-Гоффа i. Тогда уравнения (2.22) – (2.24) запишутся в виде
Изотонический коэффициент Вант-Гоффа показывает, во сколько раз изменяется число частиц в растворе вследствие диссоциации или ассоциации молекул. В разбавленных растворах сильных электролитов величина этого коэффициента приближается к небольшим целочисленным значениям. Так, осмотическое давление (p) разбавленного раствора хлорида натрия с концентрацией с равно 2 RTc (т.е. i =2). Это легко объяснялось тем, что концентрация частиц в растворе вдвое превышает величину концентрации, которая была рассчитана исходя из навески соли NaCl, растворенной в определенном объеме. Небольшие отклонения от целочисленных значений связывали с экспериментальными ошибками. Теперь в этом усматривают влияние коэффициентов активности. Для слабых электролитов получили дробные значения i, зависящие от общей концентрации электролита. Используя теорию электролитической диссоциации Аррениуса можно установить связь между изотоническим коэффициентом Вант-Гоффа и степенью диссоциации a:
Определяя экспериментально осмотическое давление или понижение температуры замерзания раствора, можно вычислить коэффициент Вант-Гоффа i, а затем определить степень диссоциации a и рассчитать практическую константу диссоциации Кс для слабого электролита. Величину Кс также можно определить, используя кондуктометрический и потенциометрический методы. Рассчитанные разными методами Кс хорошо согласуются друг с другом, что служит убедительным доказательством справедливости электролитической теории Аррениуса для слабых электролитов. Для сильных электролитов в разбавленных растворах степень диссоциации a
Пример: Определим, подчиняется ли идеальным законам раствор CaCl2 − H2O следующего состава: 0,944 г CaCl2,150 г H2O. Экспериментально определенное понижение температуры замерзания Решение: Рассчитаем моляльность раствора:
Найдем понижение температуры замерзания раствора, считая раствор идеальным, воспользовавшись справочными данными о криоскопической постоянной воды [2]:
Сравнение рассчитанной величины
2.2.1.1 Многовариантное задание №4 «Определение активности и коэффициента активности растворителя в растворе» 1. Вычислите по закону Рауля давление насыщенного пара растворителя над раствором указанной концентрации (таблица 2.2). 2. Сравните с экспериментальным давлением p эксп. (таблица 2.2). 3. Объясните полученный результат. 4. Рассчитайте активность растворителя. 5. Рассчитайте коэффициент активности растворителя.
Таблица 2.2 – Варианты заданий
2.2.1.2 Многовариантное задание № 5 «Коллигативные свойства растворов»
Определите, подчиняются ли идеальным законам указанные в таблице 2.3 растворы. Если не подчиняются − укажите причину. Для систем: ZnSO4 − H2O; H3BO3 − H2O; (C6H5O7)H3 − H2O; MgCl2 − H2O; MgSO4 − H2O; CHCl2COOH − CCl4; CO(NH2)2 − NH3(ж) приведено экспериментально определенное повышение температуры кипения, для всех других систем – понижение температуры замерзания ( Эбулиоскопические E и криоскопические K константы растворителей приведены в таблице 2.4.
Таблица 2.4 – Свойства растворителей
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 243; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.1.100 (0.008 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 (ЕА-А + ЕВ-В). (2.12)
(ЕА-А + ЕВ-В). (2.12)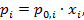 (2.14)
(2.14)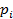 - парциальное давление насыщенного пара i -го компонента над раствором;
- парциальное давление насыщенного пара i -го компонента над раствором;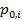 - давление насыщенного пара над чистым жидким i -м компонентом;
- давление насыщенного пара над чистым жидким i -м компонентом;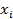 – молярная доля i -го компонента в растворе.
– молярная доля i -го компонента в растворе.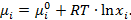 (2.15)
(2.15)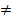
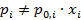 ). (Оно может быть применимо только по отношению к растворителю в очень разбавленных реальных растворах).
). (Оно может быть применимо только по отношению к растворителю в очень разбавленных реальных растворах).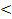
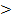 0) и с увеличением объема (Δ mixV
0) и с увеличением объема (Δ mixV 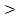 p ид. Силы межчастичного взаимодействия между молекулами в растворе меньше, чем между молекулами чистых компонентов, и, следовательно, перевод компонентов такого раствора в пар требует меньших затрат энергий, чем перевод в пар компонентов идеального раствора.
p ид. Силы межчастичного взаимодействия между молекулами в растворе меньше, чем между молекулами чистых компонентов, и, следовательно, перевод компонентов такого раствора в пар требует меньших затрат энергий, чем перевод в пар компонентов идеального раствора.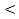 p ид. Силы межчастичного взаимодействия между молекулами в растворе больше, чем между молекулами чистых компонентов, и, следовательно, перевод компонентов такого раствора в пар требует больших затрат энергий, чем перевод в пар компонентов идеального раствора.
p ид. Силы межчастичного взаимодействия между молекулами в растворе больше, чем между молекулами чистых компонентов, и, следовательно, перевод компонентов такого раствора в пар требует больших затрат энергий, чем перевод в пар компонентов идеального раствора.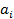 .
.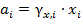 , (2.19)
, (2.19)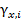 - коэффициент активности.
- коэффициент активности.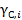 . Для моляльной концентрации коэффициент активности обозначается
. Для моляльной концентрации коэффициент активности обозначается 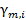 или
или 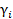 .
.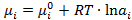 (2.20)
(2.20)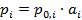 (2.21)
(2.21)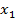 в растворе определяется как:
в растворе определяется как: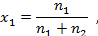
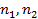 – количества молей растворителя и растворенного вещества, соответственно.
– количества молей растворителя и растворенного вещества, соответственно.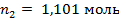 . Количество молей воды, находящихся в 1000 г, рассчитаем:
. Количество молей воды, находящихся в 1000 г, рассчитаем: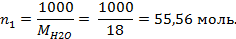
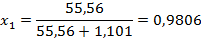
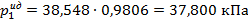 .
.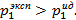 Следовательно, наблюдается положительное отклонение от закона Рауля.
Следовательно, наблюдается положительное отклонение от закона Рауля.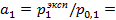 37,954/38,548 = 0,9846
37,954/38,548 = 0,9846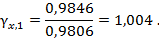
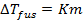 , (2.22)
, (2.22)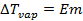 , (2.23)
, (2.23)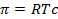 , (2.24)
, (2.24)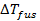 – понижение температуры замерзания (плавления) раствора по сравнению с температурой замерзания (плавления) растворителя;
– понижение температуры замерзания (плавления) раствора по сравнению с температурой замерзания (плавления) растворителя;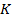 – криоскопическая постоянная, зависящая только от свойств растворителя;
– криоскопическая постоянная, зависящая только от свойств растворителя;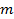 – моляльность раствора, моль/кг растворителя;
– моляльность раствора, моль/кг растворителя;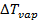 – повышение температуры кипения раствора по сравнению с температурой кипения растворителя;
– повышение температуры кипения раствора по сравнению с температурой кипения растворителя;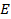 – эбулиоскопическая постоянная, зависящая только от свойств растворителя;
– эбулиоскопическая постоянная, зависящая только от свойств растворителя;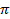 – осмотическое давление, Па;
– осмотическое давление, Па;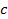 – молярная концентрация, моль/м3.
– молярная концентрация, моль/м3.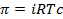 , (2.25)
, (2.25)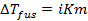 , (2.26)
, (2.26)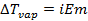 , (2.27)
, (2.27)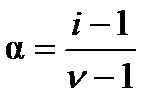 . (2.28)
. (2.28) 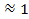 , т.е. число частиц должно увеличиться в nраз.Однако в действительности коэффициент Вант-Гоффа всегда меньше n, так как ионы в растворе связаны силами электростатического взаимодействия и не могут проявлять себя как вполне свободные частицы. Чем больше силы межионного взаимодействия, тем больше отклоняется данный реальный раствор от идеального раствора и тем меньше i.
, т.е. число частиц должно увеличиться в nраз.Однако в действительности коэффициент Вант-Гоффа всегда меньше n, так как ионы в растворе связаны силами электростатического взаимодействия и не могут проявлять себя как вполне свободные частицы. Чем больше силы межионного взаимодействия, тем больше отклоняется данный реальный раствор от идеального раствора и тем меньше i.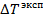 = 0,272 градуса.
= 0,272 градуса.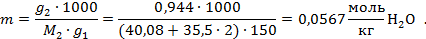
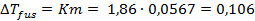 .
.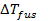 с экспериментальным значением
с экспериментальным значением