Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электрическая проводимость растворов электролитовСодержание книги
Поиск на нашем сайте
Электролиты – вещества, диссоциирующие в растворах на ионы. Под влиянием приложенного электрического поля ионы движутся направленно и являются переносчиками зарядов. Следовательно, электролиты – ионные проводники, в отличие от электронных проводников – металлов. В зависимости от степени диссоциации Электрической проводимостью wраствора называют величину, обратную сопротивлению R. Измеряется w в сименсах (1 См = 1 Ом-1). Электрическая проводимость раствора зависит от природы электролита и растворителя, концентрации, температуры и подвижностей ионов, образующихся при диссоциации электролита. Подвижность иона Удельная электрическая проводимость представляет собой электрическую проводимость единичного (1 м3) объема раствора, заключенного между параллельными электродами с единичной площадью (1 м2), расположенными на единичном расстоянии (1 м) друг от друга. Удельная электрическая проводимость является величиной, обратной удельному сопротивлению
Удельное сопротивление определяется по уравнению:
где R – общее сопротивление, Ом; l – длина проводника, м; S – поперечное сечение проводника, м2. Если бы электричество проводили только ионы, находящиеся в растворе между электродами с единичной площадью, расположенными на единичном расстоянии, то измеряемая электрическая проводимость была бы удельной. В действительности ток проводят не только ионы, заключенные в этом единичном объеме. Поэтому удельная электрическая проводимость лишь пропорциональная общей проводимости w:
Коэффициент пропорциональности k называют константой сосуда, ее численное значение зависит от соотношения
Пример: Вычислим удельную электрическую проводимость раствора KNO3, если сопротивление 0.1 M раствора KCl при 25оС составляет 20 Ом, а сопротивление раствора KNO3, измеренное в тех же условиях, равно 254 Ом.
Решение: Из табл. 62 [2] удельная электрическая проводимость раствора KCl æ = 1.288 См×м-1. Следовательно, константа сосуда Удельная электрическая проводимость раствора KNO3, рассчитанная по (3.22), равна
В растворах сильных электролитов удельная электрическая проводимость при увеличении концентрации раствора сначала возрастает, так как увеличивается количество ионов в единичном объеме. Но при некоторой концентрации æ достигает максимального значения, а затем начинает уменьшаться с ростом концентрации. Этот факт объясняется усилением электростатического взаимодействия между ионами, приводящим к уменьшению подвижности ионов. В растворах слабых электролитов удельная электрическая проводимость слабо возрастает с увеличением концентрации раствора вследствие увеличения концентрации ионов. Подвижности ионов практически не изменяются с увеличением концентрации. Только в очень концентрированных вязких растворах подвижности ионов уменьшаются, что и приводит к снижению удельной электрической проводимости. При изучении электрической проводимости растворов электролитов пользуются молярной электрической проводимостью
где c - концентрация, выраженная в моль/м3. Размерность Если концентрация выражена в моль/л, то уравнение (3.23) будет иметь вид
Для практических расчетов часто используются размерности в производных единицах СИ: [æ] - Cм×см-1; [
Пример: Вычислим удельную и молярную электрические проводимости 0.1 М раствора KNO3, если удельное сопротивление раствора составляет 95.3 Ом×см. Решение: Удельная электрическая проводимость раствора в соответствие с (3.20) будет равна
Молярная электрическая проводимость, вычисленная по (3.23б), составит
С увеличением концентрации электролита молярная электрическая проводимость уменьшается. Для сильных электролитов это связано с уменьшением подвижности ионов вследствие усиления межионного взаимодействия, а для слабых – в основном с уменьшением степени диссоциации. Молярная электрическая проводимость с уменьшением концентрации увеличивается и при с → 0 стремится к некоторому предельному максимальному значению
где Величины предельных электрических проводимостей отдельных ионов приведены в справочниках, например в [2], таблица 65, с. 123. Для сильных электролитов имеется линейная зависимость Так как уменьшение молярной электрической проводимости слабого электролита объясняется, в основном, снижением степени диссоциации, то величину степени диссоциации при заданной концентрации раствора можно определить из соотношения:
где Определив степень диссоциации слабого электролита, легко рассчитать практическую константу диссоциации при данной концентрации
В справочной литературе приводятся величины молярной электрической проводимости ряда слабых электролитов при различных разведениях раствора V, например, [2], таблица 66, с.125.
Пример: Используя справочное значение молярной электрической проводимости трихлоруксуной кислоты при разведении раствора V = 256 л/моль, вычислим степень, константу диссоциации и рН данного раствора при температуре 25оС. Решение: Из таблицы 66 [2] следует, что при разведении V = 256 л/моль величина CCl3COOH Û H+ + CCl3COO- В таблице 65 при 25оС находим значения Тогда в соответствие с (3.24)
Степень диссоциации вычисляем по уравнению (3.25)
Концентрация раствора кислоты при данном разведении составляет
следовательно, константа диссоциации, рассчитанная по уравнению (3.26), равна
рН раствора определяется активностью ионов водорода. Так как раствор достаточно разбавленный, можно считать его близким к идеальному и вместо активности использовать концентрацию ионов водорода:
Измерения электрической проводимости используют для нахождения растворимости или произведения растворимости трудно растворимых соединений. Такие насыщенные растворы можно считать близкими к бесконечно разбавленным и поэтому принять
Пример: Насыщенный раствор AgCl имеет при 25оС в сосуде с константой k = 0.18 см-1 сопротивление R = 67542 Ом, Решение:. Так как растворимость мала, то можно считать, что Тогда
Для раствора AgCl следовательно,
Растворимость
Так как растворимость мала, можно считать раствор близким к идеальному, и тогда произведение растворимости
3.2.1 Многовариантное задание № 9 «Электрическая проводимость растворов электролитов»
Используя величину удельного сопротивления r раствора при температуре 25ºС электролита А заданной концентрации c (таблица 3.5), рассчитать степень, константу диссоциации и рН раствора.
3.3 Контрольные вопросы
1. Что такое гальванический элемент? 2. Из чего состоит электрод электрохимической системы? 3. Каковы причины возникновения скачка потенциала на границе раздела проводник первого рода проводник второго рода? 4. Что такое водородная шкала потенциалов? 5. Как рассчитывается потенциал электрода в водородной шкале? 6. Каков физический смысл стандартного электродного потенциала? 7. Какие типы электродов Вы знаете? 8. Какие типы гальванических элементов Вы знаете? 9. Что такое ЭДС? 10. Как рассчитывается максимальная электрическая работа, которую может произвести гальванический элемент? 11. Как рассчитывается изменение термодинамических функций D G 0, D H 0, D S 0 и константа равновесия реакции, протекающей в замкнутом гальваническом элементе. 12. Какую величину называют электрической проводимостью раствора? В каких единицах измеряется эта величина? 13. От каких факторов зависит электрическая проводимость растворов электролитов? 14. Что характеризует удельная электрическая проводимость? Как можно определить эту величину? 15. Как зависит удельная электрическая проводимость от концентрации сильного электролита? Ответ аргументируйте. 16. Как зависит удельная электрическая проводимость от концентрации слабого электролита? Ответ аргументируйте. 17. Какую величину называют молярной электрической проводимостью раствора? Как эта величина зависит от концентрации раствора сильного и слабого электролита? 18. Что понимают под предельной молярной электрической проводимостью раствора? Как можно определить эту величину для сильных и слабых электролитов? 19. Как определить степень и константу диссоциации слабого электролита, измеряя электрическую проводимость раствора? 20. Как определить произведение растворимости трудно растворимого соединения, измеряя электрическую проводимость раствора?
Таблица 3.5 – Варианты заданий
МЕТОДЫ ОПРЕДЕЛЕНИЯ СТРОЕНИЯ ВЕЩЕСТВА
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 197; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.204.52 (0.008 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

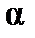 различают сильные и слабые электролиты. У сильных электролитов α ≈ 1. Степень диссоциации электролита в растворе зависит от природы вещества, концентрации и от природы растворителя.
различают сильные и слабые электролиты. У сильных электролитов α ≈ 1. Степень диссоциации электролита в растворе зависит от природы вещества, концентрации и от природы растворителя.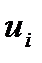 характеризует скорость его движения в поле с единичным градиентом потенциала. Различают удельную æ и молярную
характеризует скорость его движения в поле с единичным градиентом потенциала. Различают удельную æ и молярную 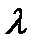 электрическую проводимости раствора.
электрическую проводимости раствора.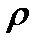 и измеряется в См×м-1:
и измеряется в См×м-1: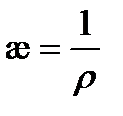 (3.20)
(3.20)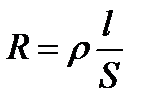 , (3.21)
, (3.21)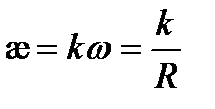 (3.22)
(3.22)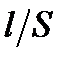 . Для нахождения константы сосуда измеряют сопротивление R стандартных растворов с известной удельной электрической проводимостью. В качестве стандартных растворов используют растворы KCl или NaCl, величины удельной электрической проводимости которых приводятся в справочной литературе. Например, [2], таблица 62, с.119.
. Для нахождения константы сосуда измеряют сопротивление R стандартных растворов с известной удельной электрической проводимостью. В качестве стандартных растворов используют растворы KCl или NaCl, величины удельной электрической проводимости которых приводятся в справочной литературе. Например, [2], таблица 62, с.119.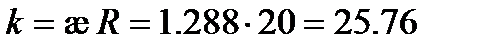 м-1 (или 0.2576 см-1).
м-1 (или 0.2576 см-1).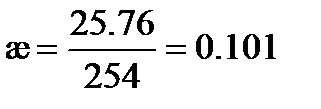 См×м-1.
См×м-1. , которая равна удельной электрической проводимости, отнесенной к единичной концентрации раствора c:
, которая равна удельной электрической проводимости, отнесенной к единичной концентрации раствора c: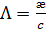 , (3.23)
, (3.23)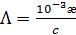 (3.23а)
(3.23а)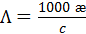 (3.23б)
(3.23б)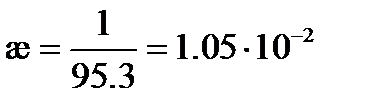 См×см-1
См×см-1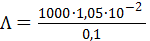 = 105 См×см2/моль
= 105 См×см2/моль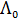 . Величину предельного значения молярной электрической проводимости можно рассчитать, используя закон Кольрауша о независимом движении ионов:
. Величину предельного значения молярной электрической проводимости можно рассчитать, используя закон Кольрауша о независимом движении ионов: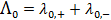 , (3.24)
, (3.24)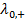 и
и 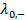 – предельные электрические проводимости ионов, образующих электролит.
– предельные электрические проводимости ионов, образующих электролит.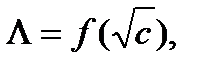 поэтому величину
поэтому величину 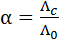 , (3.25)
, (3.25)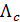 - величина молярной электрической проводимости при заданной концентрации раствора c.
- величина молярной электрической проводимости при заданной концентрации раствора c. 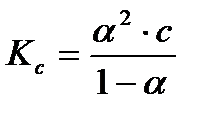 (3.26)
(3.26)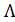 = 371.4×10-4 См×м2/моль. Трихлоруксусная кислота диссоциирует по уравнению
= 371.4×10-4 См×м2/моль. Трихлоруксусная кислота диссоциирует по уравнению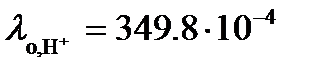 См×м2/моль и
См×м2/моль и 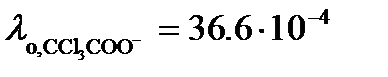 См×м2/моль.
См×м2/моль.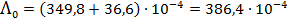 См×м2/моль.
См×м2/моль.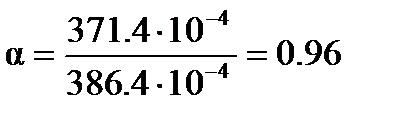 .
.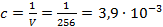 ,
,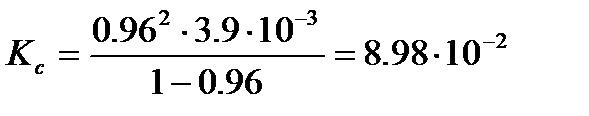
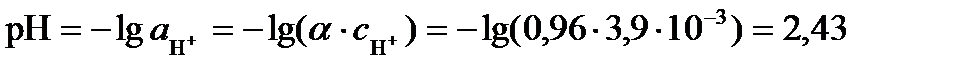
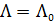 .
. 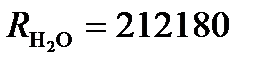 Ом. Вычислим произведение растворимости AgCl, считая, что растворенная соль полностью диссоциирована.
Ом. Вычислим произведение растворимости AgCl, считая, что растворенная соль полностью диссоциирована.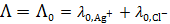 . Из таблицы 65 [2] следует, что
. Из таблицы 65 [2] следует, что 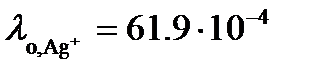 См×м2/моль, а
См×м2/моль, а 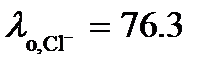 См×м2/моль.
См×м2/моль.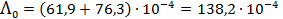 См×м2/моль = 138.2 См×см2/моль.
См×м2/моль = 138.2 См×см2/моль.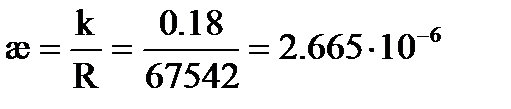 См×см-1,
См×см-1,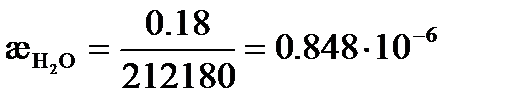 См× см-1,
См× см-1,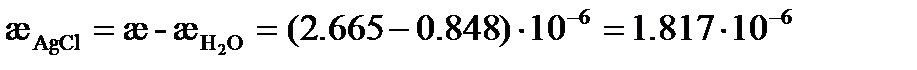 См×см-1.
См×см-1.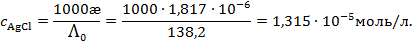
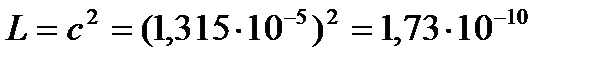 (моль/л)2.
(моль/л)2.