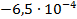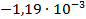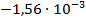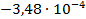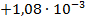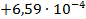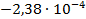Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение термодинамических параметров реакции, протекающей в гальваническом элементе
Для обратимо работающего гальванического элемента при Р и Т = const изменение энергии Гиббса В результате получим выражение:
Изменение энтропии, характеризующее электрохимическую реакцию, равно
Из термодинамики известно, что
Подставим в уравнение (3.16) уравнение (3.14), преобразуем и получим:
Последнее уравнение является одной из форм уравнения Гиббса – Гельмгольца и позволяет рассчитать тепловой эффект реакции, протекающей в элементе, если известны его электродвижущая сила и температурный коэффициент ЭДС При достижении равновесия при Т, Р = const изменение энергии Гиббса равно нулю и для термодинамической константы равновесия электро-химической реакции, протекающей в гальваническом элементе, справедливо:
где
где
Пример: Составим элемент, в котором обратимо протекает реакция:
Используя стандартную ЭДС этого элемента рассчитаем стандартные термодинамические функции этой реакции, константу равновесия при температуре 325 К, если температурный коэффициент стандартной ЭДС составляет Решение: Сначала нужно выяснить, из каких электродов состоит гальванический элемент, на котором протекает данная реакция. В данной реакции серебро окисляется, повышая свою степень окисления, а Запишем электродные реакции, протекающие на электродах с учетом стехиометрических коэффициентов заданной реакции:
и
В суммарной реакции участвуют 2 электрона ( Электрод, на котором протекает реакция окисления (хлорсеребрянный), будет располагаться на схеме гальванического элемента слева, а электрод, на котором идет реакция восстановления (каломелевый), - справа. Электроды второго рода обязательно включают в себя хорошо растворимое соединение с анионом, одноименным аниону малорастворимого соединения. Поэтому хорошо растворимое соединение нужно включить в схему гальванического элемента, несмотря на то, что оно не входит в суммарную реакцию. Гальванический элемент можно представить в виде гальванического элемента с переносомионов через границу раздела жидких фаз (т.е., с двумя жидкими фазами, между которыми располагается мембрана или электролитический мостик):
или без переноса ионов через границу раздела жидких фаз (с одной жидкой фазой, общей для двух электродов):
В таблице 79 [2] найдем стандартные потенциалы хлорсеребрянного и каломелевого электродов: +0,222 В и +0,268 В, соответственно. Стандартная ЭДС данного гальванического элемента при Т = 298 К:
Используя температурный коэффициент ЭДС
По формуле (3.19) найдем
Термодинамическую константу равновесия найдем из формулы (3.18):
Далее по формулам (3.15) и (3.16) рассчитаем изменение энтропии и тепловой эффект реакции при 325 К:
3.1.4 Многовариантное задание №8 «Гальванические элементы» 1. Какого рода левый электрод гальванического элемента А (таблица 3.1)? Напишите уравнение реакции, протекающей на этом электроде в равновесных условиях, и уравнение для расчета потенциала этого электрода. 2. Определите среднюю ионную активность электролита a ± в левом электроде гальванического элемента А на основании справочных значений среднего ионного коэффициента активности электролита [2] при моляльной концентрации m 1 (таблица 3.2) и температуре 298 К. 3. Определите электродный потенциал левого электрода при 298 К. Стандартный электродный потенциал возьмите из справочника [2]. Давление в газовых электродах примите равным стандартному атмосферному давлению. 4. Какого рода правый электрод гальванического элемента А (таблица 3.1)? Напишите уравнение реакции, протекающей на этом электроде в равновесных условиях, и уравнение для расчета потенциала этого электрода 5. Определите среднюю ионную активность электролита a ± в правом электроде гальванического элемента А на основании справочных значений среднего ионного коэффициента активности электролита [2] при моляльной концентрации m 2 (таблица 3.2) и температуре 298 К. 6. Определите электродный потенциал правого электрода при 298 К. Стандартный электродный потенциал возьмите из справочника [2]. Давление в газовых электродах примите равным стандартному атмосферному давлению. 7. Напишите электродные реакции, протекающие на отрицательном и положительном электродах и суммарную химическую реакцию, протекающую самопроизвольно при работе гальванического элемента А. 8. Определите электродвижущую силу (ЭДС) гальванического элемента А и максимальную полезную электрическую работу, которую можно получить при работе данного элемента при температуре 298 К. 9. Вычислите термодинамическую константу равновесия реакции, протекающей самопроизвольно в гальваническом элементе А при температуре 298 К. 10. Составьте гальванический элемент, в котором протекает самопроизвольно химическая реакция В (таблица 3.3). 11. Определите стандартное значение ЭДС гальванического элемента, в котором протекает химическая реакция В, при температуре 298 К на основании стандартных электродных потенциалов из справочника [2]. 12. Определите Е 0при температуре T на основании значения Е 0 при 298 К и величины 13. Определите 14. Определите
15. Определите тепловой эффект 16. Определите термодинамическую константу равновесия химической реакции В при температуре T.
Таблица 3.1 – Варианты заданий
Продолжение таблицы 3.1
Таблица 3.2 – Варианты заданий
Таблица 3.3 – Варианты заданий
Таблица 3.4 – Варианты заданий
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 486; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.13.70 (0.041 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
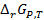 равно максимальной полезной работе W, взятой с обратным знаком
равно максимальной полезной работе W, взятой с обратным знаком 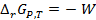 . С другой стороны, электрическая работа, связанная с переносом заряда, соответствующего одному молю вещества, между электродами с разностью потенциалов Е (ЭДС), равна
. С другой стороны, электрическая работа, связанная с переносом заряда, соответствующего одному молю вещества, между электродами с разностью потенциалов Е (ЭДС), равна  (см. выражение (3.5)).
(см. выражение (3.5)).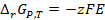 (3.14)
(3.14)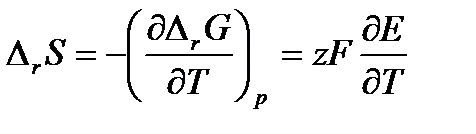 (3.15)
(3.15) (3.16)
(3.16) (3.17)
(3.17) 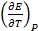 . Знак
. Знак 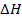 связан со знаком температурного коэффициента ЭДС. Действительно,
связан со знаком температурного коэффициента ЭДС. Действительно, 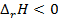 (теплота выделяется), если
(теплота выделяется), если 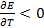 или
или  , но
, но  . Энтальпия увеличивается (
. Энтальпия увеличивается (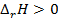 ), если
), если 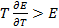 . В последнем случае элемент работает с поглощением теплоты из окружающей среды. Если
. В последнем случае элемент работает с поглощением теплоты из окружающей среды. Если  , то
, то 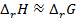 , т.е. в этом случае все тепло практически можно превратить в работу, и коэффициент полезного действия такого элемента приближается к 100%.
, т.е. в этом случае все тепло практически можно превратить в работу, и коэффициент полезного действия такого элемента приближается к 100%.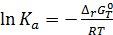 , (3.18)
, (3.18) – изменение энергии Гиббса химической реакции, протекающей при условии, что активности всех компонентов равны единице. По определению стандартный потенциал электрода – это потенциал при активностях окисленной и восстановленной формы равных единице. Стандартная ЭДС – разность стандартных потенциалов. Следовательно,
– изменение энергии Гиббса химической реакции, протекающей при условии, что активности всех компонентов равны единице. По определению стандартный потенциал электрода – это потенциал при активностях окисленной и восстановленной формы равных единице. Стандартная ЭДС – разность стандартных потенциалов. Следовательно, (3.19)
(3.19)  – стандартная ЭДС и стандартные потенциалы положительного и отрицательного электродов, соответственно.
– стандартная ЭДС и стандартные потенциалы положительного и отрицательного электродов, соответственно.
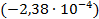 В/К.
В/К. восстанавливается, понижая свою степень окисления. Хлорид серебра
восстанавливается, понижая свою степень окисления. Хлорид серебра 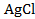 и каломель
и каломель 
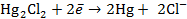
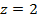 ).
).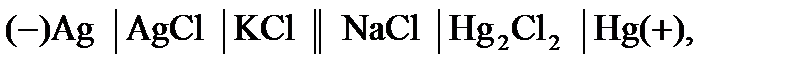

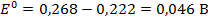
 и приняв, что в указанном интервале температур зависимость Е0 = f (T) линейна, найдем:
и приняв, что в указанном интервале температур зависимость Е0 = f (T) линейна, найдем: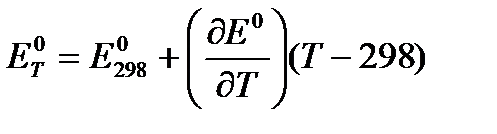
 В.
В.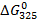 :
: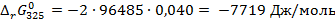

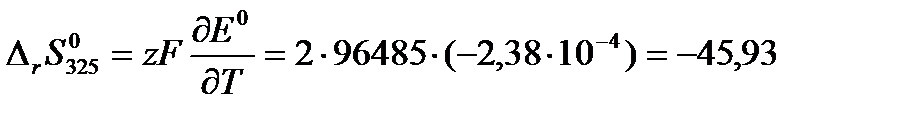 Дж/(моль·К)
Дж/(моль·К)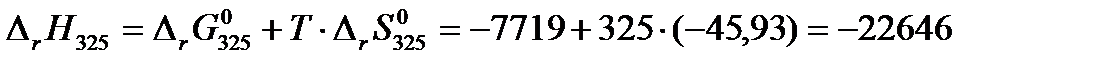 Дж/моль.
Дж/моль.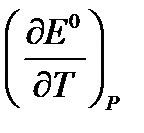 (таблица 3.3), приняв что в указанном интервале температур зависимость Е0 = f (T) линейна.
(таблица 3.3), приняв что в указанном интервале температур зависимость Е0 = f (T) линейна.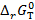 (кДж/моль) реакции В, протекающей в гальваническом элементе при температуре T (таблица 3.4).
(кДж/моль) реакции В, протекающей в гальваническом элементе при температуре T (таблица 3.4). (Дж/(моль∙К)) для реакции В, протекающей в гальваническом элементе при температуре T.
(Дж/(моль∙К)) для реакции В, протекающей в гальваническом элементе при температуре T.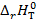 (кДж/моль) реакции В, протекающей в гальваническом элементе при температуре T.
(кДж/моль) реакции В, протекающей в гальваническом элементе при температуре T.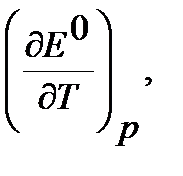 В/К
В/К