
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Метрологические основы аналитической химииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
План: 1. Основные этапы анализа. Метод и методика. 2. Аналитический сигнал: а) полезный аналитический сигнал; б) аналитический сигнал фона. 3. Основные понятия химической метрологии. 4. Классификация погрешностей анализа: а) абсолютная и относительная погрешность; б) систематические, случайные погрешности и промахи. 5. Способы оценки правильности анализа: метод «введено-найдено», использование стандартных образцов, сопоставление с другими методами. 6. Оценка воспроизводимости анализа. 7. Статистическая обработка результатов анализа: а) генеральная совокупность; б) закон нормального распределения (ЗНР) случайных погрешностей; в) t-распределение; г) среднее арифметическое, дисперсное, стандартное отклонение, относительное стандартное отклонение; д) графическое изображение t-распределения; е) доверительный интервал. 8. Проверка однородности результатов анализа. θ-критерий. 9. Сравнение дисперсий (F-критерий) и средних (t-критерий) двух методов анализа. 10. Аттестация аналитических лабораторий. 11. Основные характеристики метода анализа: а) чувствительность; б) избирательность.
1. Химический анализ представляет собой сложный многостадийный процесс, включает следующие этапы: а) выбор метода и схемы анализа; б) отбор пробы; в) пробоподготовка; г) непосредственно определение; д) статистическая обработка результатов анализа. Метод – краткое определение принципов, положенных в основу анализа. Методика – подробное описание всех условий и операций проведения анализа.
Рассмотрим гравиметрический метод Метод основан на определении массы соединения, содержащего анализируемый компонент. В методику анализа входит описание условий осаждения (pH, температура, количество и концентрация осадителя), способ отделения осадка от раствора, условия промывания осадка, перевод определяемого вещества из осаждаемой формы в гравиметрическую. После отбора пробы и подготовки пробы к анализу, приступают непосредственно к химическому анализу, т.е к обнаружению и определению компонента. Для обнаружения компонента используют аналитический сигнал. При определении количества компонента измеряют величину аналитического сигнала. Затем рассчитывают содержание анализируемого компонента используя функциональную зависимость: аналитический сигнал – концентрация:
2. Различают полезный аналитический сигнал и аналитический сигнал фона. Полезный аналитический сигнал представляет собой функцию содержания определяемого компонента. Аналитический сигнал фона обусловлен примесями в растворителях, реактивах, а также шумами приборов. Для учета аналитического сигнала фона проводят холостой опыт. Измеряют аналитический сигнал пробы, несодержащей анализируемый компонент. Затем измеряют аналитический сигнал пробы, содержащей исследуемый компонент. По разности определяют полезный аналитический сигнал, используя градуировочный график. 3. Обычно проводят не одно определение, а несколько параллельных определений (3-5). Затем определяют среднее арифметическое 4. По способу вычисления различают абсолютную и относительную погрешности. Абсолютная погрешность – разность между средним результатом и истинным содержанием. D = Относительная погрешность – отношение абсолютной погрешности к истинному результату По характеру проявления различают систематические, случайные погрешности и промахи. Систематические погрешности вызваны постоянно действующей причиной, их можно выявить и устранить из результатов анализа, они имеют постоянный знак. Систематические погрешности имеют следующую классификацию: а) методические погрешности, обусловленные методикой определения; б) инструментальные погрешности обусловлены применяемыми приборами. в) погрешности, связанные с применяемыми реактивами. По степени чистоты реактивы имеют несколько квалификаций: техн., очищ., чистые, ч.д.а., х.ч., о.с.ч., спектрально чистые. г) индивидуальные погрешности связаны с индивидуальными особенностями работающего аналитика. Случайные погрешности возникают в результате неконтролируемых изменений в процессе эксперимента. Случайные погрешности нельзя измерить, их можно оценить методами математической статистики. Промахи – грубые погрешности, они должны быть выявлены и исключены из результатов анализа. 5. Правильность характеризуется абсолютной и относительной погрешностью. Почему правильность не оценивают по величине абсолютной и относительной погрешности? (т.к. обычно истинное содержание компонента неизвестно). Для оценки правильности анализа используют следующие приемы: 1) метод «введено-найдено»; 2) 2) независимый метод; 3) Метод стандартных образцов. Метод «введено-найдено» имеет две разновидности: а) точно известное количество определяемого компонента вводят в матрицу образца, не содержащего определяемого компонента; б) точно известное количество определяемого компонента добавляют к образцу, содержащему определяемый компонент (метод добавок). Рассмотрим первую разновидность метода. Готовят искусственную смесь, состоящую из Cu, Zn, Al. В эту матрицу вводят точно известное количество Ni – x1. Проводят анализ и определяют содержание Ni- Относительную погрешность определяют по формуле: Если D небольшая, то метод считается правильным. Недостатками этого метода являются: а) не учитывается, что сплав имеет более сложный состав, чем искусственная смесь; б) нужно провести пробоотбор и пробоподготовку. Метод добавок В этом случае анализируют не искусственную смесь, а сам сплав. Берут навеску сплава, его растворяют в кислоте и определяют содержание никеля - Погрешность рассчитывают по формуле:
Анализ считается идеальным, если x совпадает с xдоб. Результаты считаются правильными, если D невелика. Метод является более точным. Независимый метод При использовании этого метода необходимо соблюдать 2 условия: а) выбранный для сравнения метод должен дать правильный результат; б) должен принципиально отличаться от изучаемого метода. Например, при определении содержания никеля в латуни комплексонометричесим методом для сравнения используют гравиметрический метод. Содержание Ni, определенное гравиметрическим методом, берется за истинное.
ЛЕКЦИЯ № 8 Самым надежным методом выявления систематических погрешностей является метод стандартных образцов. Стандартные образцы (СО) – это образцы из материала, состав и свойства которого надежно установлены и удостоверены государственным учреждением. Каждый СО снабжен паспортом, в котором указывается истинное содержание компонента. Готовят СО I разряда для металлов, сплавов, горных пород, лекарственных препаратов. СО I разряда готовят специализированные лаборатории. Затем их рассылают не менее, чем в 25-30 лабораторий страны. В каждой лаборатории образец анализируется не менее чем двумя различными методами и двумя аналитиками. Проводят пять параллельных определений и три определения методом добавок. Полученные результаты посылают в специализированную лабораторию и обрабатываются методами математической статистики. Труднее всего готовить СО II разряда для пищевых продуктов и объектов окружающей среды. На основе реальных объектов готовят СО и содержание их определяют по СО I разряда. 6. Для оценки правильности результатов анализа СО можно использовать в том случае, когда состав и свойства анализируемой пробы и СО совпадают. Основные понятия химической метрологии Генеральная совокупность - гипотетическая совокупность всех мыслимых результатов от -∞ до +∞. Выборочная совокупность 9выборка) - реальное число измерений, которое имеет исследователь (обычно n=3-5). При n > 20-30 с достаточной степенью приближения и при n >50-100 с хорошим приближением выборка переходит в генеральную совокупность. При наличии генеральной совокупности результаты химического анализа подчиняются закону нормального распределения (ЗНР). Для обработки малого числа измерений используют распределение Стьюдента. Основными параметрами ЗНР являются: математическое ожидание (μ), дисперсия σ2, стандартное отклонение. Математическое ожидание (генеральное среднее) – среднее из бесконечного числа измерений. При отсутствии систематических погрешностей, μ равно истинному содержанию. Дисперсия σ2 характеризует разброс результатов относительно μ. Стандартное отклонение σ тоже характеризует разброс результатов относительно μ. Основными параметрами t-распределения являются дисперсия V, стандартное отклонение S и относительное стандартное отклонение Sr. Дисперсия V характеризует разброс результатов относительно среднего арифметического. S и Sr тоже характеризуют рассеяние результатов параллельных определений.
t-распределение зависит от объема выборки, т.е. от числа параллельных определений. Для того чтобы исключить это влияние вводится понятии степень свободы f=n-1 (исключается одна степень свободы, связанная с определением среднего). ЗНР связывает вероятность появления отклонения с величиной отклонения (x- μ).
t-распределение связывает между собой ширину доверительного интервала, доверительную вероятность и объем выборочной совокупности. Графическое изображение распределения случайных погрешностей называется кривой распределения.
Выводы по кривой распределения: 1. Кривые распределения зависят от величины дисперсии, и, следовательно, от стандартного отклонения σ. Чем больше σ, тем больше разброс результатов. 2. Симметричные кривые показывают равную вероятность появления как отрицательных, так и положительных погрешностей. 3. Вероятность появления малых погрешностей значительно больше, чем вероятность появления больших погрешностей. Кривые t-распределения зависят от тех же факторов, что и кривые ЗНР. Кроме этого они еще зависят от числа измерений. По t-распределению можно определить доверительный интервал ∆x. Эта область, внутри, которой находится истинное значение измеряемой величины с заданной доверительной вероятностью
Доверительная вероятность p – это вероятность попадания случайной величины в заданный доверительный интервал. Обычно при расчетах p=0,95. Если известно истинное содержание x компонента, то можно и охарактеризовать правильность анализа.
8. Прежде всего проводить статистическую обработку, необходимо выявить промахи и исключить их из результатов анализа. Для этого используют θ-критерий при n≥5.
x2 – соседний с промахом результат xmax и xmin –максимальное и минимальное значение в выборке. xmax - xmin – размах варьирования θэксп сравнивают с θтабл, если θэксп > θтабл, то результат является промахом, его исключают. Если θэксп < θтабл, то результат оставляют в выборке.
9. Чтобы оценить сходимость результатов анализа одного и того же объекта, полученные двумя разными методами, в двух разных лабораториях проводят сравнение дисперсий двух методов. Для этого используют критерий Фишера (F-критерий). Fэксп. сравнивают с Fтабл учитывая, что числа степеней свободы выборки с большей дисперсией располагается в горизонтальном ряду таблиц, а числа степеней свободы выборки с меньшей дисперсией – в вертикальном ряду. Если Fэксп < Fтабл, различие между двумя выборками незначимо. Если Fэксп > Fтабл, различие между двумя выборками значимо, результаты двух методов отличаются по воспроизводимости. Если расхождение между дисперсиями незначимо, сравнивают
Сравнивают tэксп c tтабл при p=0,95 и f=n1 + n2 – 2. Если tэксп < tтабл, то расхождение незначимо, результаты двух выборок можно объединить в одну выборку. Если tэксп > tтабл, расхождение значимо, следует искать систематическую погрешность. 10. Чтобы аналитическая лаборатория могла проводить анализы и результаты анализа были признаны, она должна пройти аттестацию. По результатам аттестации лаборатории присваивается категория. При аттестации используют поэлементную и комплексную поверку. Поэлементная поверка – проверяют мерную посуду, аналитические весы и другие приборы. Комплексная поверка – проверяют правильность результатов анализа. работникам лаборатории выдают СО, их анализируют несколькими надежными методами. Полученные результаты сравнивают с паспортными данными СО.
11. Основными характеристиками метода являются точность, чувствительность, избирательность. Чувствительность характеризуется пределом обнаружения и нижней границей определяемых содержаний. Предел обнаружения –это наименьшее содержание, при котором по данной методике можно обнаружить присутствие компонента с заданной доверительной вероятностью. Предел обнаружения задается в виде cmin и mmin. mmin –минимальное количество, при котором данный компонент может быть обнаружен с достаточно высокой заданной вероятностью. cmin
S – коэффициент чувствительности; Sфон – стандартное отклонение аналитического сигнала фона. Sфон определяют из большого числа параллельных определений (n≥ 20). В этом случае выборка с достаточной степенью приблежения переходит в генеральную совокупность Sфон ≈σ. S определяют из градуировочного графика:
Чем меньше S, тем метод более чувствителен. Нижняя граница определяемых содержаний – это наименьшее содержание компонента, определяемого по данной методике. За нижнюю границу определяемых содержаний принимают минимальную концентрацию, которую можно определить с Sr ≤ 0,33.
ЛЕКЦИЯ 9
Различают избирательность метода, методики и отдельной реакции. Избирательными называются те методы, с помощью которых можно обнаружить или определить компонент без помех со стороны других присутствующих компонентов. Если метод или методика позволяют определять только один компонент, их называют специфичными. Избирательными могут быть также реакции. По избирательности реакции делятся на 3 группы: а) групповые –реакции, проводимые с применением групповых реагентов (H2SO4, HCl, NaOH, NH3водн).; б) избирательные – реакции, проводимые с применением избирательных реагентов, которые позволяют определять данный ион в присутствии ограниченного числа ионов. в) специфические реакции – реакции, проводимые с применением специфических реагентов, которые позволяют определять данный ион в присутствии всех мешающих ионов. Реакцию можно сделать избирательной, если: а) создать определенное значение pH; б) маскировать мешающий ион; в) перевести мешающий ион в другое валентное состояние.
Тема: Методы разделения и концентрирования ЭКСТРАКЦИЯ План: 1. Основные законы и количественные характеристики экстракции. 2. типы экстракционных систем. 3. Классификация экстракционных процессов. 4. Практическое значение экстракции.
1. Экстракция – это процесс переноса вещества из водного раствора в слой несмешивающегося с водой органического растворителя. Органическая фаза, отделенная от водной фазы и содержащая экстрагированное соединении, называется экстрактом. Органические растворители, применяемые для экстракции, называются экстрагентами. Процесс обратимый экстракции, называется реэкстракцией. В основе экстракции лежит закон распределения. Если к двум несмешивающимся жидкостям прибавить вещество, которое растворяется в обеих этих жидкостях, то вещество распределится так, что его концентрации в той и другой жидкости будут находится в постоянном отношении, называемом коэффициентом распределения. Пусть вещество А из водной фазы переходит в органическую фазу за счет массопереноса. Через некоторое время устанавливается динамическое равновесие: Ав ↔ Ао.
Если концентрация вещества А мала и I=0 или I=const и вещество находится в обеих фазах в одной и той же форме, используют концентрационную константу распределения КД.
Если вещество находится в растворе в разных формах, используют условную константу распределения и она называется коэффициентом распределения Д.
Чем больше вещество А растворяется в органической фазе, тем больше Д и тем полнее происходит экстрагирование. Другой характеристикой экстракции является степень экстракции (степень извлечения) –R.
Фактор разделения – это отношение коэффициентов распределения двух разделяемых веществ. Если S ≥ 104, происходит количественное разделение вещества. Следующая характеристика –константа экстракции Равновесие при экстракции ВКС HLn можно представить следующим образом: Mn+в + nHLo ↔ MLno + nH+в: HLo –молекула органического реагента
Кэксп зависит от природы экстрагируемого соединения, органического лиганда, pH раствора, от количества органического реагента. 2. Основные типы экстрагирующих систем: 1) простые соединения с ковалентной связью: I2, HgCl2, AsCl3, SBCl3, GeCl4, бромиды и иодиды hg, As, Sn, Ge, оксиды (RuO4, OsO4). 2) ВКС (дитизонаты, 8-оксихинолинаты). Если Zn экстрагировать хлороформом или CCl4, он не экстрагируется. Его переводят в дитизонат, который хорошо экстрагируется CHCl3. 3) Кислоты (простые, комплексные, гетерополикислоты). 4) Ионные ассоциаты (соединения крупных катионов с крупными анионами). 3. Виды экстракции: а) периодическая (простая); б) непрерывная; в) противоточная. Периодическую экстракцию проводят в делительной воронке, в которой находится водный раствор исследуемого вщества и органический растворитель. Содержимое воронки хорошо перемешивают, отстаивают и сливают органический или водный слой. Затем добавляют новую порцию органического растворителя. Эту операцию повторяют 5-6 раз. Если Д велик, то можно исследуемое вещество количественно переводить в органическую фазу. Непрерывная экстракция осуществляется при непрерывном и относительном перемещении двух фаз, водная фаза является неподвижной. Непрерывная экстракция осуществляется в специальных приборах. Противоточная экстракция осуществляется при встречном движении фаз. 4. а) Экстракцию применяют для разделения веществ, если проводить в специфических условиях (pH, маскировка); б) для концентрирования веществ, что позволяет повышать чувствительность метода; в) для определения вещества.
ЛЕКЦИЯ № 10
|
||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 2724; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.89.8 (0.011 с.) |


 . Когда истинное содержание определяемого компонента не совпадает со
. Когда истинное содержание определяемого компонента не совпадает со 







 ≥
≥  систематическая погрешность есть
систематическая погрешность есть ; x1 –результат который считается промахом.
; x1 –результат который считается промахом. V1>V2.
V1>V2. и
и 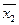 двух методов:
двух методов: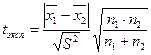

 - средняя дисперсия
- средняя дисперсия –минимальная концентрация, при которой данный компонент может быть обнаружен с достаточно высокой доверительной вероятностью.
–минимальная концентрация, при которой данный компонент может быть обнаружен с достаточно высокой доверительной вероятностью.


 ,
,  - термодинамическая константа распределения, зависит от температуры, природы экстрагируемого соединения. Эту формулу используют, если вещество А находится в водной и органической фазах в одной форме.
- термодинамическая константа распределения, зависит от температуры, природы экстрагируемого соединения. Эту формулу используют, если вещество А находится в водной и органической фазах в одной форме.
 , Д зависит от pH водной фазы, концентрации экстрагента, от объемов фаз не зависит.
, Д зависит от pH водной фазы, концентрации экстрагента, от объемов фаз не зависит. - это отношение количества вещества в органической фазе к общему количеству вещества в обеих фазах.
- это отношение количества вещества в органической фазе к общему количеству вещества в обеих фазах.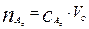
 +
+ 
 +
+ 
 =
= 

 , если Vв = Vo
, если Vв = Vo Чем больше объем органической фазы, тем больше R, тем более полнее происходит экстракция.
Чем больше объем органической фазы, тем больше R, тем более полнее происходит экстракция. Д1 >Д2
Д1 >Д2 , где
, где 




